废纸造纸废水化学沉淀法除钙研究*
2020-12-23战晓慧张小红沈海涛史惠祥
战晓慧 张 辉 张小红 沈海涛 史惠祥# 姚 熠
(1.浙江大学环境与资源学院,浙江 杭州 310058;2.浙江景兴纸业股份有限公司,浙江 嘉兴 314000;3.嘉兴市环境科学研究所有限公司,浙江 嘉兴 314000)
造纸工业是我国的支柱产业之一,发展迅速,纸张产量逐年增加。随着造纸技术的变革和发展,CaCO3作为填料和涂料得到广泛应用。CaCO3能够极大提高纸张油墨吸收性能、纸张白度、不透明度和表面性能,减少纤维用量,降低生产成本[1]。近年来为有效控制成本,废纸造纸的发展趋势明显[2]。废纸造纸过程中会产生大量的造纸废水,且废纸中的钙会转移至废水中。另外,为减少造纸行业排水量,废纸造纸企业将废水经过深度处理后回用至生产线,提高废水的回用率,降低排水量,但Ca2+会在废水处理系统中不断积累。
废水中Ca2+过高会引起设备和管道结垢,甚至堵塞[3];在厌氧系统中引起颗粒污泥钙化,使反应器堵塞,影响厌氧污泥性能和厌氧处理效率[4];在反渗透系统中堵塞反渗透膜,影响出水水质[5]。
因此,解决造纸系统的钙积累问题,寻求高效的造纸废水除钙技术具有重要意义。目前,除钙技术主要有离子交换法、吸附法、膜分离法、电化学法和化学沉淀法等。化学沉淀法基于溶度积原理,通过向废水中投加化学药剂,使之与Ca2+反应生成沉淀,达到除钙目的。化学沉淀法的去除效率很高,但是投加量过大会严重影响出水水质。因此,化学药剂量一定要精确,以保障出水水质的稳定。
本研究选取化学沉淀法去除造纸废水中的Ca2+,对废纸造纸企业中水回用系统的钙污染物进行特征分析,了解现有Ca2+浓度下中水回用系统的结垢情况;探究不同化学药剂对Ca2+的去除效果及CaCO3的沉降性能;探究不同化学药剂对Ca2+的去除机理。通过对化学沉淀法去除造纸废水钙污染物的工艺研究,为造纸废水钙污染治理提供依据和技术支持。
1 材料与方法
1.1 实验材料
实际废水取自嘉兴市废纸造纸企业A(以下简称企业A)二沉池出水、废纸造纸企业B(以下简称企业B)三沉池出水;KCl、CaCl2、NaHCO3、Na2CO3、Ca(OH)2、NaOH、CaCO3、La2O3、聚丙烯酰胺、HgSO4、MgCl2、Ag2SO4、Na2SO4为分析纯,K2Cr2O7、HNO3、H2SO4、HCl、乙炔为优级纯。
1.2 实验方法
1.2.1 现场调研
选取两家废纸造纸企业,对其废水处理系统进行现场调研,统计2018年9月至2019年6月各主要处理单元出水的COD、悬浮物(SS)、Ca2+等水质情况。
1.2.2 投加量实验
模拟废水投加量实验:模拟废水现用现配。投加不同方案的化学药剂至溶液中(见表1),以400 r/min快速搅拌1 min,然后以100 r/min慢速搅拌2 min,最后静置沉淀60 min。投加药剂之前和搅拌结束后定时在溶液液面下方5 cm处用10 mL注射器取上清液,经过0.45 μm滤膜过滤后取1 mL移至50 mL容量瓶,滴加1~2滴HNO3酸化并稀释定容,随后测定Ca2+。
实际废水投加量实验:准确量取1 000 mL实际废水于1 L烧杯中,投加一定量的化学药剂至溶液中,以模拟废水投加量实验相同的水力条件进行实验,并在相同取样时间取上清液,经过处理后测定Ca2+。
沉降性能测试:反应结束后测定沉降体积、浊度变化、Zeta电位和粒径分布。
1.3 分析与检测
本研究涉及的测试项目、方法与仪器列于表2。
2 结果与讨论
2.1 废纸造纸企业中水回用系统的钙污染物特征分析
2.1.1 企业A、B废水处理概况
企业A位于浙江省平湖市,目前厂区实际日均废水产生量约23 500 m3/d。企业现有废水处理设施两座,其中预处理设施设计处理规模25 000 m3/d;厌氧反应塔4座,设计处理规模36 000m3/d;好氧处理系统两套,设计处理规模32 000m3/d;中水回用系统两套(并联),设计处理规模13 500 m3/d,产水量7 500 m3/d。
在2018年9、12月与2019年3、6月,对企业A的各废水处理单元出水取样,检测了pH、SS、COD、氨氮、TP和Ca2+,结果见表3。
经过企业A整个废水处理系统,COD大致由6 400 mg/L降至170 mg/L,总去除率为97.34%;SS大致由2 700 mg/L降至90 mg/L,总去除率为96.67%;Ca2+大致由1 000 mg/L降至400 mg/L,总去除率为60.00%。pH、氨氮和TP均符合《制浆造纸工业水污染物排放标准》(GB 3544—2008)排放要求。厌氧反应塔进水Ca2+为900 mg/L,会使厌氧颗粒污泥钙化,失去活性,影响厌氧系统的运行效果;中水回用系统进水的Ca2+为400 mg/L,会形成钙沉淀积累在反渗透膜表面,造成膜堵塞。

表1 化学药剂的投加方案

表2 主要测试项目、方法与仪器
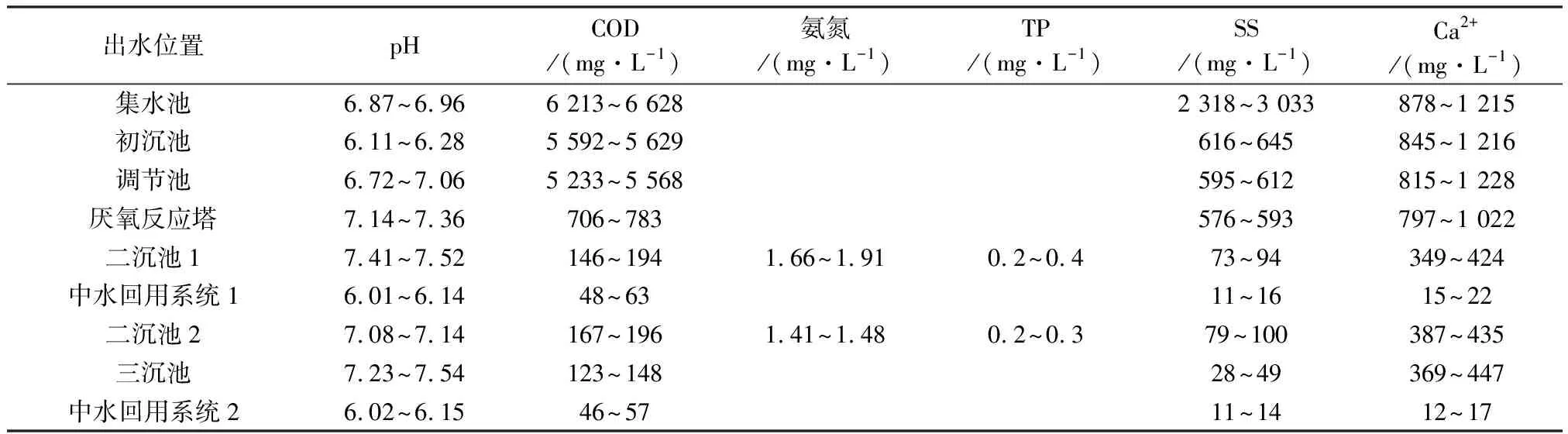
表3 企业A废水处理出水水质
企业B位于浙江省嘉兴市,设计处理规模20 000 m3/d,回用规模2 400 m3/d。企业B实际日均废水处理量9 026 m3/d,回用水量2 400 m3/d。企业B同期的各废水处理单元出水水质的检测结果见表4。
经过企业B废水处理系统,COD大致由6 200 mg/L降至150 mg/L,总去除率为97.58%;SS大致由1 300 mg/L降至125 mg/L,总去除率为90.54%;Ca2+大致由1 700 mg/L降至400 mg/L,总去除率为76.47%。pH、氨氮和TP均符合GB 3544—2008排放要求。厌氧反应塔和中水回用系统进水的Ca2+浓度同样也偏高。
对两个企业进入中水回用系统前的沉淀池——企业A的二沉池(以二沉池1为例进行研究)、企业B的三沉池出水取样,检测水中阴离子和金属元素含量,结果分别见表5和表6。
企业A二沉池、企业B三沉池出水中的Ba、
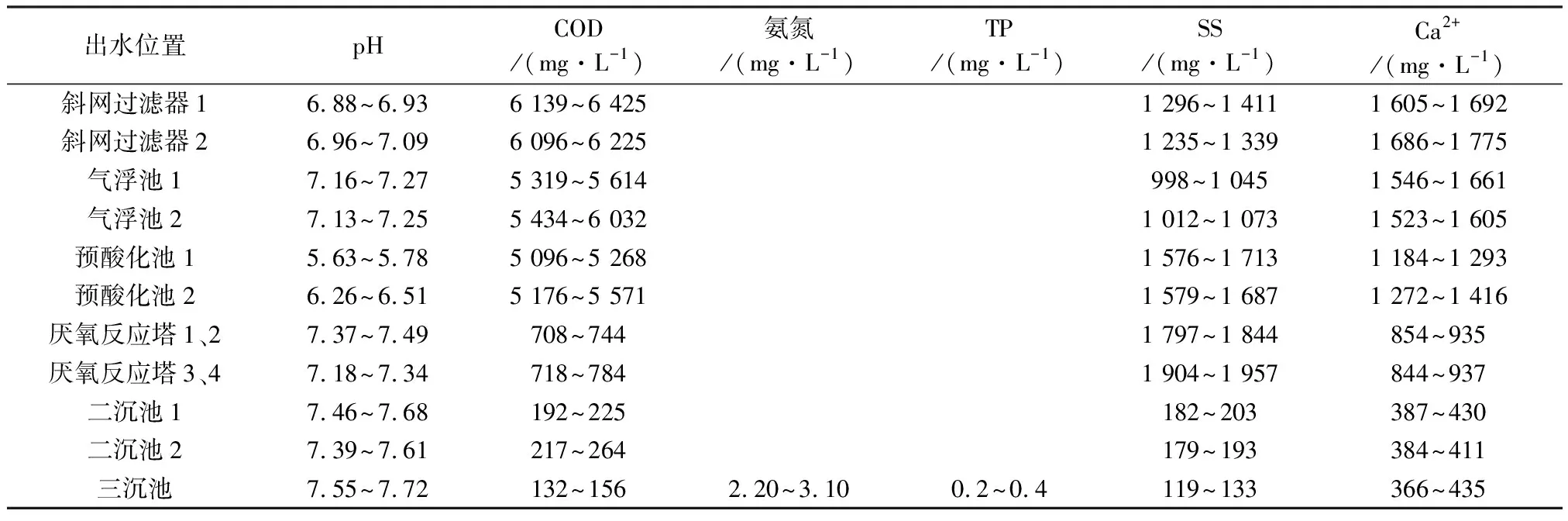
表4 企业B废水处理出水水质

表5 沉淀池出水阴离子质量浓度

表6 沉淀池出水金属元素质量浓度
Cu、Fe和Mn较低,均不超过1 mg/L;Ca和Na较高,在企业A中平均值分别是395、328 mg/L,在企业B中为392、301 mg/L,且Ca是Mg的10倍左右,属于超高硬水(Ca质量浓度280~400 mg/L),容易引起管道结垢,反渗透膜堵塞。
2.1.2 中水回用系统结垢分析
(1) CaCO3结垢的判断
CaCO3结垢的判断研究较为成熟,普遍采用朗格利尔指数进行判断。朗格利尔指数计算方法见式(1)。
IL=p-pS
(1)
式中:IL为朗格利尔指数;p为实测水pH;pS为水的饱和pH,指温和状态下,水中的碳酸盐平衡时应具有的pH,参照文献[6]计算。IL>0时,是结垢性水;IL<0时,是腐蚀性水。
结合文献[7]的数据及式(1)计算得出,企业A二沉池和企业B三沉池出水的朗格利尔指数分别为1.31、1.53,易形成CaCO3沉淀。
(2) CaSO4结垢的判断
利用溶解平衡法,通过模型假设和模型求解,可得到CaSO4饱和指数方程,判断CaSO4的结垢倾向[8]。CaSO4饱和指数与离子强度、温度有关,具体见式(2)。
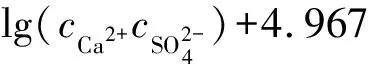
(2)
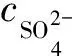
IS>0时,会形成CaSO4沉淀;IS=0时,处于平衡状态;IS<0时,不会形成CaSO4沉淀。计算得出,企业A二沉池和企业B三沉池出水的CaSO4饱和指数分别为-0.472、-0.466,不易形成CaSO4沉淀。
2.2 化学沉淀法除钙工艺研究
2.2.1 确定药剂方案与投加量
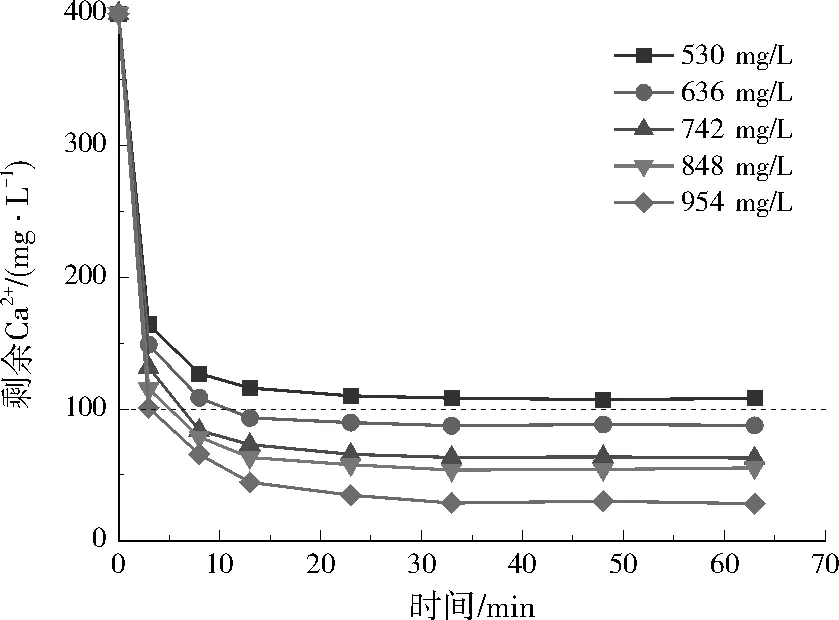
注:图中虚线指示回用水Ca2+限值(100 mg/L),下同。图1 不同Na2CO3投加量对模拟废水剩余Ca2+质量浓度的影响Fig.1 Effect of different Na2CO3 dosage on residual Ca2+ concentration in simulated wastewater
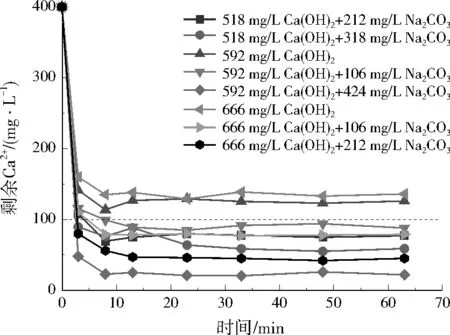
图2 不同Ca(OH)2和Na2CO3投加量对模拟废水剩余Ca2+质量浓度的影响Fig.2 Effect of different Ca(OH)2 and Na2CO3 dosage on residual Ca2+ concentration in simulated wastewater
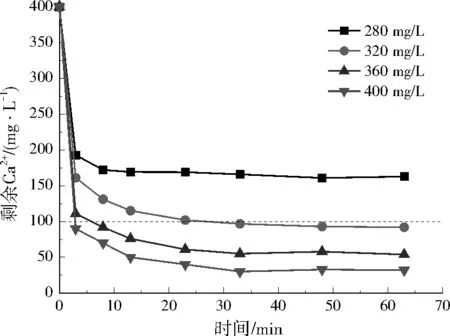
图3 不同NaOH投加量对模拟废水剩余Ca2+质量浓度的影响Fig.3 Effect of different NaOH dosage on residual Ca2+ concentration in simulated wastewater
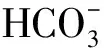
实际废水最佳投药量以企业A的二沉池出水为对象进行阐述,结果见图4至图6。
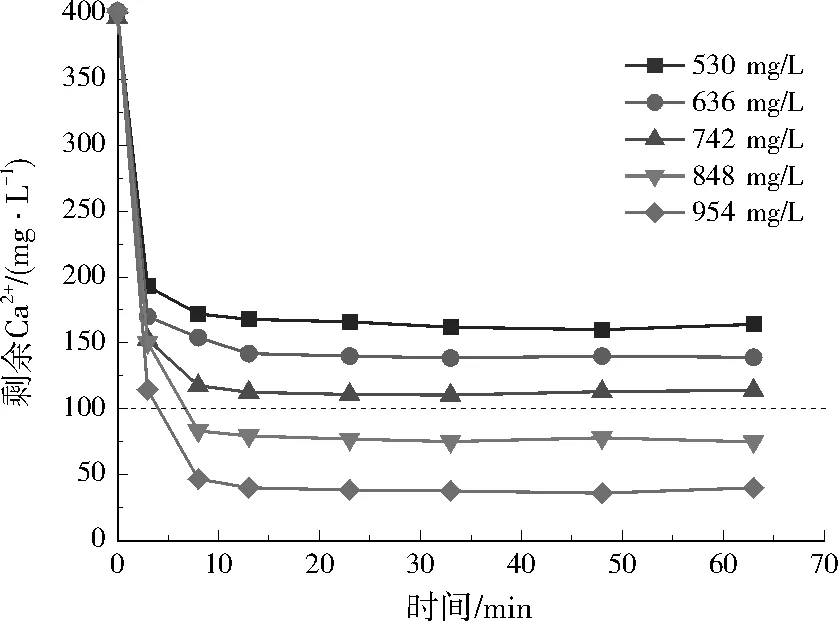
图4 不同Na2CO3投加量对实际废水剩余Ca2+质量浓度的影响Fig.4 Effect of different Na2CO3 dosage on residual Ca2+ concentration in actual wastewater
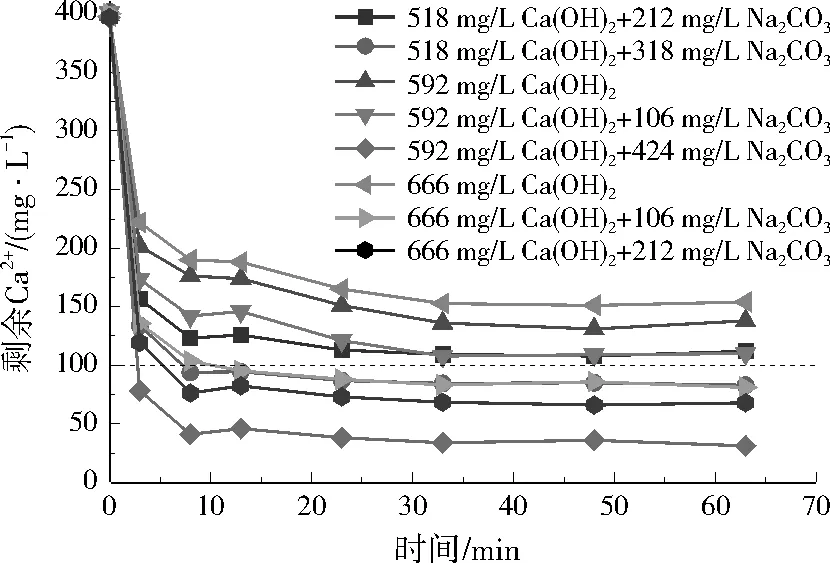
图5 不同Ca(OH)2和Na2CO3投加量对实际废水剩余Ca2+质量浓度的影响Fig.5 Effect of different Ca(OH)2 and Na2CO3 dosage on residual Ca2+ concentration in actual wastewater
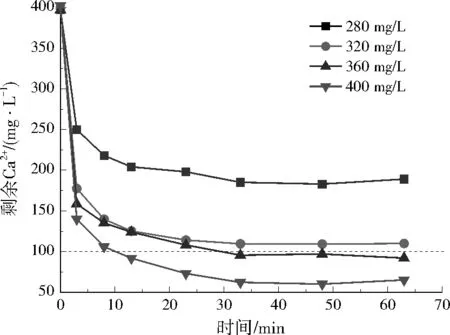
图6 不同NaOH投加量对实际废水剩余Ca2+质量浓度的影响Fig.6 Effect of different NaOH dosage on residual Ca2+ concentration in actual wastewater
在实际废水中,3种方案反应3 min内Ca2+去除效果明显,Ca2+浓度迅速降低。方案1在反应20 min左右Ca2+浓度几乎稳定;随Na2CO3投加量增加,剩余Ca2+浓度逐渐降低;结合经济性考虑,Na2CO3在实际废水中最佳投加量为848 mg/L。方案2中,反应3 min后Ca2+浓度下降缓慢,30 min后趋于稳定;8组投药方案中,4组满足要求;考虑经济性,Ca(OH)2和Na2CO3在实际废水中最佳投加量分别为666、106 mg/L。方案3中,30 min内,Ca2+浓度明显降低,30 min后基本保持不变;结合经济性考虑,NaOH在实际废水中的最佳投加量为360 mg/L。
2.2.2 CaCO3沉降性能研究
依据前文确定的模拟废水药剂最佳投加量,从沉降体积、浊度、Zeta电位和粒径4个方面分别对3种投药方案析出的CaCO3展开沉降性能的研究。
由图7可知,沉降60 min后,3种方案污泥沉降体积分别为83、91、10 mL,方案3的沉降速度远大于方案1、2。由图8可知,沉降45 min时,方案1、2的浊度稳定在185 NTU左右,而方案3在沉降20 min时已经非常澄清,浊度接近于0 NTU。Zeta电位绝对值越小,颗粒之间越容易凝聚。方案1、2的Zeta电位绝对值为13.61、13.12 mV,方案3为2.59 mV,说明方案3中CaCO3颗粒团聚沉降性能好。由图9可知,方案3的CaCO3颗粒粒径明显大于方案1、2。
综上,方案1、2中CaCO3颗粒粒径较小,沉降速度慢,且不易团结凝聚;方案3的CaCO3颗粒粒径较大,沉降速度快,且容易团结凝聚。从沉降体积、浊度、Zeta电位和颗粒粒径4个方面分析,方案3的沉降性能优于方案1、2。
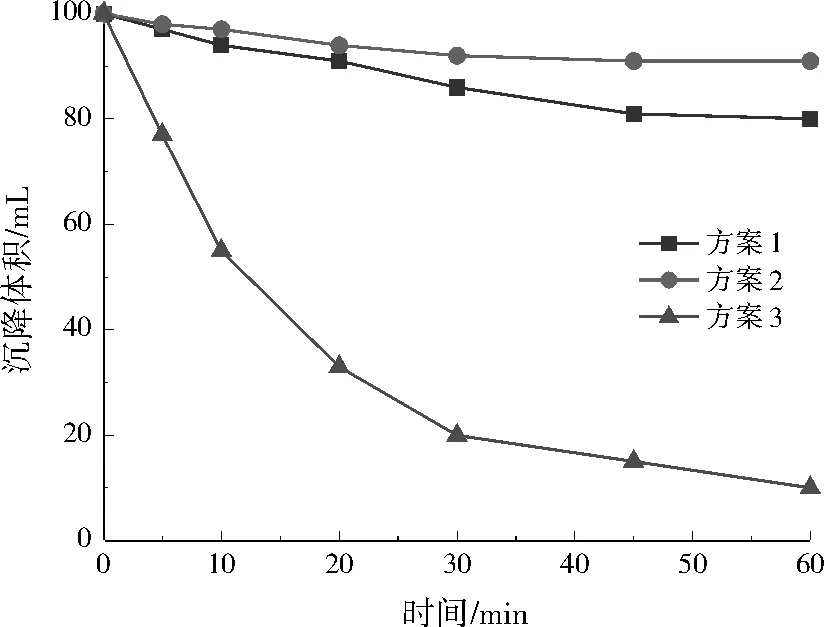
图7 不同投药方案对CaCO3沉降体积的影响Fig.7 Effect of different dosing schemes on the settling volume of CaCO3
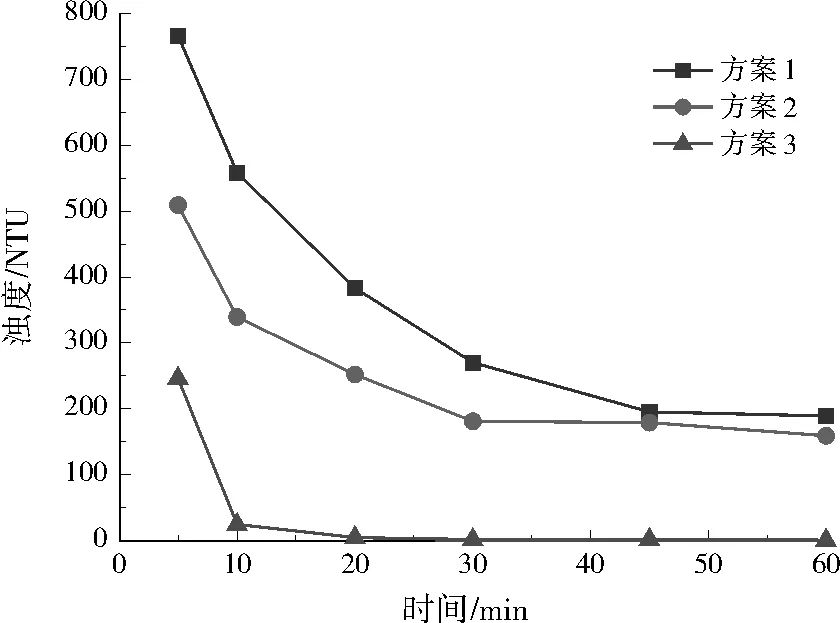
图8 不同投药方案对浊度的影响Fig.8 Effect of different dosing schemes on turbidity
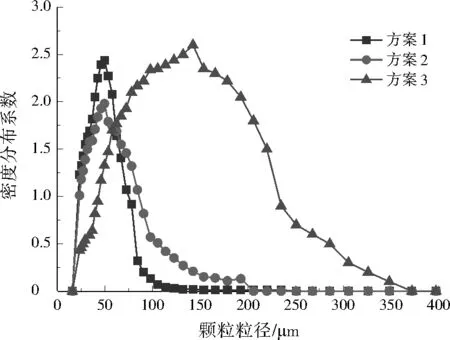
图9 不同投药方案对颗粒粒径的影响Fig.9 Effect of different dosing schemes on particle size
2.3 化学沉淀法除钙机理研究
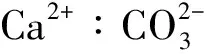
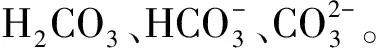
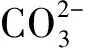
(3)
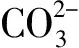
(4)
(5)
(6)
(7)
3 结 论
(1) 调研嘉兴市两家废纸造纸企业,出水pH、氨氮和TP均符合GB 3544—2008排放要求。通过计算朗格利尔指数和CaSO4饱和指数,可知两家企业中水回用系统的进水均易形成CaCO3沉淀,不易形成CaSO4沉淀。
(2) 采用3种不同的投药方案除钙,针对模拟废水,最佳投加量为636 mg/L Na2CO3、592 mg/LCa(OH)2+106 mg/L Na2CO3或320 mg/L NaOH;针对实际废水,最佳投加量为848 mg/L Na2CO3、666 mg/L Ca(OH)2+106 mg/L Na2CO3或360 mg/L NaOH。从沉降体积、浊度、Zeta电位和粒径分布分析发现,方案3的CaCO3沉降性能优于方案1、2。
