过表达硫氧还蛋白-1抑制戊四氮致癫痫大鼠海马神经元细胞凋亡①
2020-12-23周弟弥
甘 露 周弟弥 张 磊 陈 琳
(南华大学附属第二医院神经内科,衡阳 421001)
癫痫是全球常见的慢性神经系统疾病,发病机制复杂,目前尚未明确。任何引起大脑生理结构或功能紊乱的因素均可能导致癫痫,威胁各年龄阶段人群[1,2]。研究报道,全球约有7 000万癫痫患者,我国癫痫患者约占全球的13%[3]。目前,癫痫的主要治疗方式是抗癫痫药物治疗,但仍有25%~30%的患者发展为耐药性癫痫,治疗效果并不理想[4]。寻找治疗癫痫的新方法成为急需解决的问题。硫氧还蛋白(thioredoxin,Trx)是一种广泛存在于生物体内的抗氧化分子,可通过抗氧化效应减轻神经元氧化应激损伤,具有显著的神经保护作用[5]。Trx与Trx还原酶(TrxR)及还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate oxidase,NADPH)组成硫氧还蛋白系统,发挥抗氧化功能,并参与调控戊四氮(pentylenetet-razol,PTZ)点燃致癫痫小鼠模型氧化应激过程[6,7]。Trx-1是Trx蛋白家族中的主要成员,参与氧化还原反应,并通过凋亡信号通路调控细胞凋亡[8]。本研究拟通过PTZ诱导大鼠癫痫模型,并采用Trx-1过表达慢病毒进行干预,探讨其对大鼠海马组织神经元损伤及细胞凋亡的影响,以期为癫痫的临床治疗提供新思路。
1 材料与方法
1.1材料
1.1.1实验动物 40只健康清洁级SD大鼠(长沙市天勤生物技术有限公司),动物合格证号:SCXK(湘)2014-0010,体质量230~250 g,7~8周龄。
1.1.2试剂 载体(上海吉凯基因化学技术有限公司);引物(南京金斯瑞生物科技有限公司);TRIzol、反转录试剂盒(大连TaKaRa公司);SYBR Green PCR试剂盒(美国KAPA Biosystems公司);BCA蛋白浓度测定试剂盒(北京康为世纪公司);兔抗Trx-1多克隆抗体(美国CST公司,货号:#2298);兔抗B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)多克隆抗体、兔抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)多克隆抗体、兔抗磷酸化c-Jun末端激酶(phospho c-Jun N-terminal kinase,p-JNK)单克隆抗体、兔抗凋亡信号调节激酶1(apoptosis signal regulating kinase-1,ASK1)多克隆抗体(美国Abcam公司,货号:ab 196495、ab53154、ab124956、ab1315 06);TUNEL细胞凋亡检测试剂盒(美国Promega公司)。
1.1.3仪器 ChemiDoc Touch系统(美国Bio-Rad公司)。
1.2方法
1.2.1Trx-1过表达重组慢病毒载体设计及合成 根据Trx-1基因序列,设计合成含Trx-1和绿色荧光蛋白(green fluorescent protein,GFP)的慢病毒载体(ov-Trx-1-GFP)及阴性对照慢病毒载体(NC-GFP),慢病毒载体滴度为5×108TU/ml。
1.2.2动物分组及处理 40只SD大鼠随机分为4组:对照组、模型组、Trx-1过表达组和阴性对照组,每组10只。大鼠腹腔注射0.5%戊巴比妥钠溶液(40 mg/kg),麻醉后固定于立体定位仪中,Trx-1过表达组大鼠两侧海马区注射2.5 μl ov-Trx-1-GFP慢病毒溶液,阴性对照组大鼠于相同位置注射等量的NC-GFP慢病毒溶液,对照组和模型组注射等量生理盐水。慢病毒转染大鼠海马区14 d后构建PTZ点燃癫痫模型。
1.2.3建模 除对照组外,其他组大鼠腹腔反复注射PTZ(35 mg/kg),对照组注射等量生理盐水,1次/d。注射PTZ 1 h后观察大鼠状态及行为变化,记录大鼠癫痫惊厥情况。根据Smialowki癫痫发作分级标准评估大鼠癫痫惊厥级别,0级:无反应;1级:面部运动,指鼻子、点头、奔跑;2级:前肢痉挛;3级:前肢痉挛伴后退;4级:前肢痉挛伴后退及摔倒发作;5级:摔倒、强直发作[9]。连续注射3 d PTZ后,大鼠的癫痫发作级别均为4~5级则视为建模成功。模型建立成功后,大鼠麻醉断头取脑,分离海马组织,一部分采用4%多聚甲醛固定,另一部分-80℃保存备用。
1.2.4RT-PCR检测Trx-1 mRNA相对表达量 TRIzol提取海马组织总RNA,试剂盒反转录为cDNA,以cDNA为模板进行RT-PCR扩增。Trx-1引物序列为:F:5′-TTCTTTCATTCCCTCTGTG-3′,R:5′-TCCGTAATAGTGGCTTCG-3′,内参基因GAPDH引物序列:F:5′-CCACTCCTCCACCTTTG-3′,R:5′-CACCACCCTGTTGCTGT-3′。 2-ΔΔCt法计算。
1.2.5Western blot检测蛋白相对表达量 提取各组海马组织总蛋白,BCA法测定蛋白浓度后进行SDS-PAGE凝胶电泳,蛋白上样量为20 μl,转至PVDF膜,5%脱脂奶粉室温封闭2 h。PBST洗膜后加入一抗稀释液(1∶1 000),室温孵育1 h。PBST洗膜,加入二抗稀释液,室温孵育1 h。PBST洗膜,滴加化学发光试剂显影,ChemiDoc Touch系统采集图像,以GAPDH为内参计算其他蛋白相对表达量。
1.2.6HE染色观察海马组织形态 取固定海马组织,常规制片:组织脱水,浸蜡包埋,切成4 μm厚片,脱蜡至水。加入苏木素染液染色3 min,流水冲洗后加入1%盐酸乙醇分化1 min。流水冲洗,加入促蓝液返蓝1 min,洗涤后加入伊红染液染色3 min。乙醇脱水,二甲苯通透,中性树脂封片,显微镜下观察并拍照。
1.2.7TUNEL染色观察海马组织细胞凋亡 将海马组织切片进行脱蜡脱水处理,按照TUNEL凋亡检测试剂盒说明书操作,显微镜下观察海马组织细胞凋亡情况,统计3个切片TUNEL染色阳性细胞数,取平均值。

2 结果
2.1大鼠行为观察 PTZ连续注射8 d后,模型组和阴性对照组大鼠出现1级惊厥发作,15 d后,Trx-1过表达组大鼠出现惊厥发作,20 d后,模型组和阴性对照组大鼠连续3 d均表现出4~5级癫痫惊厥行为,说明PTZ成功点燃癫痫模型,PTZ点燃成功后,对照组大鼠未出现惊厥发作,模型组与阴性对照组大鼠惊厥发作时间长、级别高,而Trx-1过表达组大鼠惊厥时间明显缩短,级别明显降低(P<0.01)。见表1。
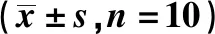
表1 大鼠癫痫发作情况比较Tab.1 Comparison of epileptic seizures in
2.2Trx-1 mRNA及蛋白表达水平 与对照组相比,模型组大鼠海马组织Trx-1表达显著降低(P<0.01),与模型组相比,Trx-1过表达组Trx-1表达显著升高(P<0.01),说明Trx-1过表达重组慢病毒载体转染成功。见图1。
图1 Trx-1 mRNA及蛋白表达Fig.1 mRNA and protein expressions of Trx-1Note:Compared with control group,**.P<0.01;compared with model group,##.P<0.01.
2.3Trx-1过表达对大鼠海马组织形态的影响 对照组细胞排列整齐紧密,细胞轮廓清晰,无明显病变。模型组和阴性对照组细胞形状不规则,排列疏松,细胞核固缩深染,细胞质呈现严重空泡化。与模型组相比,Trx-1过表达组海马神经元损伤减轻,细胞轮廓较清晰,排列整齐,细胞质空泡化程度降低。见图2。

图2 HE染色观察海马组织形态(×200)Fig.2 Hippocampus morphology observed by HE staining(×200)
2.4Trx-1过表达对大鼠海马组织细胞凋亡的影响 TUNEL染色观察各组海马组织细胞凋亡水平,结果显示,与对照组相比,模型组和阴性对照组凋亡细胞数显著增加(P<0.01),与模型组相比,Trx-1过表达组细胞凋亡数显著减少(P<0.01)。见图3。
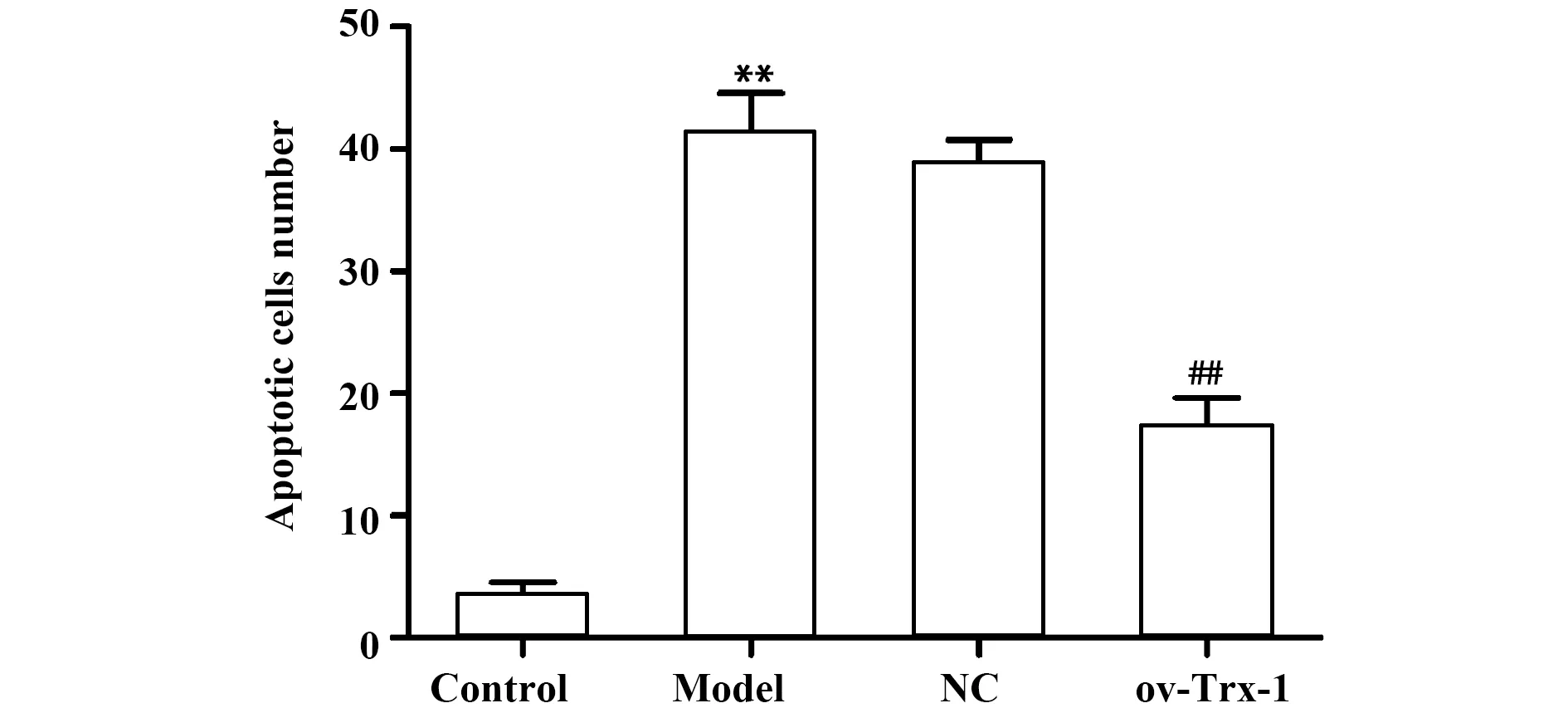
图3 各组海马组织凋亡细胞数比较Fig.3 Comparison of apoptotic cells in hippocampus of each groupNote:Compared with control group,**.P<0.01;compared with model group,##.P<0.01.
2.5Trx-1过表达对大鼠海马组织凋亡相关蛋白的影响 与对照组相比,模型组Bcl-2蛋白表达显著降低(P<0.01),而Bax、ASK1和p-JNK蛋白表达显著升高(P<0.01)。与模型组相比,Trx-1过表达组Bcl-2蛋白表达显著升高(P<0.01),而Bax、ASK1和p-JNK蛋白表达显著降低(P<0.01)。见图4。

图4 Trx-1过表达对Bcl-2、Bax、ASK1和p-JNK蛋白表达的影响Fig.4 Effect of Trx-1 overexpression on proteins expressions of Bcl-2,Bax,ASK1 and p-JNKNote:Compared with control group,**.P<0.01;compared with model group,##.P<0.01.
3 讨论
癫痫是一种复杂的神经综合征,具有刻板性、发作性和反复性等特点,全球90%以上的癫痫发生于中低收入水平国家,且伴有认知、心理及生理学等方面的并发症[10,11]。癫痫主要由多种因素导致大脑神经元过度兴奋和突然的同步放电引发,发病机制复杂[12]。抗癫痫药物治疗效果不理想,对癫痫发病机制及新型治疗方法的研究对改善癫痫治疗现状具有重要意义。
ASK1在生物体内具有重要的生理功能,特别是在应激条件下,对氧化应激高度敏感,诱导细胞凋亡,可被内质网应激、氧化应激及炎症信号等激活,过度活化后的ASK1可激活下游JNK通路,诱导细胞凋亡,引起组织形态学改变及多种应激反应,进而引发多种疾病[13,14]。JNK是丝裂原活化蛋白激酶家族主要成员,JNK信号传导可参与外源性凋亡途径及线粒体引发的内源性凋亡途径,是诱导细胞凋亡的关键因子,抑制肿瘤发展[14,15]。研究显示多种磷酸化信号通路与遗传因素和后天性脑损伤引起的癫痫发病机制相关,在癫痫动物模型中发现JNK存在过度激活,推测JNK介导的磷酸化信号可能是一种新的抗癫痫治疗靶点[16]。Trx作为ASK1信号的调控成分之一,可通过调节ASK1/JNK信号通路调控细胞凋亡[13]。研究发现,Trx-1/Trxr-1系统参与胸腺细胞内ASK1及JNK磷酸化过程,上调该系统表达水平及控制细胞内氧化还原状态稳定对胸腺细胞的存活至关重要[17]。Wong等[18]研究结果也证实了Trx-1是一种内源性抗凋亡分子,可通过抑制ASK1-JNK/p38信号通路减少神经元细胞凋亡,减轻脑缺血再灌注损伤。
PTZ是一种中枢系统兴奋剂,在神经元完好的情况下,反复注射PTZ可诱导慢性癫痫动物模型[18]。本研究采用PTZ诱导大鼠癫痫模型,模型组大鼠癫痫发作时间长、级别高,海马组织出现严重损伤,细胞凋亡增加,经过Trx-1过表达慢病毒转染干预后,癫痫大鼠的癫痫惊厥发作时间缩短,级别降低,海马组织损伤减弱,且细胞凋亡数量减少,抗凋亡基因Bcl-2表达上调,而促凋亡基因Bax、ASK1及p-JNK表达下调。综上,过表达Trx-1对癫痫具有较好的治疗作用,可减缓海马组织损伤及细胞凋亡,其作用机制可能与下调ASK1/JNK信号通路有关。
