Toll样受体4基因敲除对高脂饮食诱导的肥胖小鼠骨骼肌AMPK-ACC-CPT-1B的影响①
2020-12-23孟祥雪叶盛开
孟祥雪 宋 冰 叶盛开
(中国人民解放军第967医院,锦州医科大学研究生培养基地,大连 116021)
随着糖尿病发病率升高,超重和肥胖比率逐年提高[1]。肥胖的发生是由于能量代谢失衡,导致脂肪代谢紊乱[2]。骨骼肌是机体最大的能量代谢器官,腺苷酸活化蛋白激酶(AMP-actived protein kinaseα,AMPKα)是机体细胞的能量感受器,在脂肪酸代谢调节,产热和脂肪组织发育中起关键作用[3-6]。
Toll样受体(toll-like receptors,TLRs)作为模式识别受体不仅在感染免疫和损伤诱导的炎症反应中发挥重要作用,还参与代谢相关疾病的发生发展,是目前研究中与肥胖关系最为密切的模式识别受体[7]。研究表明,高脂饮食时游离脂肪酸和脂多糖促进巨噬细胞、脂肪细胞和骨骼肌细胞表达TLR4及相关炎症信号分子(MyD88、p-NF-κB p65)[8-10]。但尚无文章提到TLR4通过AMPKα对小鼠骨骼肌脂代谢产生影响,故本文将TLR4与AMPKα联系起来进行探讨。
AMPK是对能量变化和能量转换极其敏感的一种激酶,广泛存在于骨骼肌、肝脏、胰腺和脂肪组织。AMPK以异源三聚体复合物形式存在,由α、β和γ 3个亚基组成,其中α亚基是催化亚基,具有α1和α2 2个亚型,α1主要表达于心脏、脑、肝脏等组织,α2主要在骨骼肌、心脏和肝脏中表达,对AMPKα活性起主要作用[11]。α2亚基比α1亚基对AMP的敏感性更高,是α1亚基活性的4倍[12]。骨骼肌AMPKα的激活依赖于α2亚基Thr172磷酸化。AMPKα在正常生理或病理过程中均发挥重要作用,在正常的细胞应激反应中,当机体发生能量危机时,ATP浓度下降,AMP浓度上升,细胞内AMP/ATP比例升高,此时,AMPKα被激活,在代谢综合征等病理状态下,伴随能量代谢紊乱,AMPKα活性被抑制[13]。通常以p-AMPKα蛋白表达量表示AMPKα的激活程度,以p-AMPKα/AMPKα表示[14]。
AMPK的主要功能是通过乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)的磷酸化来调节脂质代谢[15]。ACC是近年来在肥胖机制研究中被逐渐重视的一种促进脂肪酸合成的限速酶,有ACC1和ACC2 2种同工型[16]。在肌肉、心肌等部位,AMPK主要通过抑制ACC2和增强内碱脂酰转移酶(carnitine palmitoyltransfer enzyme-1,CPT-1)的活性减少脂肪酸合成并促进脂肪酸氧化[17]。激活的AMPK可使ACC磷酸化而失活,导致丙二酸单酰辅酶A活性降低,减轻对CPT-1的变构抑制,从而增强CPT-1活性,CPT-1可将长链脂肪酸从肉碱运送到线粒体进行β-氧化。CPT-1位于线粒体外膜,有CPT-1A(肝脏型)、CPT-1B(肌肉型)、CPT-1C(脑型)3种同工型,其表达上升可促进脂肪酸分解,降低机体脂肪酸含量。因此假设TLR4基因可能调节肥胖小鼠骨骼肌AMPK-ACC活性,改善脂代谢紊乱。本实验采用TLR4基因敲除的C57BL/6J小鼠,给予高脂饮食诱导肥胖,观察其骨骼肌组织脂代谢指标的变化。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级4周龄C57BL/6J雄性小鼠24只(北京华阜康生物科技有限公司)和TLR4基因敲除小鼠24只(美国Jackson实验室)杂交,喂养于锦州医科大学实验动物中心。
1.1.2试剂 BCA蛋白定量试剂盒、RIPA裂解液、SDS-PAGE凝胶制备试剂盒、一抗二抗去除液、SDS-PAGE蛋白上样缓冲液、超敏ECL化学发光液、DAB显色液、HE染色试剂盒、MyD88兔多克隆抗体、p-NF-κB p65兔多克隆抗体、AMPKα兔多克隆抗体、兔抗鼠β-actin内参一抗、辣根酶标记山羊抗兔IgG抗体(沈阳万类公司);免疫组化染色试剂盒(北京博奥森公司);TLR4兔多克隆抗体、p-AMPKα(Thr172)兔多克隆抗体、p-ACC(Ser80)兔多克隆抗体(美国Affinity);ACC兔多克隆抗体(美国CST);CPT-1B兔多克隆抗体(武汉博士德公司);小分子Maker(26616#)和大分子Maker(26619#)(上海赛默飞公司)。
1.2方法
1.2.1动物分组与处理 小鼠随机分为正常对照组(NC,8只)、肥胖组(OB,16只)、TLR4 基因敲除组(TK,8只)和TLR4基因敲除肥胖组(TO,16只)。自由饮水、摄食,动物房内12 h 昼夜循环,(22±2)℃。专用高能量饲料(含脂肪60%)喂养OB组和TO组小鼠,小鼠全价营养颗粒基础饲料(含脂肪10%)喂养NC组和TK组小鼠,16周后OB组小鼠体质量大于NC组小鼠上限且不发生糖尿病,TO组小鼠体质量大于TK组小鼠上限且不发生糖尿病。随机各选取8只用于后续实验。所有实验程序均符合锦州医科大学附属第一医院伦理委员会规定。
1.2.2生化指标检测 每周禁食不禁水8 h,断尾检测空腹血糖(fasting plasma glucose,FPG)水平,测体质量。16周后,禁食8 h,断头取血,测定FPG、TG、TC、LDL-C、HDL-C和FFA水平。处死前1周进行糖耐量试验(intraperitoneal glucose tolerance test,IPGTT,2 g/kg)。Western blot检测:小鼠处死后,取左侧腓肠肌组织,-80℃保存。取少量小鼠腓肠肌组织剪碎后加入RIPA裂解液(1∶100),静置10 min,超声3次,10 s/次,12 000 r/min离心20 min(4℃),取中层液体,BCA蛋白定量试剂盒测定总浓度,调整各蛋白浓度至2 mg/ml,95℃水浴5 min,-20℃保存备用。采用分离胶(8%和10%)、浓缩胶(5%)电泳,10 μl/孔样本及4 μl/孔Marker上样,1×上样缓冲液防止边缘效应,蛋白湿转至PVDF膜,5%脱脂奶粉室温封闭 3 h,加入一抗4℃孵育过夜,加入辣根过氧化物酶标记的山羊抗兔二抗室温孵育1 h。GISt020凝胶图像分析仪成像,ImageJ软件分析条带灰度值。
1.2.3HE染色 分离组织,以10%福尔马林溶液固定,常规脱水、石蜡包埋、切片、脱蜡至水,苏木素染色(2 min),自来水冲洗10 min,蒸馏水冲洗1 min,1%盐酸酒精分化3 s,自来水冲洗1 min,1%伊红染液染色1 min,蒸馏水洗1 min,脱水,透明,封片,光学显微镜下观察。
1.2.4免疫组织化学染色 分离组织,以10%福尔马林溶液固定,常规脱水、石蜡包埋、切片、脱蜡至水,抗原修复,3%过氧化氢孵育,山羊血清封闭,加入一抗、二抗孵育,辣根酶标记,DAB显色,苏木素复染,显微镜下观察并拍照,每个标本随机选取3张切片,每张切片选取5个视野,Image Pro Plus 6.0软件计算p-AMPKα、p-ACC、CPT-1B表达。

2 结果
2.1敲除TLR4基因对高脂饮食诱导的肥胖小鼠体质量及血脂代谢的影响 与NC组相比,OB组小鼠体质量、FPG、FFA、TG、TC、LDL-C水平升高,HDL-C水平降低;与OB组相比,TO组小鼠体质量、FPG、FFA、TG、TC、LDL-C水平均降低,HDL-C水平升高;与TO组相比,TK组小鼠体质量、FPG、TC、TG、LDL-C水平降低,HDL-C水平上升,FFA水平降低(表1)。
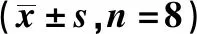
表1 各组小鼠体质量及生化指标Tab.1 Body weight and biochemical indicators of each
2.2TLR4基因敲除减轻高脂饮食诱导的肥胖小鼠骨骼肌炎症细胞浸润程度 HE染色结果显示,NC组与TK组小鼠腓肠肌排列均匀,横纹清晰;OB组小鼠腓肠肌有大量炎症细胞浸润;TK组小鼠骨骼肌排列均匀,横纹清晰,炎症细胞浸润减轻,TO组小鼠骨骼肌炎症细胞浸润明显减轻(图1)。
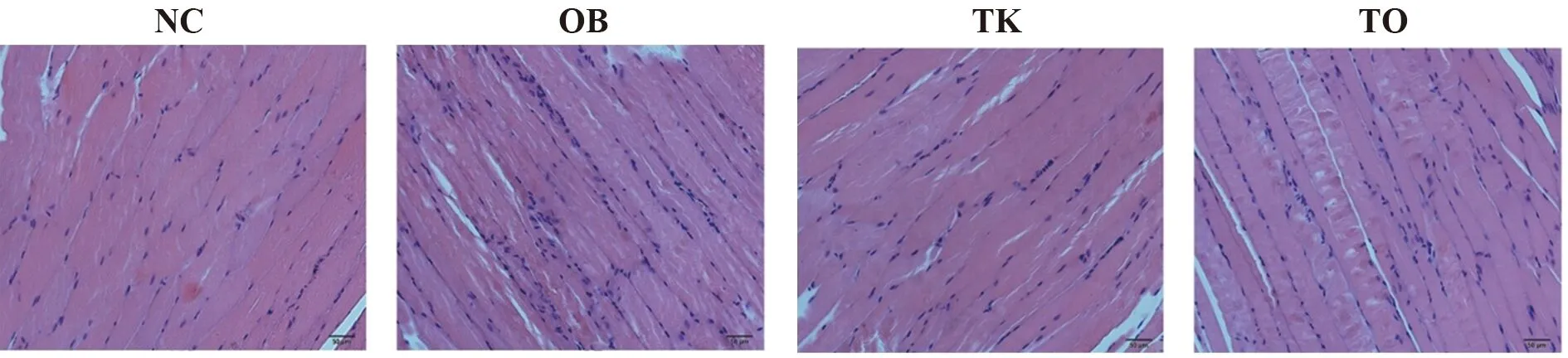
图1 各组小鼠骨骼肌组织HE染色(×400)Fig.1 HE staining of skeletal muscle tissues of mice in each group(×400)
2.3TLR4基因敲除上调高脂饮食诱导的肥胖小鼠骨骼肌组织p-AMPKα、p-ACC 和CPT-1B表达 免疫组化染色结果显示,与NC组相比,OB组小鼠骨骼肌组织p-AMPKα、p-ACC、CPT-1B表达下降;与OB组相比,TO组小鼠骨骼肌组织p-AMPK、p-ACC、CPT-1B表达上升,与TK相比,TO组小鼠骨骼肌组织p-AMPKα、p-ACC、CPT-1B表达上升(图2)。
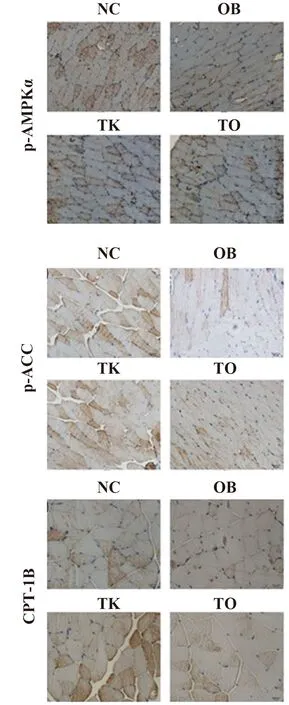
图2 免疫组化检测各组小鼠骨骼肌组织p-AMPKα、p-ACC、CPT-1B表达(×400)Fig.2 Expressions of p-AMPKα,p-ACC and CPT-1B in mice skeletal tissue were detected by IHC staining in each group(×400)Note:Compared with NC,**.P<0.01;compared with TK,##.P<0.01;compared with OB,△△.P<0.01.
2.4TLR4基因敲除上调高脂饮食诱导的肥胖小鼠骨骼肌组织AMPK蛋白活性 与NC组相比,OB组小鼠骨骼肌组织TLR4、MyD88、NF-κB p65、ACC表达上升,AMPKα、p-AMPKα、p-ACC、CPT-1B表达下降;与OB组相比,TO组小鼠骨骼肌组织TLR4、MyD88、p-NF-κB p65、ACC表达降低,AMPKα、p-AMPKα、p-ACC、CPT-1B表达上升;与TK组相比,TO组小鼠骨骼肌组织TLR4、MyD88、p-NF-κB p65、ACC表达上升,AMPKα、p-AMPKα、p-ACC、CPT-1B表达降低(图3)。
图3 各组小鼠骨骼肌组织TLR4、MyD88、p-NF-κB p65、p-AMPK、AMPK、p-ACC、ACC、CPT-1B蛋白表达Fig.3 TLR4,MyD88,p-NF-κB p65,p-AMPK,AMPK,p-ACC,ACC,CPT-1B protein expressions in skeletal muscle tissue of miceNote:Compared with NC,*.P<0.05,**.P<0.01;compared with TK,#.P<0.05,##.P<0.01;compared with OB,△.P<0.05,△△.P<0.01.
2.5AMPK活性与血糖、血脂的相关性分析 AMPK活性与FPG、FFA、TG、TC、LDL-C呈负相关(r=-0.716、-0.612、-0.668、-0.542、-0.817,P<0.01),与HDL-C呈正相关(r=0.630,P<0.01)。
3 讨论
骨骼肌是机体代谢最为旺盛的组织之一,骨骼肌代谢异常不仅会引起肌无力、肌萎缩等肌肉自身病变且会对全身造成不良影响,引发肥胖、糖尿病等多种代谢性疾病,严重降低人们的生活质量。肥胖发病率逐年上升,使其成为亟待解决的问题[18-20]。经过高脂饲料诱导后,若OB组小鼠体质量及血清TC、TG、LDL-C水平明显升高,提示造模成功[21]。
有研究表明TLR4抑制剂可抑制基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)分泌,与非脂多糖处理组相比,脂多糖刺激使MMP9水平提高1.79倍,细胞内MMP9直接或间接导致AMPKα降解[22,23]。本研究中,与NC组相比,OB组小鼠TLR4表达上升,AMPK表达下降,与既往研究结论一致。
AMPK是调节机体脂质代谢的“压力计”,能增强胰岛素敏感性、减少肝糖输出,且能通过AMPK磷酸化抑制脂肪酸合成,增强线粒体对脂肪酸的利用及氧化[24,25]。激活的AMPK可使ACC磷酸化而失活[26]。 ACC通过催化乙酰辅酶A生成丙二酸单酰辅酶A,在脂肪酸代谢过程中发挥重要作用,而抑制ACC活性可抑制脂质合成[27]。Liu等[28]研究发现,ACC-β基因敲除小鼠的采食量升高,但是体内的脂肪含量降低,表明ACC-β基因敲除后脂肪酸氧化速率加快,进而导致体内脂肪囤积减少。本研究中,与NC组相比,OB组小鼠AMPK、p-AMPK、p-ACC、CPT1B表达下降,ACC表达上升,与既往研究结论一致。
CPT-1在介导酰基进入线粒体的过程中发挥重要作用,是线粒体β氧化的关键酶,其表达水平升高促进脂肪酸分解,降低机体脂肪含量[28]。本研究中,与OB组相比,TO组小鼠骨骼肌CPT-1B表达上升,FFA、TG、TC、LDL-C水平降低,HDL-C水平升高。
目前针对通过各种运动、电针等改善肥胖小鼠骨骼肌能量代谢的报道较多,但TLR4基因敲除对骨骼肌能量代谢影响的报道较少,因此本研究采用高脂饮食诱导肥胖小鼠,对比肥胖小鼠与TLR4基因敲除组肥胖小鼠骨骼肌AMPK-ACC-CPT1B表达,初步认为TLR4基因敲除可通过激活肥胖小鼠骨骼肌组织AMPKα、ACC磷酸化而失活,CPT-1B表达上升,减少脂肪酸合成,增强脂肪酸β-氧化,从而降低血清FFA、TC、TG、LDL水平,提高血清HDL水平,但TLR4对骨骼肌能量代谢及血脂的影响是否还有其他信号通路有待进一步研究。
致谢:感谢2016年辽宁省自然科学基金(201602308)的资金支持以及辽宁省脑与脊髓损伤重点实验室郑华川和翟振华老师提供的实验材料和实验设备支持。
