DNA实时荧光恒温扩增法在结核病临床检测中的应用价值
2020-12-23杨翰李爱芳王佩党丽云
杨翰 李爱芳 王佩 党丽云
目前,临床结核病病原学检测方法包括传统的涂片镜检、分离培养菌株、分子生物学方法等。随着分子生物学不断发展,各种分子生物学检测技术都已经应用在结核病的检测中,如传统PCR技术检测结核分枝杆菌DNA(FQ-PCR法),利福平耐药实时荧光定量核酸检测(GeneXpert MTB/RIF法)检测DNA,以及恒温扩增技术检测DNA、RNA。DNA实时荧光恒温扩增法(简称“恒温扩增法”)检测结核分枝杆菌凭借其操作简便、实验仪器要求不高等特点,已经广泛应用于基层定点医院结核病诊断。本研究将恒温扩增法与其他临床常见分子生物学技术进行对比,探讨该方法在临床中的应用价值。
资料和方法
一、资料收集
参照《WS 288—2017肺结核诊断》[1],本研究样本量估算公式为:n=(μα/δ)2(1-P)P,其中(1)μα:检验水准α=0.05,μα=Zα/2=1.960;(2)δ:判断界值。一般定在0.05~0.10之间,本研究取δ=0.08;(3)P的确定:P敏感度=0.59;P特异度=0.85。将P敏感度=0.59代入公式后可计算试验组样本量得n(试验)≈145。将P特异度=0.85代入公式后可计算对照组样本量得n(对照)≈77,本研究为配对资料,因此样本量不得少于试验组所需样本量n(试验)=145。
收集2019年1—6月西安市胸科医院收治的疑似肺结核患者2421例,其中共有356例患者留取的痰液标本同时进行了痰涂片抗酸染色、GeneXpert MTB/RIF法、FQ-PCR法、结核分枝杆菌RNA实时荧光恒温扩增(SAT-RNA法)、恒温扩增法检测,以上结果全部纳入本次研究。同时收集121份恒温扩增法阳性的核酸用熔解曲线法检测利福平ropB基因。
二、研究方法
(一)仪器与试剂
Deaou-308C恒温荧光PCR快速检测系统、ABI7500荧光定量PCR仪(美国应用生物系统公司)、全自动医用PCR分析系统GeneXpert Dx System)(美国赛沛公司)、SLAN系列实时荧光定量PCR检测系统(厦门致善生物科技股份有限公司)、BACTECTMMGIT 960全自动分枝杆菌检测系统(美国BD公司)、BACTEC MGIT 960液体培养试剂盒(美国BD公司)、GeneXpert MTB/RIF检测试剂盒(美国赛沛公司)、结核分枝杆菌RNA恒温扩增检测试剂盒(上海仁度生物科技有限公司)、结核分枝杆菌复合群恒温扩增核酸检测试剂盒(广州迪澳生物科技有限公司)、结核分枝杆菌利福平耐药突变检测试剂盒 (厦门致善生物科技股份有限公司)。
(二)试验方法
1.结核分枝杆菌培养:采用BACTEC MGIT 960液体培养技术(简称“MGIT 960技术”)检测痰标本。痰标本2 ml与6% NaOH溶液以1∶1~1∶2混合加入到50 ml离心管中,振荡充分液化后,静置15 min,加入0.1 mol/L磷酸盐缓冲溶液(PBS)至45 ml, 3000×g离心20 min,弃上清,加入1 ml 0.1 mol/L PBS混匀,接种0.5 ml至MGIT 960培养管中,置于BACTEC MGIT 960培养箱中培养42 d。若BACTEC MGIT 960系统报告阳性,取出再经涂片抗酸染色确认是否为抗酸杆菌,抗酸杆菌阳性则进行MPB64蛋白免疫胶体金法检测鉴定菌种,MPB64蛋白阳性为结核分枝杆菌,阴性为非结核分枝杆菌;若BACTEC MGIT 960系统报阴性,则分枝杆菌培养阴性。
2. FQ-PCR法[2]:取1 ml标本加入1.5 ml离心管中,15 000×g离心5 min,弃上清,加入1 ml生理盐水涡旋振荡后,15 000×g离心5 min,弃上清。向沉淀中加入50 μl核酸提取液并转入带磁珠的核酸提取管中,提取仪快速振荡10 min,然后95 ℃水浴5 min。取2 μl提取好的核酸溶液加入18 μl PCR扩增试剂中进行扩增:37 ℃、300 s(1个循环),94 ℃、180 s(1个循环),94 ℃、15 s(40个循环),60 ℃、30 s(40个循环),50 ℃、10 s(1个循环);荧光采集点选择60 ℃、30 s,同时检测结核分枝杆菌拷贝通道和分枝杆菌拷贝通道。结果判读:样本曲线与阈值线交点的横坐标读数循环阈值(Ct值)<40的样本为阳性,Ct值>40或无数值的为阴性。
3. GeneXpert MTB/RIF法[3]:将样本加于 50 ml 带有螺旋盖的前处理管;视样本性状,将样品处理试剂加入前处理管中; 旋紧处理管的螺旋盖;在涡旋振荡器上振荡 1 min左右直至样本充分液化;将前处理管置于生物安全柜内,室温静置 15 min;使用无菌移液管将2 ml液化的样品缓慢加入检测匣。上机测试。结果自动导出。
4. SAT-RNA法[4-5]:将标本加入等量4% NaOH溶液将其液化。取出1.5 ml离心管,对应标本编号,置于离心管架上。吸取1000 μl已液化好的痰液标本加入到相应编号的离心管中。15 000×g离心8 min,将上清液倒掉,加入1.0 ml生理盐水,混匀;15 000×g离心8 min,倒掉上清液,用加样枪将剩余上清液吸弃干净,加50 μl稀释液,旋涡振荡混匀。置于分枝杆菌细胞超声破碎仪中处理15 min。15 000×g离心5 min,上清液即为制备好的RNA。取2 μl提取好的RNA加入含30 μl扩增检测液的洁净微量反应管中,放置于恒温干浴器内,60 ℃ 10 min,42 ℃ 5 min,加入SAT酶。上机检测,扩增工作程序(42 ℃ 1 min,40个循环,每分钟采集一次荧光,选取FAM通道。分析条件设定与结果判读:根据分析后图像调整基线和阈值线。样本曲线与阈值线交点的横坐标读数(Ct)<40的样本为阳性,Ct值≥40或无数值的为阴性。
5. 恒温扩增法[6]:用一次性吸管吸取 200 μl(浓痰 100 μl)的痰液加入到样品管中,混匀。100 ℃恒温处理 10 min,取出样品管,冷却至室温。取下吸附管的管帽,将样品管顺时针旋入吸附管,将液化液和吸附剂充分混匀,平放静置 1 min。吸附管横向,靠近滤嘴端将折断键折断,滤嘴朝下,用手挤压吸附管,将液滴挤入离心管中备用。将模板 DNA加入到对应的反应管中,瞬时(5 s)离心混合以上试剂。打开恒温扩增荧光检测仪,按程序扩增,报告结果。
6. 熔解曲线方法[7-8]:(1)核酸提取,为使用恒温扩增法处理样本后剩余核酸。(2)试剂配制,取出相应药物试剂盒平衡至室温溶解,将MixA、MixB(PCR反应体系包含:Mg2+、引物、dNTP等)旋涡振荡充分混匀,分别吸取19.6 μl MixA、MixB与0.4 μl 酶液(逆转录酶、T7聚合酶)混合加入八连管。在相应管中加入5 μl提取的DNA,瞬时(5 s)离心混合,弹去气泡,上机检测并进行结果判读及分析。
三、统计学处理
使用SPSS 18.0统计学软件进行数据分析及ROC曲线绘制,计数资料使用χ2检验,检验水准为α=0.05。以痰培养结果为金标准,分析其余4种试验的敏感度、特异度、阳性预测值、阴性预测值、符合率、Kappa值。同时分析涂阳、涂阴肺结核患者中的各分子生物学方法的阳性率。
结 果
1. 4种分子生物学方法的检测效能:以痰培养结果为金标准,4种临床常用分子生物学方法比较,恒温扩增法的敏感度低于GeneXpert MTB/RIF,高于FQ-PCR、SAT-RNA等其他两种试验,且差异具有统计学意义,见表1。ROC曲线中,GeneXpert MTB/RIF的曲线下面积最大(0.910),随后依次为恒温扩增法(0.860)、FQ-PCR法(0.854)、SAT-RNA法(0.789)。以培养为金标准,4种检测方法在临床有较好的诊断价值,见图1。4种检测方法在痰涂片阳性肺结核患者中,恒温扩增法阳性率为89.23%(58/65),低于GeneXpert MTB/RIF法的93.85%(61/65),高于FQ-PCR法的73.85%(48/65)及SAT-RNA法的64.62%(42/65);在痰涂片阴性肺结核患者中,恒温扩增法阳性率为22.34%(65/291),低于GeneXpert MTB/RIF法的34.36%(100/291),高于FQ-PCR法的21.31%(62/291)及SAT-RNA法的14.43%(42/291)。
2. 恒温扩增法阳性核酸标本耐药基因检测结果:121份恒温扩增法阳性核酸标本用熔解曲线法检测对利福平耐药的ropB基因,其中dt值在15~25之间共36份,26~30之间共31份,31~35之间共21份,36~45之间共33份,可发现当恒温扩增法阳性核酸荧光信号出现的时间dt值(1dt=1 min)>30时ropB耐药基因的检出率较低,dt值<30时ropB耐药基因的检出率均在90%以上。恒温扩增法提取的原始核酸和稀释5倍后核酸比较,稀释后核酸dt值15~25时ropB耐药基因的检出率高于原核酸,dt值26~30时则检出率低于原核酸(表2)。
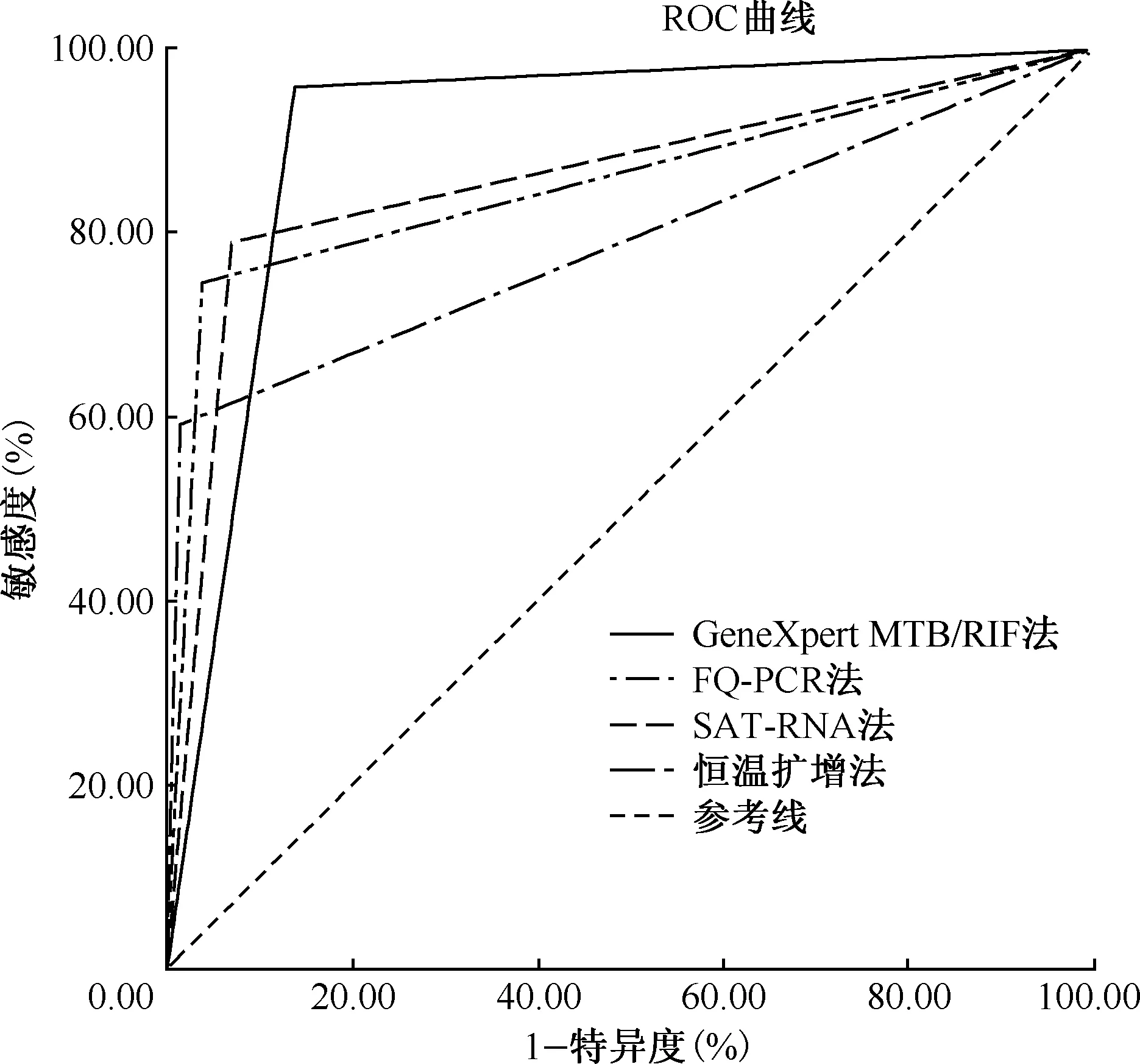
图1 GeneXpert MTB/RIF法、FQ-PCR法、SAT-RNA法、恒温扩增法ROC曲线图

表1 不同分子生物学检测方法效能比较

表2 不同dt值对利福平耐药的ropB基因检出率
讨 论
目前应用于结核病检测的分子生物学方法很多,恒温扩增法具有快速、简单、不需要大型仪器等特点,普遍应用于结核病定点医院。本研究通过对比4种不同的分子生物学方法,研究恒温扩增法在结核病诊断中的应用价值。
本研究比较了4种分子生物学方法的检测效能,结果显示恒温扩增法的敏感度优于传统FQ-PCR法,因在恒温扩增法中DNA解链始终处于单链状态,扩增过程持续进行,不需要传统PCR解链、退火、延伸的步骤,所以恒温扩增法的扩增效率高于传统FQ-PCR法,并且反应的时间更短。恒温扩增法敏感度优于SAT-RNA法,在RNA恒温扩增中RNA逆转录成DNA,通过T7 RNA多聚酶等作用又形成新的RNA,RNA恒温扩增的扩增状态同样一直持续进行,但RNA存在于活的结核分枝杆菌中[10],这可能是SAT-RNA法敏感度低于恒温扩增法的原因。恒温扩增法敏感度低于GeneXpert MTB/RIF法,GeneXpert MTB/RIF法是基于传统PCR扩增的半巢式PCR法,该方法因其技术特点能够对样本中的低拷贝目的基因进行有效的扩增,能够检出标本中低水平结核分枝杆菌,使得GeneXpert MTB/RIF法的敏感度高于恒温扩增法[11]。
关于4种分子生物学检测方法在痰涂片阳性及阴性肺结核患者中的检出率,本研究对痰涂片阳性及痰涂片阴性患者的痰标本进行恒温扩增法检测,其阳性检出率均高于FQ-PCR法及SAT-RNA法,均低于GeneXpert MTB/RIF法,这与各种方法的原理有关,恒温扩增法在痰涂片阳性及阴性肺结核患者中均具有较好的应用价值。
通过ROC曲线下面积分析4种分子生物学检测方法的诊断效能,以培养为金标准,4种检测方法在临床有较好的诊断价值。其中恒温扩增法的曲线下面积大于FQ-PCR法,诊断价值相对于FQ-PCR法更好。马晓光等[6]的研究显示,恒温扩增法与痰培养结果具有高度的一致性。本研究中,4种分子生物学方法与痰培养均具有较高的符合率和一致性,说明恒温扩增法与传统培养及其他临床常用的分子诊断方法均具有较好的诊断效能。
近年来针对结核病病原学诊断方法较多,尤其在分子生物学检测方法方面,包括分枝杆菌检测及相关耐药基因检测。因传统培养及药敏时间需要1.5个月甚至更久,耐药基因的检测对于早期发现耐药结核病有重要价值[7,12]。本研究中使用的恒温扩增法,虽然仅能够对病原菌进行检测,但该试验中提取的核酸是否能够应用于耐药基因检测,是此次研究的目的。不同的核酸提取方法[13-14]对细菌核酸提取的效率不同,恒温扩增法采用化学裂解、高温煮沸、杂质吸附等步骤进行核酸提取,应用于耐药基因检测具有一定可操作性。研究以试验中dt值为标准,预估提取核酸中结核分枝杆菌基因拷贝数,以不同dt值进行分组,分析不同结核分枝杆菌基因拷贝数对耐药基因检测的影响。试验结果可以看出dt值<35时,提取的原核酸是可以检测到ropB耐药基因片段的。dt值在31~35时,ropB耐药基因检出率仅为9.52%,基因拷贝数在此范围内较低,临床检验中若使用恒温扩增法提取的核酸进行耐药基因检测时不应当考虑此范围的标本,避免试剂成本的浪费。dt值在15~30时,ropB耐药基因检出率均高于90%。考虑到恒温扩增法提取核酸为化学及高温裂解等原理,核酸纯度不够,可能存在大量的盐离子物质,以及高的基因拷贝数等因素影响耐药基因检测的PCR反应。本研究同时对原核酸标本进行了5倍稀释,结果显示dt值在15~25时,稀释后的核酸ropB耐药基因检出率明显高于原核酸,这得益于核酸的稀释降低了盐离子物质浓度,以及提供了合适的模板浓度。dt值在26~30时,稀释后的核酸ropB耐药基因检出率略低于原核酸,可能是核酸稀释后模板浓度降低所致。研究结果提示,在不同的dt值条件下可以适当地稀释核酸样本进行检测,提高耐药基因检出率,同时也可节约试剂和人工等成本。
综上所述,通过与各种检测技术比较,恒温扩增法具有临床应用价值,并适用于基层医院的结核病诊断。
