完全圆头精子症5 例报告
2020-12-22刘彩钊王家雄郑爱燕孟庆霞杨慎敏
刘彩钊 王家雄 郑爱燕 丁 洁 孟庆霞 李 红 杨慎敏
南京医科大学附属苏州医院 生殖与遗传中心(江苏苏州 215002)
男性不育目前已经成为困扰很多家庭的问题,影响男性生育力的因素很多, 其中遗传缺陷导致的精子发生异常不容忽视。 遗传因素相关的精子发生异常往往表现为严重男性不育, 如: 精子鞭毛多发形态异常(multiple morphological abnormalities of the sperm flagella,MMAF)[1]、 原发性纤毛运动障碍(primary ciliary dyskinesia,PCD)[2]、无头精子症(Acephalic Spermatozoa Syndrome,ASS)[3]、圆头精子症[4]等。 其中圆头精子症早在上个世纪70 年代就被报道[5],具体表现为精子头部小而圆、顶体缺失,部分病例出现尾部鞭毛的卷曲从而影响精子活动能力[6]。圆头精子症是常染色体隐性遗传病,目前已知的致病基因主要有DPY19L2(MIM:613893)、SPATA16(MIM:609856)和PICK1(MIM:605926),其中DPY19L2 缺陷最为常见[7]。 由于顶体的缺失,圆头精子无法穿透卵子透明带从而使卵子受精,因此,圆头精子症是一种严重的原发性不育。 从发现到现在,圆头精子症的辅助生殖结局就一直被关注, 由于无法穿透透明带,在引入卵胞浆内单精子注射(intracytoplasmic sperm injection,ICSI)之前,并没有针性治疗方法[8]。 圆头精子症的ICSI 结局也不甚理想,总受精率仍低于50%[9]。 在此, 我们报道5 例在我院接受ICSI 治疗的完全圆头精子症患者,采取卵子激活后,1 例成功生育健康子代。
材料与方法
一、研究对象
5 例均为原发不育,年龄23-37 岁,不育年限3-10年。 查体:男性第二性征发育正常,睾丸、附睾、输精管均无异常,无精索静脉曲张。 患者染色体核型分析均为46,XY,性激素检测结果在正常参考值范围。
二、方法
(一)样本接收与常规检测
患者禁欲2-7 天后手淫采集精液,液化后采用计算机辅助精液分析系统(Computer-aided Semen Analysis System ,CASA)(上海北昂医药科技股份有限公司)进行精液常规分析,记录精子浓度、活动精子百分率、前向运动精子百分率。 采取精子染色质结构分析法(sperm chromatin structure assay,SCSA)分析精子DNA碎片化指数[10]。 患者1 进行精子超微结构、顶体检测等试验,对5 例样本均进行遗传分析。
(二)精子形态分析
按照《WHO 人类精液检查与处理实验室手册》第5版标准对精子进行形态分析,采用改良巴氏染色液(南京欣迪生物药业工程有限责任公司) 进行精子涂片染色,1000 倍镜观察。
精子超微结构观察: 精液液化后,400g×15min 离心获得新鲜的精子标本,PBS 洗涤两次, 加2.5%戊二醛溶液固定。梯度浓度乙醇脱水和渗透后,将用于透射电镜的样品包埋在Epon 812(SPI,美国)中,并用乙酸铀酰和柠檬酸铅对超薄切片进行染色。 用透射电镜(TECHAI-10,Philips,荷兰)以80kV 的加速电压观察和记录超微结构。用离子喷雾仪(ACE200,Leica,德国)溅射涂覆用于扫描电镜检查的样品,并通过扫描电镜(Nova NanoSEM 450,FEI,美国)以5kV 的加速电压进行分析。
(三)精子顶体功能检测
采用钙离子载体(A23187,Sigma Aldrich,美国)诱导精子发生顶体反应后,37℃、5%CO2下孵育15min, 将精子用PBS 洗涤3 次,涂在载玻片上并风干。 随后,将精子载玻片在室温下用PBS-4%甲醛固定20min,然后在PBS中洗涤3 次。 将玻片用5%牛血清白蛋白(A8020;Solarbio, 中 国) 封 闭, 并 在4℃下 与 兔 抗CD46 一 抗(ab108307,Abcam,美国)一起孵育过夜。 之后,在室温下与Cy3 偶联的山羊抗兔IgG(GB21303,Servicebio,武汉,中国)孵育50min,用PBS 洗涤3 遍。 将载玻片用5 mg/mL DAPI(G1012,Servicebio,中国)复染,并用固定介质(G1401,Servicebio,中国)固定。 用共聚焦显微镜(Nikon Eclipse CI,Nikon,Japan)捕获荧光图像。
(四)遗传分析
使用DNeasy 血液和组织试剂盒(Qiagen,美国)从血液样品中提取基因组DNA。 使用xGen Exome Research Panel V1.0(Integrated DNA Technologies,美国)制备样品的全外显子组测序。测序文库的量通过Qubit 2.0 荧光计(Thermo Fisher Scientific,美国)评估。文库的质量和大小通过2100Bioanalyzer 高灵敏度DNA 分析(Agilent Technologies,美国)进行检测。 将合格的文库应用于Illumina NovaSeq 平台(Illumina,美国)上测序。通过BWA v0.7.13 将FASTQ 文件与人类参考基因组(hg19/GRCh37)对齐。 变体(单个核苷酸变体和插入/缺失)由GATK 4.0 从重新校准的BAM 文件中进行基因分型, 并使用ANNOVAR 针对多个数据库进行注释,包括HGVS 变体描述、种群频率、疾病或表型和变体功能预测。 按照美国医学遗传学学会(American College of Medical Genetics and Genomics, ACMG)指南,将变体分类为致病性、可能致病性、未知意义的变体、可能为良性或良性变体。拷贝数变异由DNAcopy R软件包调用,按照ACMG 指南进行过滤和分类,并使用Integrative Genomics Viewer 7 进行手动检查。
(五)辅助生殖
女方采用长刺激方案诱导排卵, 在黄体中期或口服避孕药停药前5~7 d 使用促性腺激素释放激素, 在第15天测激素水平和B 超后开始给予重组卵泡刺激素以刺激卵泡发育。当至少两个优势卵泡直径达到18mm 时,注射250μg 重组人绒毛膜促性腺激素。 注射后36h 取卵,间隔4~6h 注射精子使M II 卵细胞受精,15min 后在培养基中加入钙离子激动剂(A23187,SigmaAldrich,USA)至终浓度为10μmol/L。 取卵72h 后移植,胚胎移植后第12 天检测血清hCG,35 天后超声发现胎心确定为临床妊娠。
结 果
一、一般资料
5 例患者精子形态异常严重,正常形态精子百分率多次检测均为0%,精液量正常,除患者2 外,精子浓度也在正常范围(>15×106/mL)。 除患者5 外,精子活动力较正常参考值低。 患者1、2、3 精子DNA 碎片化指数分别为20.54,34.85 以及18.64,见表1。

表1 5 例圆头精子症患者的一般资料
二、精子形态
正常精子光学显微镜下观察, 头部呈光滑椭圆形,尾部正常舒展(图1A),圆头精子症患者精子光学显微镜下呈圆形,顶体缺失,部分患者精子尾部鞭毛出现卷曲、短等严重畸形(图1B),扫描电镜下放大观察亦是如此(图1C-D)。透射电镜下观察,正常精子头部核质组装紧密,顶体位于头部前方,胞膜明显(图2E),而圆头精子症患者头部不仅缺失顶体,而且核质出现松散、空泡等异常(图2F)。正常精子尾部鞭毛轴丝由1 对中央微管和9 对外周双联微管组成“9+2”结构,外周由外周致密纤维和纤维鞘包裹(图2G);圆头精子症患者1,多数精子鞭毛也存在结构组装紊乱或微管缺失等异常(图2H)。
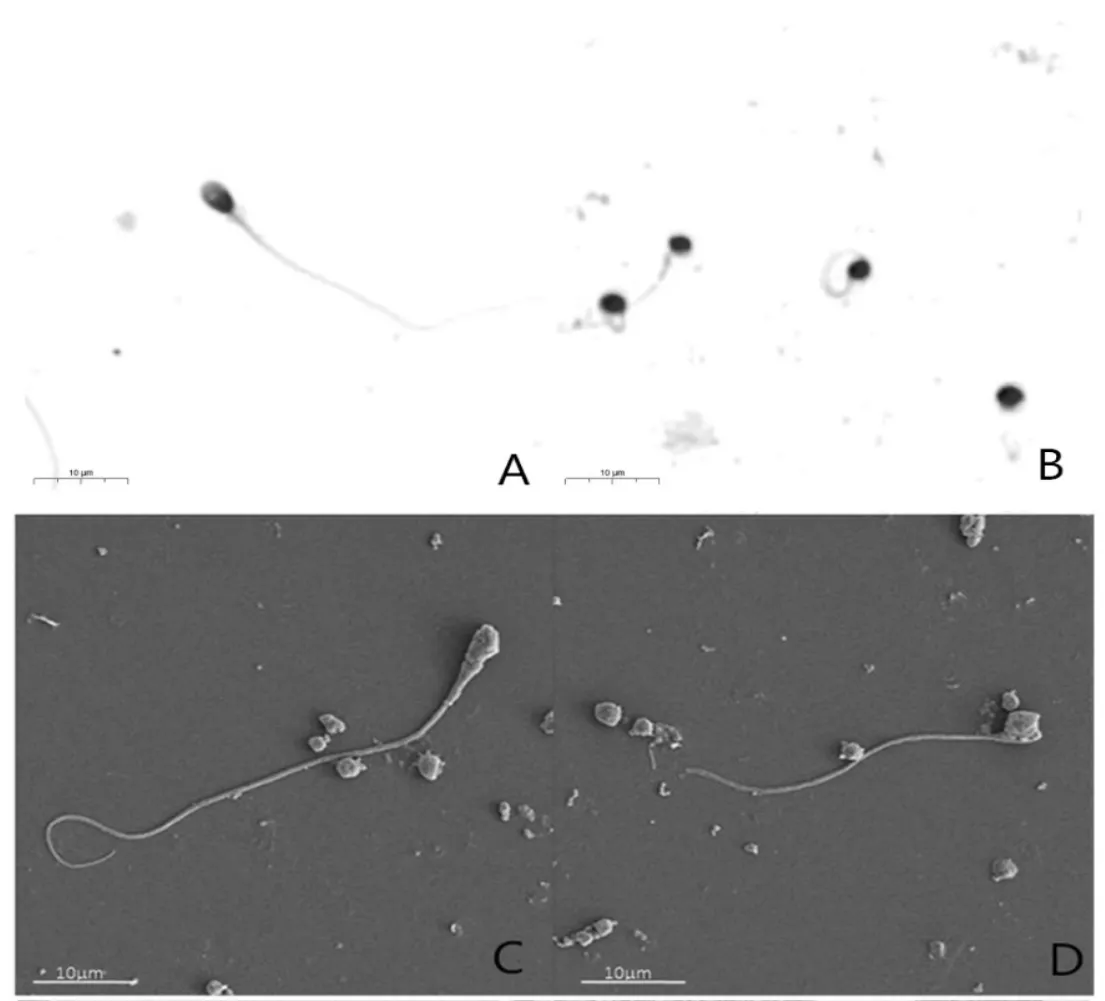
图1 光镜和扫描电镜下正常男性(A、C)和圆头精子症患者精子形态

图2 透能电镜下正常精子和圆头精子超微结构
三、精子顶体功能检测
CD46 在精子中定位于顶体帽,其仅在精子顶体反应后暴露于顶体内膜表面。 正常男性精子通过钙离子诱发顶体反应后,CD46 暴露, 可以与CD46 特异性荧光抗体结合发出荧光,但是圆头精子症患者由于顶体结构的缺失,无法发生顶体反应,CD46 表达阴性,见图3。
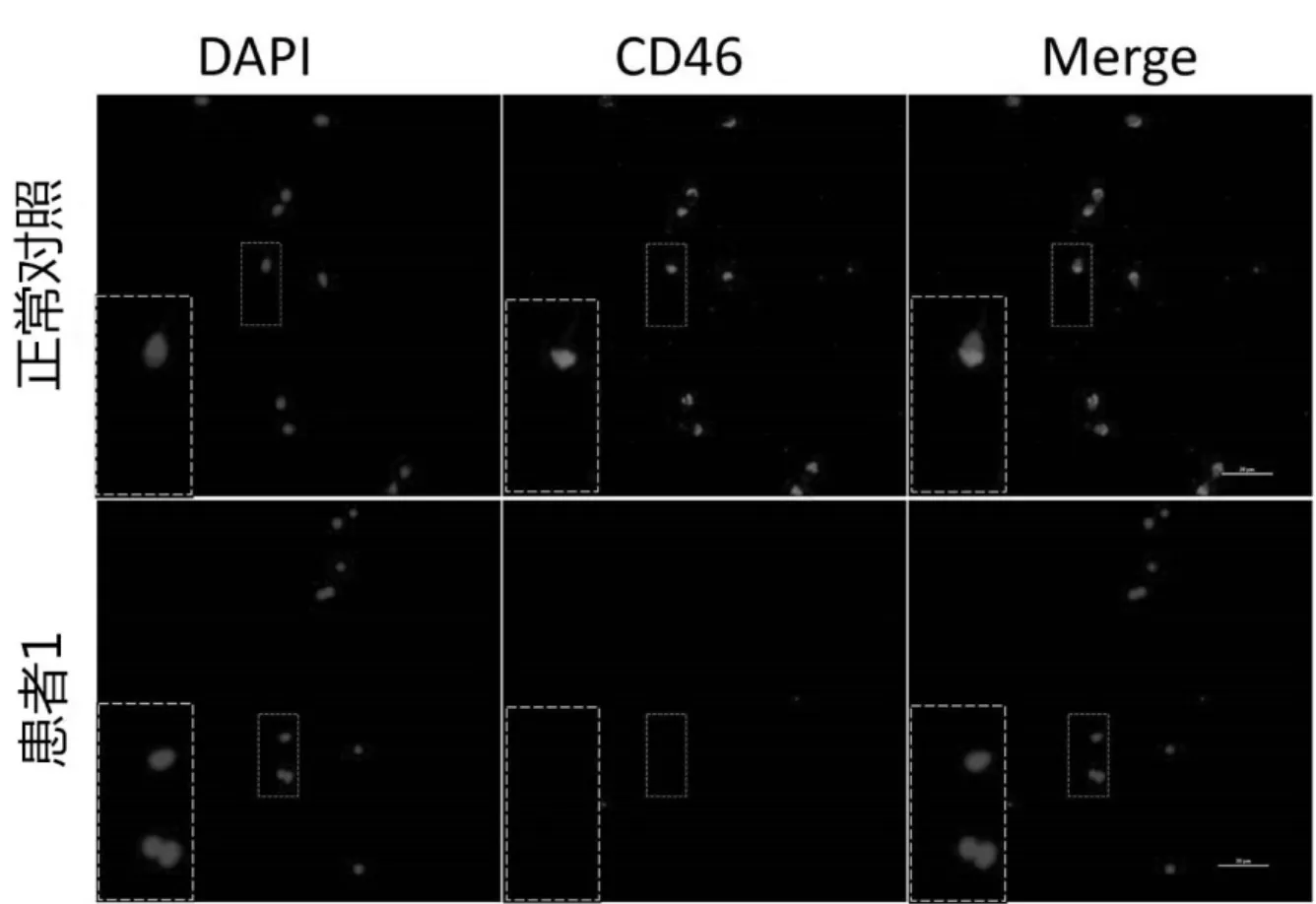
图3 CD46 的免疫荧光显示的正常(第1 行)和圆头精子症的患者(第2 行)中Ca2+离子诱导的顶体反应
四、患者遗传病因分析
患者1-4 接受全外显子测序(whole exome sequencing,WES)检测后未发现小片段缺失和突变,在进行了CNV 分析后, 发现存在长达十多万bp 的缺失, 而患者5 是大片段缺失与点突变的复合变异,见表2。
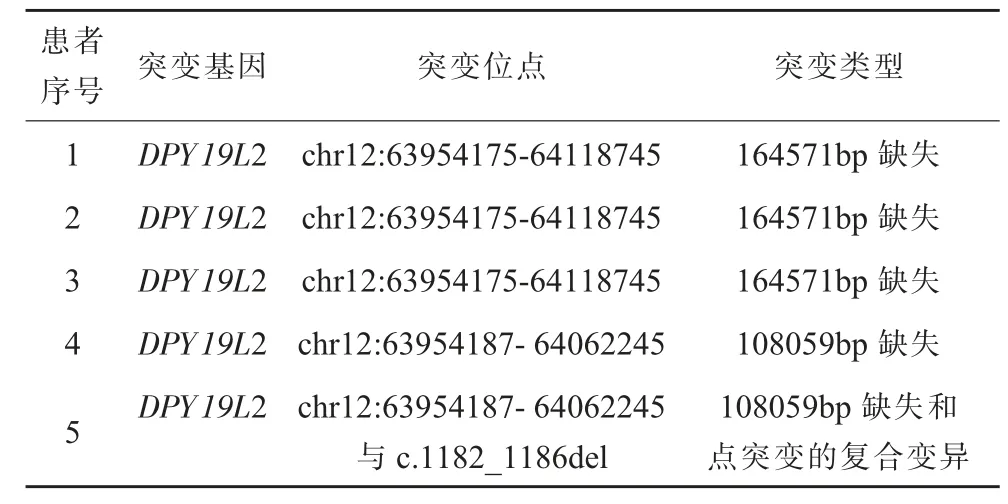
表2 5 例圆头精子症患者的遗传病因
五、辅助生殖结局
患者1-5 受精率分别为83.3%(5/6)、60%(3/5)、28.6%(2/7)、0%(0/6)和0%(0/23),患者1 和患者2 胚胎移植后无临床妊娠, 患者3 移植2 枚优质胚胎足月产2 孩,1 男1 女,如表3。

表3 患者辅助生殖临床数据
讨 论
精子形态在男性生育力评估中的作用举足轻重,其中精子头部畸形对精子质量的影响尤为明显。 精子头部主要分为顶体区与顶体后区, 顶体后区即精子核质部分。 顶体区域的异常会导致精子无法穿透卵子透明带而核质部分异常会使胚胎质量下降。 圆头精子症是典型的精子头部异常, 光镜下通过顶体形态的差异可以分为完全圆头精子症和不完全圆头精子症。 完全圆头精子症是圆头精子症中严重的一类, 典型的特点是顶体的完全缺失; 而不完全圆头精子症患者的精子仍保留了部分顶体残余[11],此次研究入组的5 例患者均为完全圆头精子症。 伴随着精子头部形状变化和顶体缺失的是精子核质的异常,有研究发现,与正常男性相比, 圆头精子症患者精子的鱼精蛋白缺乏, 而且DNA碎片率显著增高[12]。 Perrin 等[13]在对圆头精子症的文献回顾中发现, 圆头精子症患者不仅DNA 损伤增加,精子染色体非整倍体率也大幅增加。 这使得圆头精子症不仅难以穿透卵子透明带,即使进入卵子,由于精子遗传物质的缺陷也会导致胚胎发育潜能不足。 除了圆头精子症头部形态的研究, 精子尾部也出现不同程度的畸形,但原因不详[14,15]。 Ricci 等[16]认为导致圆头精子的头部异常成熟的过程可能也导致了精子尾部在核周的缠绕,这个异常过程一直持续到其最终阶段,因此最终变现出鞭毛的多次卷曲缠绕精子头部。 而在本次研究中观察到的患者精子不仅出现了典型的头部缺陷,也伴随了尾部的卷曲, 超微结构观察患者部分精子鞭毛微管结构排列紊乱,也提示了在精子成熟过程中,影响头部发育的遗传缺陷也影响着精子尾部的组装。 这说明圆头精子症是一个精子整体的组装障碍, 而不仅仅局限于头部形态。 Sermondade 等[17]的研究采用钙离子诱导了精子顶体反应,并采用抗CD46 标记了发生顶体反应的顶体。 本研究中圆头精子症患者顶体反应异常,也证实了患者由于精子顶体无法穿透卵子透明带而导致原发性不育。
DPY19 样蛋白2(DPY19L2)、 精子发生相关16(SPATA16)和C 激酶1 相互作用蛋白(PICK1),这三个蛋白编码基因的变异被确定为圆头精子症的主要遗传病因。DPY19L2 蛋白是睾丸特异性表达蛋白,有研究证明它是位于内核膜上的跨膜蛋白, 它的缺失会导致顶体扩散过程中存在于核/ 顶体交界处的分层结构的破坏, 并最终导致顶体从核中脱离[18]。SPATA16 与PICK1 蛋白均定位于高尔基体中, 并在囊泡从高尔基体转移到顶体以及顶体生物发生中发挥作用[19],除此之外SPATA16 的小鼠模型试验发现, 删除Spata16 的第四个外显子会导致雄性不育小鼠的生精阻滞, 说明该基因对于小鼠以及人类的男性生殖都是必不可少的[20]。最新的研究发现了两个新的圆头精子症致病基因ZPBP(MIM:608498)和CCDC62(MIM:613481),这两 个基因编码的蛋白均位于精子顶体区域,动物实验表明,其缺陷会导致精子顶体、头部形态的发育异常[18]。 除此之外,在动物模型中,还发现了圆头精子症潜在致病基因Hrb、Csnk2a2、GOPC, 但暂时没有在人体中发现[21]。在所有的圆头精子症致病基因中,最普遍(60%~80%)的是DPY19L2, 其中大片段缺失占DPY19LL2 相关的圆头精子症的80.4%,而其余则是由基因内的小片段缺失和点突变引起的[22],而在本次研究纳入的5 名患者均存在DPY19L2 基因的大片段缺失。
圆头精子症患者目前只能通过ICSI 生育, 但受精率、妊娠率和活产率均偏低[23]。 不同的遗传缺陷患者的辅助生殖结局不同,携带PICK1 和SPATA16 致病突变的患者至今无ICSI 成功报道,部分DPY19L2 缺陷的患者可通过ICSI 成功生育[24]。 卵子活化是一个涉及钙离子升高的过程, 过程中触发了内质网存储的钙离子的反复振荡。 精子进入卵子使精子可溶因子扩散,它们将磷脂酰肌醇4,5- 双磷酸酯水解为肌醇1,4,5- 三磷酸酯(inositol triphosphate 3,IP3)和二酰基甘油。然后,IP3 与诱导钙离子振荡的特定受体结合,导致卵子活化,精子释放的精子因子(如:震荡蛋白、顶体后鞘WW 结构域结合蛋白等) 是否会引起钙离子振荡取决于精子携带的精子因子水平[25]。圆头精子症患者精子缺乏一种顶体磷脂酶——磷脂酶Cζ(phospholipase Cζ,PLCζ),从而导致卵子激活失败。 目前人工卵母细胞活化(artificial oocyte activation,AOA)成为了提高圆头精子症患者生育可能的手段, 但安全性和有效性有待进一步观察[26],而且圆头精子症伴随的DNA 和染色质异常也是降低ICSI 成功率的关键因素,Eskandari 等[12]发现,即使采取了AOA, 圆头精子症患者由于其精子染色质包装和DNA 碎片化最终会导致受精失败或胚胎发育不良。 在本次研究中我们对圆头精子症患者均采取了AOA,但是结果仍然不理想。 同样的遗传缺陷和类似的精子表型,AOA 治疗的结果却存在不同,我们认为可能与女方因素有关,也与操作中选择的精子有关。 有研究报道虽然钙离子AOA 可以改善圆头精子症ICSI 后的成功率, 但是其激活卵子的效率低于正常精子注射所诱导的效率[27]。 因此我们认为圆头精子症ICSI 的成功关键是精子的选择, 即在众多顶体缺失的精子中尽最大努力挑出存在顶体残余的精子注射, 该思路也得到了文献的验证[17]。 因此,对于圆头精子症患者的ICSI 治疗,如果有条件的单位, 我们建议采用胞浆内形态选择精子注射(intracytoplasmic morphologically selected sperm injection,IMSI)结合AOA 的方法,而不是单纯的不挑选优秀形态的精子仅仅采用AOA 治疗。
综上所述,虽然完全圆头精子症的临床表型明确,多数病例的遗传学病因也比较清晰, 但是目前仍没有可靠的手段可以提高该类患者的辅助生殖结局。 该类患者的遗传检测十分必要, 有研究者推荐不仅需要对圆头精子症患者进行遗传检测, 其女性伴侣如果是近血缘婚姻后代或出生在封闭社会环境, 也需要对她们进行DPY19L2 缺失的筛查, 如果伴侣也存在该基因的杂合缺失, 则需要适当的选择植入前基因测试来挑选健康的胚胎以避免出生同样患有圆头精子症的男婴[28]。
