固有免疫相关编码基因在奶牛乳腺炎调节中的研究进展
2020-12-21胡启超罗仍卓么魏大为杨箭贾立王兴平马云
胡启超 罗仍卓么 魏大为 杨箭 贾立 王兴平 马云
(宁夏大学农学院,银川 750021)
奶牛乳腺炎是由病原微生物感染乳腺组织而产生的一种复杂性疾病,其发病率高,治愈率低,易复发,可造成产奶量下降,乳品质降低,甚至被迫奶牛过早淘汰,给现代奶业造成了极大的经济损失[1]。影响奶牛乳腺炎的因素很多,包括奶牛个体状况、饲养环境(主要为病原微生物)和饲养管理等。在个体状况中,机体固有免疫与乳腺炎的易感性、抗病性和发病程度密切相关[2]。
乳腺组织是宿主被病原微生物侵入时的重要结构屏障,而乳腺上皮细胞(bMEC)是奶牛乳腺组织的主要细胞类型,在宿主被病原微生物侵入后的固有免疫反应中起着重要的作用。近年来,学者们以奶牛乳腺组织和bMEC炎症模型为研究材料,进行奶牛乳腺炎的分子机制研究。本文综述了乳腺固有免疫相关编码基因在奶牛乳腺炎调节中的研究进展,为系统了解奶牛乳腺炎的分子机制提供参考。
1 固有免疫相关编码基因的分类
固有免疫是动物机体在长期进化过程中形成的一种防御机制,可对感染的病原体作出迅速应答,产生非特异抗感染作用[2]。根据编码基因及其蛋白质在固有免疫反应中的作用特点,可将固有免疫编码基因分为:细胞模式识别受体基因(如TLRs和NODs)、信号通路相关基因(NF-κB信号通路等相关基因)、炎症细胞因子基因(TNF-α、IL-6、IL-8、IL-10和IL-1β等)、炎症趋化因子基因(CC、CXC和CXCL家族基因等)、宿主防御素(如BNBD家族和DEFB家族基因)和抗菌肽(如LAP)等。上述基因虽然在功能上相对独立,特点明显,但是在启动固有免疫反应和抗感染作用中具有协同作用,如:bMEC在病原体或病原体相关分子模式(如LPS,E.coli细胞表面成分)的刺激下,可激活Toll样受体(Toll-like receptors,TLRs)和NOD样受体(NOD-like receptors,NLRs)介导的NF-κB信号通路,使促炎症细胞因子和炎症趋化因子的分泌迅速增加[3],从而诱导T细胞活化、增殖与分化,并促使白细胞向感染部位定向迁移,起到抗感染作用[4]。此外,bMEC表达的宿主防御素和抗菌肽具有加强固有免疫反应的作用[5]。
2 固有免疫相关编码基因在奶牛乳腺炎中的表达模式
奶牛乳腺炎的分子机制非常复杂,其发生和发展过程受多个基因的共同调节[6]。为了阐明奶牛乳腺炎的分子调控网络,近年来,国内外学者分别采用候选基因qPCR、基因芯片和高通量测序等技术[7],检测了乳腺组织、bMEC和血液中的基因表达谱,并筛选了大量的差异表达基因(Differentially expressed genes set,DEGs),其中有很多基因功能富集在奶牛乳腺固有免疫信号通路上。
2.1 乳腺组织固有免疫相关编码基因的表达谱分析
奶牛乳腺组织是病原微生物感染的首要部位,在机体固有免疫中极其重要[3,8]。近些年,国内外学者利用qPCR方法在临床乳腺炎奶牛的乳腺组织中检测出了TLR2、TLR4、IL-6、IL-8、IL-1β、TNF-α、CXCL10、CD14和CCL5等DEGs[9-10],而且这些基因参与了TLRs、NF-κB和MAPK等固有免疫相关的信号通路。此外,还发现在病原微生物感染乳腺组织前后,β-防御素家族中的DEFB1、BNBD4、BNBD5、BNBD10和LAP基因在奶牛乳腺组织中的表达量也发生了显著变化[11]。
除了临床乳腺炎的乳腺组织的基因表达谱研究外,学者们也对常见病原菌诱导炎症的乳腺组织进行了高通量测序分析。Mitterhuemer等[12]对感染E.coli6 h和24 h后的奶牛乳腺组织中分别筛选出13个和2 154个DEGs,其中包括抗菌基因(S100A8、S100A9、S100A12和CXCL2),急性期基因(LBP、SAA3、C6、C4BPA和IF)和氧化应激相关基因等,涉及固有免疫应答和炎症反应、抗原处理和呈递、细胞因子的分泌、蛋白质降解和细胞凋亡等过程。而罗仍卓么等[13]在E. coli感染7 d后的奶牛乳腺组织中也筛选出了包括TLR4、S100A8、S100A9和LAP在内的2 388个DEGs。此外,学者们在S. aureus感染的奶牛乳腺组织中也进行了mRNA表达模式研究。Wang等[14]对S. aureus感染的奶牛乳腺组织进行了转录组测序,结果表明在感染组中检测到了602个表达上调和750个表达下调的mRNA,其中ITGB6、MYD88、ADA和TNFRSF1B基因与固有免疫有关。Fang等[15]分别采用高浓度和较低浓度的S.aureus感染奶牛乳房,24 h后在高浓度和低浓度感染组分别检测到194和21个DEGs。罗仍卓么等[13]和Kosciuczuk等[16]采用S. aureus诱导奶牛乳腺组织,前者在诱导7 d后的奶牛乳腺组织中筛选出了1 693个表达上调和949个表达下调的mRNA,后者发现差异表达基因数目和表达水平与奶牛的泌乳期有关。上述研究结果说明,乳腺组织在感染后使得mRNA表达产生变化,来应对抗感染的生物学过程。但是,感染菌的类型、感染剂量、诱导时间和检测方法等都会影响筛选出的DEGs的类型、数目以及表达量变化差异倍数[13,16]。值得一提的是,上述研究结果有一个共同点,即:差异表达基因的KEGG和GO功能富集结果均富集到了TLRs信号通路、趋化因子信号通路和MAPK等固有免疫信号通路上[12-16]。可见,固有免疫信号通路转导是乳腺炎发生和发展的必要生物学过程。
2.2 bMEC炎症反应中的mRNA表达谱分析
bMEC是乳腺组织主要的细胞类型,在外源病原微生物感染乳腺早期发挥重要作用。因此,在研究奶牛乳腺炎的分子机制时,学者们常常以诱导炎症的bMEC作为细胞模型展开相关研究[17]。
众所周知,脂多糖(Lipopolysaccharide,LPS)和脂磷壁酸(Lipteichoic acid,LTA)分别是E.coli和S.aureus的主要致毒因子[18]。Xu等[19]用LPS和LTA刺激bMEC,通过RNA-Seq技术研究这两种不同毒力因子对bMEC转录组的影响,结果在LPS处理组检测到95个表达上调和5个表达下调基因;而在LTA处理组检测到表达上调和表达下调基因各12个,说明在固有免疫应答中,LPS较LTA有更强的感染刺激作用。结合Strandberg等[20]学者的研究结果,共同解释了E. coli常常会引起急性乳腺炎,而S.aureus则会引起慢性乳腺炎。此外,学者们也利用基因芯片技术检测了S. uberis感染的bMEC,发现了固有免疫相关基因C3、IL-8、IFN-γ、IL-10、IL-1β、IL-6、TLR2、TNF-α、SAA3、LF和LBP的mRNA在处理组中的表达量显著上调[21]。Wang等[22]用S56、S178和S36共3株不同毒力因子的S. aureus处理体外培养的bMEC,3 h后进行转录组测序,结果显示S56处理组有1 028个表达上调和692个表达下调的mRNA;S178处理组有249个表达上调和178个表达下调的mRNA;S36 处理组有172个表达上调和47个表达下调的mRNA。上述DEGs功能都富集到了固有免疫相关的NOD样受体和趋化因子受体信号通路上,可见在不同病原菌或病原体相关分子模式(Pathogen-associated molecular patterns,PAMPs)诱导的bMEC炎症反应中,差异表达mRNA参与调节了细胞固有免疫应答和炎症反应。
3 奶牛乳腺固有免疫相关主要信号通路的研究进展
在病原体感染乳腺组织的早期,机体细胞表面的模式识别受体(Pattern-recognition receptors,PRRs),主要包括TLRs和NLRs,可快速识别PAMPs,激活固有免疫相关信号通路,使机体产生免疫应答和炎症反应[2,23]。固有免疫信号通路主要包括TLR2/TLR4介导的NF-κB信号通路和NOD1/NOD2介导的NF-κB信号通路。
3.1 TLR2/TLR4介导的NF-κB信号通路
TLRs是一类细胞跨膜蛋白,广泛表达于包括动物乳腺在内的多种组织,是首先被发现的PRRs[24]。牛TLRs有10个家族成员(TLR1-10)[25],其中TLR2和TLR4分别是识别革兰氏阳性菌和革兰氏阴性菌的主要成员,也是奶牛乳腺感染先天防御的关键传感器[26]。研究表明,在病原微生物感染机体后,TLR2和TLR4基因的表达量升高[27],所表达的蛋白质胞外LRR结构域可识别多种病原微生物的PAMPs[23],而胞内TIR功能域可集结MyD88和TRIF等接头分子。通过信号转导,激活细胞内NF-κB和AP1等炎性信号通路[28],最终使核转录因子活化,导致相关炎性介质基因表达与分泌,招募免疫细胞到感染部位,激活相关免疫细胞,以清除病原微生物[29]。
近年来,学者们发现了miRNA可调节TLRs介导的NF-κB信号通路,从而调控奶牛乳腺炎症[30]。目前已发现牛miR-146a可靶向抑制TRAF6和TLR4基因的表达,负反馈调节TLR4/TRAF6/NF-κB通路,进而缓解bMEC炎症反应[31]。Yang等[32]研究表明,小鼠miR-106a是LPS通过TLR4/NF-κB信号途径刺激炎症反应的负反馈调节因子。上述研究可能为乳腺炎提供一种潜在的分子治疗的方法。
除了TLRs介导的固有免疫分子机制的研究外,学者们也利用这些机制开展了抗炎方面的研究。Gondaira等[33]研究结果表明,活牛分枝杆菌可抑制bMEC中TLR2和TLR4基因的表达。Sun等[34]发现外源性H2S通过减轻LPS诱导的bMEC氧化应激,阻断TLR4/NF-κB通路发挥抗炎作用。而Li等[35]通过超表达泛素样修饰酶1(UFL1)抑制了TLR4/NF-κB通路的激活,减轻了内毒素诱导的内质网应激、细胞凋亡、自噬和氧化应激,从而减轻了炎症反应和细胞损伤。Wang等[36]实验表明苯丁酸钠通过抑制TLR2/NF-κB/NLRP3信号通路而减轻S.aureus诱导的细胞炎症反应。
3.2 NOD1/NOD2介导的NF-κB信号通路
NLRs是发现不久的一类细胞内PRRs,从结构上可分为NLRCs和NLRPs,与多种疾病和自发炎症失调密切相关[37]。NOD1和NOD2是NLRs家族的主要成员,是识别病原体的胞浆受体,可以被PAMPs激活[38]。在稳定状态下,NLRs以自动抑制非活化的形式存在,而在病原体感染后,它们通过C端LRR结构域介导受体相互作用蛋白2(RIP2),激活下游的NF-κB信号途径[39]。有研究表明,NODs还可以与NLRPs分子(如NLRP1、NLRP3和NLRP12)相互作用,并导致Caspase-1的激活和IL-1β、IL-18的活化,与细胞凋亡和炎症坏死有关[37]。除此之外,NODs也可使MAPK信号通路中的Iκ-Bα、P38、ERK和JNK磷酸化,从而使得细胞因子、趋化因子、一氧化氮和活性氧的产生,进而使得细胞产生炎症[40]。
NOD样受体家族是一类重要的模式识别受体,可参与调控乳腺固有免疫进程。Askarian等[37]研究表明,小鼠乳腺中NOD1和NOD2基因表达量与RIP2、NF-κB、IL-6以及TNF-α的表达量成正相关关系,表明NOD1/NOD2可能是S. aureus的识别受体,可通过识别S. aureus激活NF-κB信号通路,促进IL-6和TNF-α的表达,参与免疫应答[41]。Wu等[42]研究发现E. coli感染引起宿主细胞内NOD1和NOD2表达增加,从而激活NLRP 3炎症小体,引起Caspase-1和促炎细胞因子基因的转录上调,促使细胞产生炎症反应。但是,他们又发现可通过添加鼠李糖乳杆菌GR-1来限制过度和有害的炎症反应。Wei等[43]研究表明,通过抑制NOD1依赖的NF-κB激活可使中性粒细胞NOD1的表达略有下降,而NOD1/NF-κB通路的损伤可能导致围产期奶牛感染早期中性粒细胞存活减少,从而引起E. coli型乳腺炎的易感性增加。上述研究为进一步分析NLRs在奶牛不同类型乳腺炎中的分子作用有一定指导意义,为乳腺炎治疗新策略带来了新的前景。
3.3 TLRs与NODs协同调控病原菌引起的固有免疫应答
TLRs可以多途径激活NF-κB信号通路,而NODs只能依赖于RIP2。倘若细胞内RIP2基因被敲除,NODs介导的NF-κB信号通路的活化就会被完全阻断[44]。近些年来有报道称,RIP2也可以激活MAPK信号通路,并且可参与到TLRs介导的信号转导过程中。若RIP2基因缺失,TLRs信号通路诱导的炎症细胞因子的产生就会大程度减少[45]。从以上得知TLRs与NLRs在参与机体免疫反应的过程中有各自的信号通路,但同时又相互协同,识别了病原菌的TLRs会促进NODs mRNA表达的上调(图1)。
尽管如此,在NODs基因缺失的情况下,机体对病原菌的清除能力显著下降,相反,在TLR2/TLR4基因缺失的情况下,机体的固有免疫细胞对病原菌的清除能力并不受过多影响[46]。同样还有研究表明,当TLRs缺失或不足时,NOD1会发挥免疫作用;在机体感染了革兰氏阳性菌时,NOD2可以绕过TLRs途径直接发挥清除病原菌的作用,而NOD1会在NOD2缺失或不足时才会发挥抗感染作用[43]。另外,NOD2基因缺失的巨噬细胞,不能识别菌体的细胞壁成分,此时NOD1活化,激活NF-κB和MAPK途径,从而发挥免疫应答作用[47],这些研究强有力的证实了NOD1/NOD2在机体发挥固有免疫抵抗病原菌的机制中占有重要地位[48]。从以上研究结果可以看出,编码基因调控病原菌引起的固有免疫应答过程是非常复杂的,确定各个信号通路之间的关系尤为重要,通过总结完善PRRs之间协同调控的信号通路机制网络,可为系统了解奶牛乳腺固有免疫的分子调控机制奠定基础。
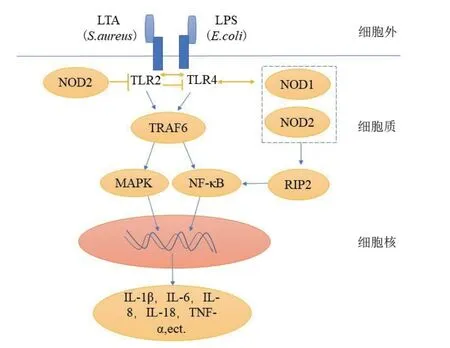
图1 TLRs与NODs协同调控病原菌引起的固有免疫应答[23]
4 固有免疫相关编码基因的SNP与乳腺炎的关联
在奶牛乳腺炎固有免疫相关编码基因方面,除了研究分子调控机制外,学者们也试图挖掘与奶牛乳腺炎易感性或抗病性密切相关的SNP位点。近年来,关于奶牛乳腺炎相关SNP的研究,主要集中在TLRs/NF-κB和趋化因子信号通路相关基因上。
4.1 TLRs/NF-κB信号通路相关基因SNP与乳腺炎的关联
如上所述,TLRs/NF-κB信号通路是奶牛固有免疫的主要信号通路。在奶牛乳房炎SNP挖掘方面,主要集中在TLR4、TLR2和IRAK2基因上。
关于TLR4基因,王兴平等[49]系统检测了荷斯坦牛TLR4基因的SNPs,共发现了31个SNPs,其中EXON2-24和TIR2AA位点上的AA基因型为乳腺炎抗性基因型;陈仁金等[50]发现TLR4基因1760C>T突变位点的等位基因C为优势等位基因,其个体具有更低的体细胞评分(SCS)。Wang等[51]进行了404头中国荷斯坦牛、三河牛和中国西门塔尔牛的TLR4基因的6个SNPs进行单倍型构建及其效应分析,发现Hap2、Hap4和Hap12对SCS有负效应,而Hap13对SCS有正效应。
关于TLR2基因,马腾壑等[52]发现TLR2基因的EcoR V酶切多态位点BB基因型个体的SCS显著低于AA和AB基因型个体,说明BB基因型可能为抵御乳腺炎的有利基因型。Zhang等[53]在TLR2基因编码胞外结构域的编码区检测到385T>G、398G>A和1884G>A的3个错义突变,并发现385T>G位点的GG基因型个体的SCS均值显著低于TT基因型和TG基因型个体。
此外,学者们也进行了TLRs信号通路关键基因IRAK2的多态性与奶牛乳腺炎的关联分析,结果表明IRAK2基因g.28879位点的CC基因型个体的SCS显著低于CT基因型个体,且以加性效应为主;g.28916位点的GG基因型个体的SCS显著低于AG基因型个体[54]。
4.2 NOD2与趋化因子相关基因与乳腺炎的关联
NOD2作为PRRs的主要成员,在乳腺炎的关联分析上,也受到学者们关注。Pant等[55]发现加拿大荷斯坦牛NOD2基因编码区c.3020A>T与SCS的EBVs相关。Wang等[56]在中国荷斯坦牛和中国西门塔尔牛NOD2基因第12外显子144A>T和1594G>A发现两个突变位点的基因型组合BBFF的SCS极显著高于其他基因型组合。在趋化因子基因方面,李虹[57]对奶牛CXCL1基因3'UTR及5'端侧翼区的3个SNPs进行单倍型组合分析发现,H1H1、H2H4和H3H4单倍型组合(H1∶CCA;H2∶CCG;H3∶ATA 和H4∶ATG)具有较低的SCS。郭润晴[58]发现奶牛CCL5基因5'端侧翼区的g.727 T>A可调控启动子的活性,其TT基因型个体的SCS显著高于AA基因型个体,还发现CCL5基因3'UTR的g.7413 G>A可抑制牛miR-2295和靶标3'UTR的结合,其野生型(GG)个体的SCS显著高于突变型(AA)个体。
目前,虽然已经发现了影响奶牛乳腺炎的多个SNP位点,但是这些SNP影响乳腺炎的具体分子调控机制尚不完全清楚,能真正用于抗乳腺炎分子育种的分子标记位点仍然有限,更多的SNP以及调控机制有待于深入研究和在大群体中验证。
5 展望
随着高通量测序和分子生物学技术的发展,对大量数据进一步挖掘成为筛选奶牛固有免疫相关基因和分子标记的重要途径。如前文所述,现已获得了部分奶牛乳房炎固有免疫相关编码基因的表达模式、分子作用机制和分子标记位点。然而,固有免疫反应在不同细胞类型和不同亚细胞结构中有多种识别机制,其在奶牛乳腺炎中的分子调控机制也尚未完全阐明。特别是关于候选基因与乳腺炎的关联性及其群体遗传多态性与乳腺炎的准确关系,以及如何用于分子标记进行辅助抗乳房炎分子育种和分子治疗等方面的研究还很缺乏。因此,继续筛选可能用于提高奶牛固有免疫力的候选基因和分子标记,更深入地探索PRRs之间相互作用以及固有免疫与适应性免疫的联动控制,仍然显得尤为重要。
