抗宫炎片剂的质量状况分析及建议
2020-12-21邬秋萍吴燕红付辉政姜军华许妍
邬秋萍,吴燕红,付辉政,姜军华,许妍
江西省药品检验检测研究院,国家药品监督管理局中成药质量评价重点实验室,江西省药品与医疗器械质量工程技术研究中心,南昌 330029
抗宫炎片现收载于《中国药典》2015 年版一部,为妇科类止带剂下清热化湿药,由广东紫珠干浸膏、益母草干浸膏、乌药干浸膏三味药组成,具有清热,祛湿,化瘀,止带之功效[1]。临床用于湿热下注所致的带下病,症见赤白带下、量多臭味,宫颈糜烂见上述症候者[2]。抗宫炎分散片由抗宫炎片改剂型研制而来,现行标准为原国家食品药品监督管理局注册标准。
本次国家药品抽检共抽取145 批次样品,包括片剂133 批次,分散片12 批次,涉及批准文号12个(占总批准文号80%)、生产企业9 家(占总生产企业81.8%),覆盖31 个省、自治区、直辖市,其中生产企业16 批、经营企业117 批、医疗机构12 批。首先,对不同抽样环节的制剂进行法定检验,再以原料药和制剂的质量问题为导向,在参考文献的基础上[3-5],围绕真实性、有效性、均一性等方面对抗宫炎片剂开展探索性研究,对现行质量标准进行补充完善,从而对抗宫炎片剂的整体质量进行客观评价,并为该制剂的监督管理和质量标准提高提供参考。同时,希望存在问题的相关企业通过评价性抽检结果的反馈信息,了解自身产品质量现状,持续地改进和提高产品质量。
1 仪器与试药
SHIMADZU LC-20AT 高效液相色谱仪(Labsolution 工作站,PDA 检测器);Sartorius BSA 124S-CW 电子天平;Sartorius BS 223S 电子天平;Sartorius BT 25S 电子天平。
对照药材乌药(批号121096-201405)、益母草(批号120912-201008)及对照品去甲异波尔定(批号111825-201402,含量以95.7%计)、连翘酯苷B(批号111811-201002,含量以93.9%计)、金石蚕苷(批号111812-201303,含量以96.9%计)、盐酸水苏碱(批号110712-201513)均购自中国食品药品检定研究院。硅胶G 薄层板购于青岛海洋化工厂分厂,中性氧化铝购于国药集团化学试剂有限公司,超纯水为Milli-Q Direct16 超纯水仪制备,乙腈为色谱纯,其他试剂均为分析纯。
2 法定标准检验
2.1 检验标准
抗宫炎片现行标准为《中国药典》2015 年版一部,抗宫炎分散片现行标准共3 个,本次抽检仅涉及其中2 个标准,执行标准检验项目各不相同,详见表1。

表1 抗宫炎片剂的现行质量标准
2.2 标准检验结果
对9 家生产企业共145 批次样品,按法定标准检验性状、鉴别、检查及含量测定等项目,结果143批次合格(合格率为98.6%),2 批次抗宫炎片不合格(不合格率为1.4%),不合格样品涉及D 和F 两家企业各1 批样品,不合格项目均为连翘酯苷B 含量不合格,由表2 可以看出,不同生产企业连翘酯苷B 和金石蚕苷含量测定结果差异较大,表明不同生产企业投料用的广东紫珠干浸膏质量差异较大。
2.3 标准评价
对法定标准检验结果进行分析,发现执行标准较多,检验项目不统一;项目设置不合理、不完善,如抗宫炎分散片(标准YBZ03152009)中仅测定盐酸水苏碱的含量,对君药广东紫珠未进行定量控制,可能存在伪品投料情况,且未设置乌药的TLC 鉴别项和含量测定项,难以有效控制乌药的质量;检测指标专属性差,如抗宫炎分散片(标准YBZ03152009)设置了盐酸水苏碱的TLC 鉴别和含量测定项,但盐酸水苏碱为广东紫珠和益母草共有成分[6,7],而未设置益母草专属性定性或定量测定项目,难以对益母草质量进行有效控制。
3 探索性研究及分析
3.1 有效性研究
3.1.1 乌药薄层色谱鉴别的修订/增订及统一乌药理气止痛,为方中之佐药,抗宫炎片及分散片(标准YBZ07532009)中设置了乌药的薄层鉴别项,但两个标准方法不一致,故参照药典标准对其方法进行了修订统一。具体方法如下:取本品适量,包衣片除去包衣,研细,取3 g,加甲醇25 mL,加热回流30 min,滤过,滤液蒸干,残渣加水20 mL,加热使溶解,用三氯甲烷振摇提取2 次,每次20 mL,合并三氯甲烷液,蒸干,残渣加乙酸乙酯1 mL 使溶解,作为供试品溶液。另取乌药对照药材2 g,加水煎煮30 min,离心,取上清液浓缩至约20 mL,自“用三氯甲烷振摇提取2 次”起,同法制成对照药材溶液。照薄层色谱法(中国药典2015 年版四部通则0502)试验,吸取供试品溶液20 μL、对照药材溶液4 μL,分别点于同一硅胶G 薄层板上,以环己烷-乙酸乙酯-甲酸(20∶20∶1)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,应显相同颜色的荧光斑点。按上述方法进行检验,结果145 批次样品中10 批次抗宫炎分散片未检出乌药,不合格率为6.9%,且10 批次样品均来自生产厂家H。
3.1.2 益母草的薄层色谱鉴别的修订/增订及统一益母草为方中臣药,抗宫炎片及分散片(标准YBZ03152009)中设置了以盐酸水苏碱为对照的薄层鉴别项,但盐酸水苏碱为广东紫珠和益母草的共有成分,专属性不强,故参照文献[8]新建了以益母草对照药材和盐酸水苏碱对照品为指标的薄层鉴别方法,并对其方法进行了统一。具体方法如下:取本品适量,包衣片除去包衣,研细,取2 g,加乙醇50 mL,超声处理30 min,滤过,滤液加在中性氧化铝柱(100~200 目,5 g,内径为2 cm)上,用乙醇20 mL 洗脱,收集洗脱液,蒸干,残渣加乙醇5 mL 使溶解,作为供试品溶液。取益母草对照药材1 g,加水100 mL 煎煮30 min,滤过,滤液蒸干,残渣加乙醇10 mL使溶解,按供试品溶液的制备方法,取乙醇液自“加在中性氧化铝柱……”起操作,制成对照药材溶液;另取盐酸水苏碱对照品,加乙醇制成每1 mL 含2 mg 的溶液,作为对照品溶液。照薄层色谱法(中国药典2015 年版四部通则0502)试验,吸取供试品溶液、对照药材及对照品溶液各10 μL,分别点于同一硅胶G 薄层板上,以乙酸乙酯-无水乙醇-甲酸(3∶2∶2)为展开剂,展开,取出,晾干,在105℃加热10 min 使薄层板上残留甲酸完全挥尽,放冷,喷以稀碘化铋钾试液-1%三氯化铁乙醇溶液(3∶2)后立即冷风吹干。供试品色谱中,在与对照药材和对照品色谱相应的位置上,应显相同颜色的斑点。按上述方法进行检验,结果145 批次样品均检出益母草和盐酸水苏碱,合格率为100%。
3.1.3 广东紫珠中连翘酯苷B 和金石蚕苷的含量测定广东紫珠为方中君药,连翘酯苷B 和金石蚕苷为其主要活性成分[9],此次被抽样品中,仅抗宫炎片设置了连翘酯苷B 和金石蚕苷的含量测定,分散片仅一个标准设置了紫珠苷(连翘酯苷B)的含量,但提取方法各异,限度差异也较大。因此,参照抗宫炎片标准对抗宫炎片剂中连翘酯苷B 和金石蚕苷的含量测定方法及其限度进行了修订统一。抗宫炎分散片的限度根据处方量折算,暂拟定为连翘酯苷B 不得少于2.0 mg/片(厂家H)和3.0 mg/片(厂家I);金石蚕苷不得少于1.0 mg(厂家H)和1.5 mg/片(厂家I)。经检验:133 批次抗宫炎片样品中有2 批次不合格,12 批次抗宫炎分散片样品全部不合格,尤其是H 厂家的抗宫炎分散片均未检出连翘酯苷B 和金石蚕苷,抗宫炎片剂总合格率为90.3%,各企业测定结果见表2。
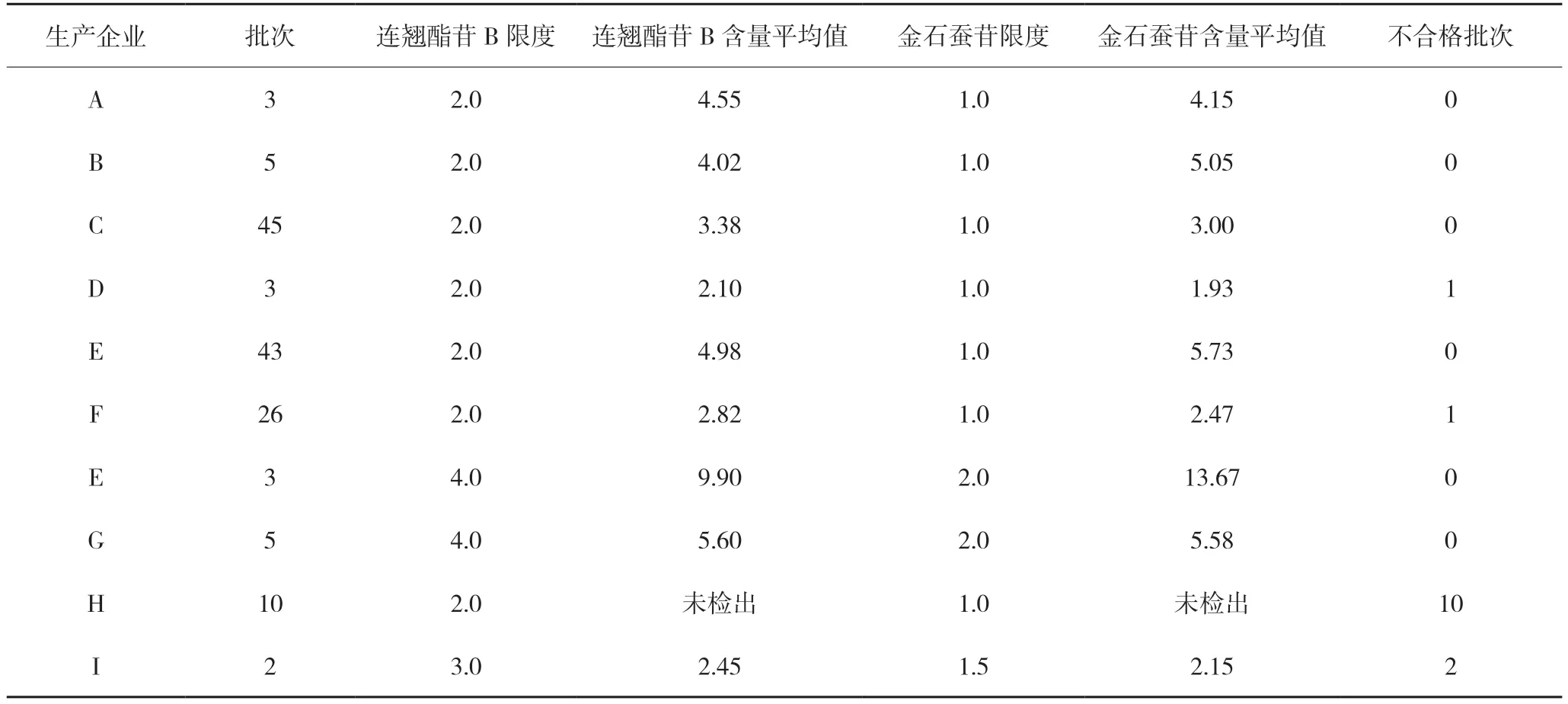
表2 不同企业连翘酯苷B和金石蚕苷含量测定结果 mg/片
12 批次抗宫炎分散片样品均低于拟定限度,分析原因为H 厂家生产的分散片现行标准中广东紫珠仅设有薄层鉴别而未设有连翘酯苷B 和金石蚕苷含量控制项,造成法定标准检验与探索性研究结果不一致,说明法定标准广东紫珠薄层鉴别方法专属性不强,无法控制本品的质量,导致生产企业可能使用了广东紫珠药材混淆品投料生产。I 厂家生产的分散片,现行标准中仅设有连翘酯苷B 的含量测定,但法定标准检验与探索性研究结果不一致,原因为法定标准限度比按《中国药典》2015 年版一部抗宫炎片处方量折算的拟定限度低1 倍,两种方法前处理又不一致,且法定标准未对金石蚕苷进行控制。
3.1.4 乌药中去甲异波尔定的含量测定乌药主要含有挥发油、异喹啉生物碱及呋喃倍半萜及内酯等化学成分,其中生物碱类成分为其主要活性成分,现代药理学研究表明其具有抗菌、抗病毒、抗炎镇痛、抗肿瘤、抗氧化等广泛的药理活性[10,11]。原标准无乌药含量测定项,处方中乌药干浸膏是乌药药材经水提取得到,研究表明其主要成分以异喹啉生物碱去甲异波尔定为主[12],为更好地控制抗宫炎制剂中乌药质量,参照《中国药典》2015 年版一部乌药药材中去甲异波尔定的含量测定方法,新建了抗宫炎片剂乌药中去甲异波尔定的HPLC 含量测定方法,并对其限度按制剂处方量进行了统一。
《中国药典》2015 年版一部乌药的限度为“含去甲异波尔定不得少于0.40%”,乌药干浸膏为水煎煮液浓缩制备而成,根据企业调研得知乌药实际生产中去甲异波尔定转移率在10~20%之间,故转移率按10%计,暂拟定抗宫炎片限度为规格(1)和(2)分别不得少于0.28 mg/片和0.56 mg/片,分散片限度为厂家H、I 分别不得少于0.28 mg/片、0.42 mg/片。按新建的含量测定方法检验,结果133 批抗宫炎片样品仅14 批合格,119 批不合格,不合格率高达89.5%;12 批分散片样品仅2 批合格,其余10 批样品中均未检出去甲异波尔定,含量为0,不合格率高达83.3%。各企业含量测定结果见表3。
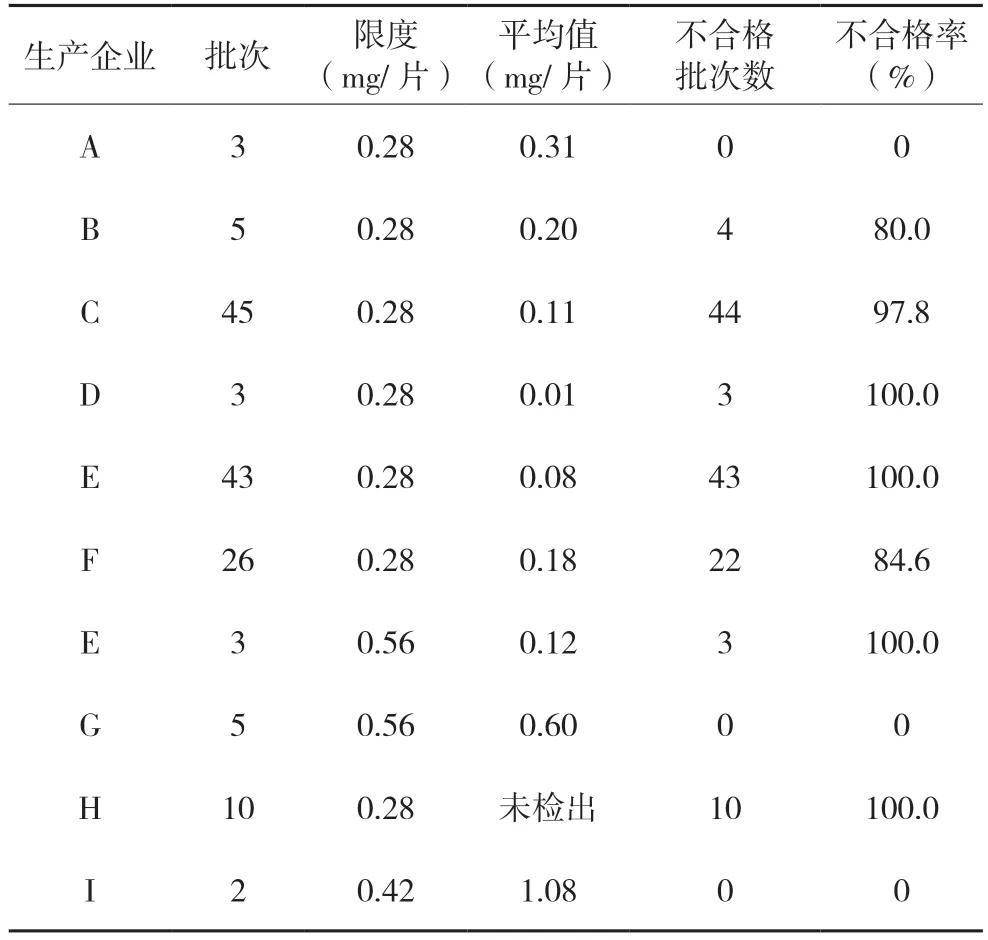
表3 不同企业去甲异波尔定含量测定结果
由表3 结果分析,133 批次抗宫炎片119 批次不合格,涉及5 家生产企业,D 厂家和E 厂家不合格率均为100%,C 厂家不合格率达97.8%,A 厂家和G 厂家全部样品均合格。从133 批片剂7 家生产企业的箱式图(详见图1)看,不同企业样品及同一企业不同批次样品中去甲异波尔定含量差异均较大。说明同一企业和不同企业间所用乌药药材原料质量参差不齐。12 批次分散片中10 批次不合格且均未检出去甲异波尔定,不合格样品均来自H 厂家,说明该企业所用乌药药材原料不正确或未投料生产。
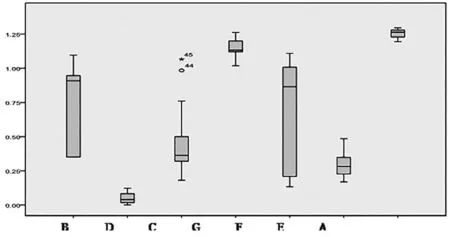
图1 不同企业抗宫炎片去甲异波尔定含量分布箱式图
3.2 整体质量控制研究
前面已建立的广东紫珠和乌药干浸膏含量测定方法,但仅针对个别指标成分,为了进一步对抗宫炎片剂的整体质量进行控制,参照《中国药典》2015 年版一部抗宫炎片标准中指纹图谱的方法,建立了抗宫炎片剂的指纹图谱方法。
结果145 批次样品涉及9 家企业,除H 厂家生产的10 批抗宫炎分散片未检测到广东紫珠特征成分连翘酯苷B 和金石蚕苷,同时未检出乌药中特征成分去甲异波尔定外,其它样品均合格。不同企业间、同一企业不同批次之间相似度在0.91~0.99之间。提示:各企业所用原料质量差异大,同一企业不同批次间差异显著。
4 讨论
4.1 总体评价
综合上述检验结果进行分析,抗宫炎片剂总体质量一般,按法定标准检验,145 批次样品2 批次连翘酯苷B 不合格,合格率为98.6%,但按探索性研究方法进行检验,仅有14 批次抗宫炎片合格,抗宫炎分散片全部不合格,合格率仅为9.7%。
4.2 主要问题及原因分析
综合法定检验和探索性研究结果,发现抗宫炎片剂主要存在以下几方面问题:首先,发现存在原料未投料或使用混淆品投料的重大问题,如H 厂家生产的10 批次样品均未检测到广东紫珠和乌药的特征成分,可能原因为广东紫珠使用大叶紫珠、裸花紫珠等混淆品投料,该企业所用乌药药材原料不正确或可能未投料生产。其次,现行质量标准较多且不统一,部分标准检验项目设置不完善,检测指标专属性差、设置不合理,含量限度设置不合理等。第三,原药材存在非药用部位投料的问题,如乌药使用茎枝,质老、不成纺锤状的直根等非药用部位投料,研究发现9 家生产企业仅3 家企业乌药中特征成分去甲异波尔定含量全部合格,4 家企业全部样品均不合格。
4.3 建议
基于以上发现的问题,提出以下建议:建议完善抗宫炎片剂质量标准,建立以益母草对照药材为指标的专属性薄层鉴别方法,增加乌药中去甲异波尔定的含量测定项,统一修订抗宫炎片剂中乌药、益母草的薄层鉴别及广东紫珠、乌药的含量测定项,加强整体质量控制;建议有关监管部门对涉嫌违法违规生产的企业留样进行核查;建议政府加强企业GMP 核查中原药材的监查,引导、规范企业生产,企业加强对中药材及饮片专业鉴定人才的培养,提高从业人员的业务素质,从源头防止劣质药材;建议企业建立广东紫珠和乌药GAP 种植基地。
