蜂蜜中多酚类物质的定量分析及其在蜂蜜种类鉴别中的应用研究
2020-12-21张晓华刘丹丹郑晶晶吕天凤林芳马艺欣
张晓华,刘丹丹,郑晶晶,吕天凤,林芳,马艺欣
(许昌学院 食品与生物工程学院,河南省食品安全生物标识快检技术重点实验室,河南 许昌 461000)
蜂蜜中许多物质为人体代谢所必需的物质,具有很高的营养价值,受到越来越多消费者的青睐[1-3]。另外,其常作为辅料添加到各类食品中,增加食品的风味和营养价值[4-6]。蜂蜜市场需求量大,部分不法商贩为了从中获取暴利,对蜂蜜进行掺假勾兑,用以次充好等不法手段制造质量不合格的蜂蜜,严重扰乱了蜂蜜市场。由于掺假蜂蜜和其他形式的冒牌蜂蜜中活性组分的种类和含量与蜜源蜂蜜存在较大差异,可以作为蜂蜜地域、蜜源和品质鉴别的重要指标,用于不同种类、不同产地和不同品质蜂蜜的甄别研究。但是蜂蜜背景复杂,活性物质种类繁多,含量相对较低,在多种未知干扰物质共存的条件下,实现多酚类物质的定性定量分析具有一定的困难。近几年,随着化学计量学的快速发展,尤其是多元校正技术的发展,可以很好地解决此类定性识别和定量检测的问题。它通过“数学分离”将重叠的谱图分辨为各个纯的分析物、干扰物质、仪器噪声以及基线漂移等的谱图,即所谓的“二阶优势”[7-10]。也就是说,在未知干扰物质共存的条件下,它可以利用“数学色谱”代替“普通色谱或质谱方法”,快速、同时和准确地实现感兴趣分析物的定性和定量分析。目前,这种联合策略已在食品、药品、环境和化妆品等领域得到了广泛的应用[11-13]。对于基于色谱联用仪器的定量分析中存在的色谱流出时间和基线漂移等因素,该方法可以很好地进行校正,获得更为准确的结果。在本文中,由于蜂蜜中多酚类物质含量较低,低于色谱DAD检测器的检测下限,被淹没于基线背景中,我们采用灵敏度更高的液相色谱串联单级质谱仪采集蜂蜜样本中多酚类物质的“色谱-质谱-浓度”三维数阵,再利用基于交替三线性分解(alternating trilinear decomposition,ATLD)算法的化学计量学二阶校正方法进行分辨处理。基于“二阶或高阶优势”,可以很好地分辨得到各个目标组分合理的色谱和质谱图以及准确的浓度预测,实现蜂蜜复杂背景与未知干扰物质共存下4种多酚类物质的同时、直接、快速、准确定量分析。另外,本研究方案基于多酚类物质的定量结果,利用“简单聚类”分析方法,实现了蜂蜜种类的鉴别,为蜂蜜的品质控制分析提供一个切实可行的研究思路。
1 材料与方法
1.1 试剂与仪器
本实验所用到的4种标准物质对香豆酸(p-coumaric acid)、槲皮素(quercetin)、山奈酚(kaempferol)和白杨素(chrysin)均为色谱纯,购自上海阿拉丁生化科技股份有限公司。其他试剂也均为色谱纯,其中,乙腈和甲醇购自赛默飞世尔科技(中国)有限公司。本实验所研究的3种蜂蜜由河南卓宇蜂业有限公司提供。
液相色谱-质谱联用仪(配有电喷雾离子源(ESI)及MassHunter工作站B.08.00):型号1290-G6470A,购自美国安捷伦科技有限公司;其他仪器为实验室常规仪器。
1.2 实验方法
1.2.1 蜂蜜样品的预处理
本实验所研究的3种蜂蜜购自许昌市大型超市,通过以下步骤进行预处理:(1)对于所研究的3种蜂蜜,分别称取10.00 g左右,并置于50 mL离心管中;(2)加入乙腈提取液,经漩涡混合器和超声波清洗器充分混匀,将所得混合液在4 ℃、10000 r/min条件下离心15 min后,转移上清液于分液漏斗中;(3)对离心管的沉淀物重复步骤(2),混合两次所得上清液;(4)对所得上清液利用乙腈饱和的正己烷溶液分两次进行提取,提取后的下层样品转移至旋蒸瓶内;(5)将样品提取液放置于旋转蒸发仪上30 ℃蒸干至残渣;(6)用流动相定容至10 mL,过0.22 μm的滤膜备用。
1.2.2 样本的配制
用纯甲醇配制4种分析物的储备液,其浓度如下:1.020 mg/mL对香豆酸、1.090 mg/mL槲皮素、1.070 mg/mL山奈酚和0.1008 mg/mL白杨素。所配制的储备液储存在4 ℃的冰箱中备用,不同浓度的工作液用流动相(35%乙腈∶65%水,V/V)稀释相应的储备液所得。
校正样和验证样:校正样是通过先加入不同体积的工作液,然后用流动相稀释到1 mL而制得,具体浓度见表1。同时,我们设计了3个不同浓度水平(低、中、高)的验证样用来测试ATLD-LC-MS方法的准确性。这些验证样只包含4种多酚物质,不含其他干扰,它们的浓度均在校正样范围之内。
蜂蜜样和蜂蜜加标样:本实验中,对于每一种蜂蜜,我们设置了5个蜂蜜样本,各个样本所称取的蜂蜜质量不同。另外,为了验证方法的准确性,在各个蜂蜜样本中添加不同浓度水平的分析物标准溶液制成加标样,每个类型的蜂蜜,设计了5个加标样本。加标样本中各个分析物的最终浓度在其线性范围内。注射到色谱系统之前,每个加标样的处理方式和蜂蜜样本相同。校正样、验证样和蜂蜜加标样中目标分析物的浓度见表1。

表1 校正样、验证样和蜂蜜加标样中 目标分析物的浓度Table 1 The content (μg/mL) of the analytes in calibrated, validated and spiked honey samples
1.2.3 色谱-质谱条件
高效液相色谱系统由一个配有100 μL进样环的自动进样器和一个安捷伦1290 Infinity系列双二元泵组成。色谱分离是在Agilent Eclipse Plus C18 RRHD反相液相色谱柱中进行(1.8 μm,50 mm×2.1 mm i.d.)。质谱检测用的是安捷伦G6470系列三重四极杆质谱仪,使用电喷雾离子源在负离子模式下工作。质谱仪参数设置:雾化器压力40 psi,Fragment电压220 V,毛细管电压4000 V,干燥气流速8 L/min,干燥气温度300 ℃。为了后续进行化学计量学ATLD方法辅助分析,质谱检测器在全扫描模式下采集数据,扫描范围是50~400 amu,间隔0.1 amu,扫描速度0.514 s/cycle。
色谱流动相为乙腈∶水35∶65(V/V),柱温为30 ℃,进样体积为5 μL,流速为0.3 mL/min。
2 理论部分
LC-MS在全扫描模式下对单个蜂蜜样本分析可产生一个二维矩阵数据,每个数据点都是由两个参数构成:其中一维是保留时间,另一维为质荷比(m/z),该二维数阵的大小为I×J(保留时间×质荷比)。通过对K个样本(包括校正样、蜂蜜样和蜂蜜加标样)的多次HPLC运行可以收集得到一个三维数阵,其大小为I×J×K(保留时间×质荷比×样本数)。如果每次LC-MS扫描得到的色谱峰无明显的色谱保留时间漂移和基线漂移,那么这个三维数阵就符合三线性结构,数据阵X 中的每个元素xijk可以表示为:
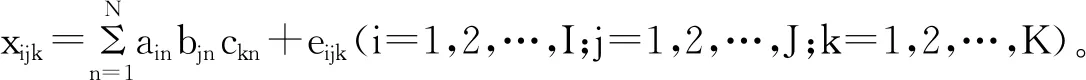
(1)
式中:N 代表总因子数,包括可检测到的目标组分、背景、仪器噪声和未校正的干扰物;xijk是X 中的元素,表示样品k在保留时间i和质荷比j时的离子流强度;ain、bjn和ckn分别为归一化色谱矩阵A(I×N)、归一化质谱矩阵B(J×N)相对浓度矩阵和C(K×N)中的元素;eijk是大小为I×J×K的三维残差数据阵E 中的元素。
ATLD算法由吴海龙教授等于1998年提出[14],它是基于最小二乘原理基础上的迭代算法,具有对组分数不敏感、收敛快速等优点。据文献报道,ATLD算法能够在占用最小计算机内存的情况下以最快速度给出较好的定性和定量分析结果。所以,本研究工作中,我们选用ATLD算法进行目标分析物的同时定性定量分析。关于该算法详细信息此处不再赘述,请参考相关文献。另外,本文所有的计算均在Matlab平台上进行,采用Matlab语言来编译算法及相关运行程序。
3 结果与讨论
3.1 多酚类物质色谱行为分析
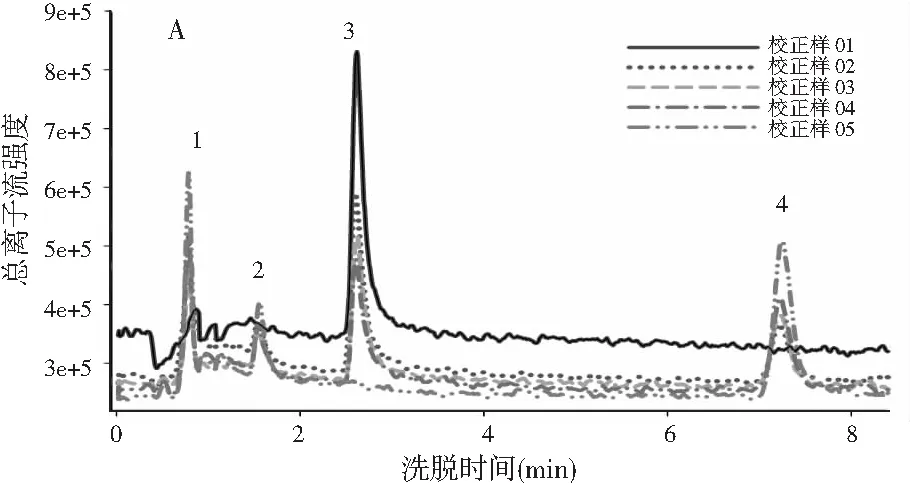
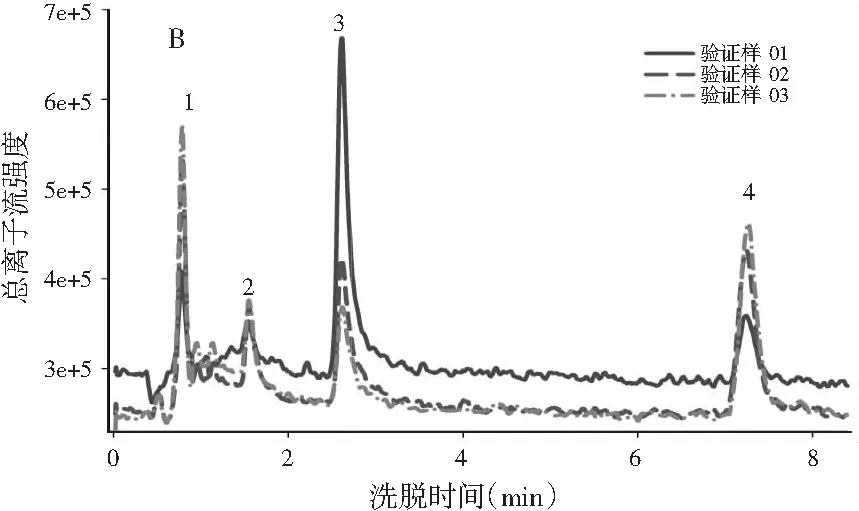
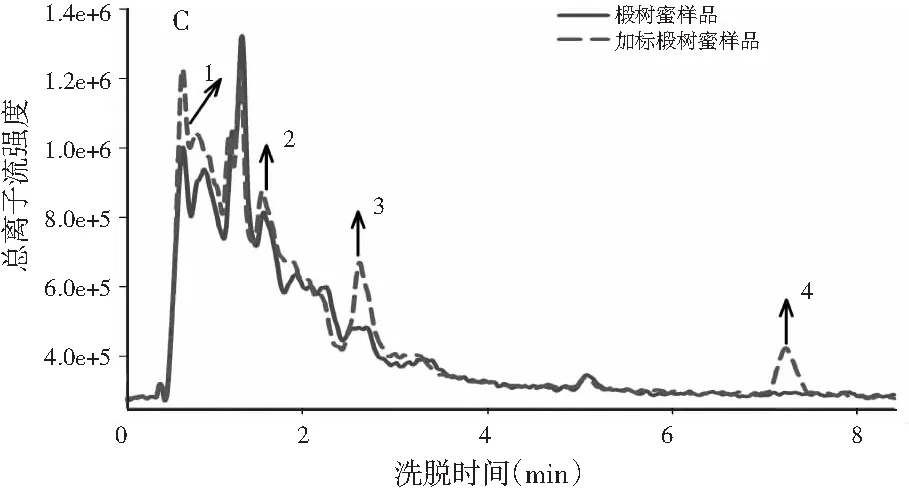
图1 基于LC-MS全扫模式的总离子流图Fig.1 The total ion current diagram based on LC-MS full scan mode
3.1.1 LC-MS实验所遇到的问题
图1中A和图1中B分别为校正样和验证样的总离子流图,图1中C以椴树蜜为例展示了蜂蜜样和蜂蜜加标样的总离子流图。由图1中A和图1中B可知,4种目标分析物的谱图出现了基线漂移。另外,由于对香豆酸的流出时间较短,仅为0.78 min,谱图上还出现了一些其他仪器噪声干扰。在实际蜂蜜样本中,背景更为复杂,往往会含有许多未知和未校正的干扰物,这些干扰物质会在目标分析物的出峰时间段出峰,这一点可以从图1中C所示的蜂蜜样和蜂蜜加标样中得到验证。
鉴于蜂蜜背景的复杂性,要实现目标分析物与背景中干扰物质的完全分离,则需要非常长的分析时间,或者根本无法实现完全分离,这一难题可以借助先进的串级质谱技术(MS/MS)得以解决。然而,复杂且精密的串联质谱仪器价格相对昂贵。而且,基于MS/MS的多重反应监测(MRM)方法需要花费大量的时间和精力优化各种各样的串级质谱条件,如碎裂电压、碰撞能量、定性和定量母离子及子离子等。在本文中,我们利用LC-MS结合ATLD算法的分析策略,巧妙地借助化学多元校正的“数学分离”这种软策略来代替三重四极杆质谱仪(Q2)和第三重四极杆(Q3)实现对离子的二次选择功能,在很短的时间(t<8.00 min)内就完成了多酚类物质的定性定量分析。
3.1.2 非线性因素的考察
由于进样时间、柱温、柱压或流动相组成等的改变,色谱分析中常会出现一些非线性现象:例如峰形改变、基线漂移或者时间漂移等,将会影响最终的定性和定量结果。因此,在使用ATLD算法分析实验所获得的三维数据矩阵(保留时间×质荷比×样本数)之前,我们要测试其是否满足三线性结构。当非三线性因素较为严重时,分辨结果将会出现较大的偏差。由图1中A可知,5个校正样中4种分析物所对应的峰位置基本相同,且每个峰的形状也基本相似。因此,我们可以认为,本实验中所采用的色谱和质谱的条件相对稳定,4个目标分析物没有明显的时间漂移,所获得的LC-MS数据基本符合三线性结构,故可使用ATLD算法来进行定性定量分析。
然而,在一些其他HPLC联用实验中,尤其当色谱流出时间较长时,时间漂移和基线漂移将无法避免。这种情况下,可以使用其他一些灵活的化学计量学多元校正方法,例如MCR-ALS(multivariate curve resolution-alternating least squares)或者PARAFAC2 (parallel factor analysis 2)等[15-17]。这些方法一般是处理展开的三维数阵,因此对数据的三线性结构没有严格的要求,可以很好地处理非三线性数据。目标分析物的线性方程、相关系数、保留时间和验证样的平均回收率见表2。

表2 目标分析物的线性方程、相关系数、 保留时间和验证样的平均回收率Table 2 The regression equations, correlation coefficients, retention time and average recovery rates of the four target analytes in the validated samples
3.2 ATLD-LC-MS方法的验证
在利用ATLD算法分辨蜂蜜样本之前,我们设计了3个不同浓度水平的验证样本来测试所运用ATLD-LC-MS方法的准确性。这些验证样本只包含4种目标分析物,不含任何其他干扰,并设计在校正样浓度范围之内。
图2中A1~A4、B1~B4、C1~C4分别展示的是利用ATLD算法分辨得到的验证样的归一化总离子流色谱图、归一化质谱图及相对浓度图。由图2可知,使用ATLD算法是可行的,成功地解决了色谱峰的基线漂移和仪器信号的干扰,实现了4种多酚类物质的同时定量分析。由于ATLD建模不设置任何约束条件,由图2中A1~A4可知,总离子流图中出现了几个负且嘈杂的轮廓(图中的虚线表示),可以看作是仪器噪声或其他非三线性成分。需要注意的是,由于总离子流色谱和质谱数据是归一化的,组分的强度信息可从相对浓度矩阵中看出。另外,验证样的定量结果见表2,4种目标分析物的线性相关系数都在0.9900以上,平均回收率接近100%,说明本文的ATLD-LC-MS分析策略准确可行。
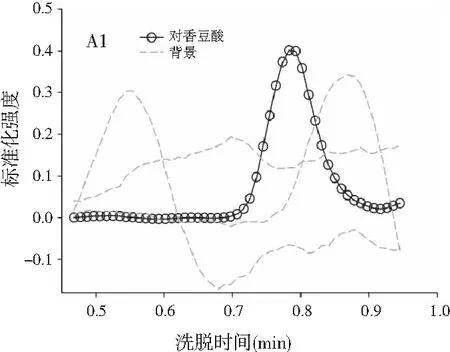
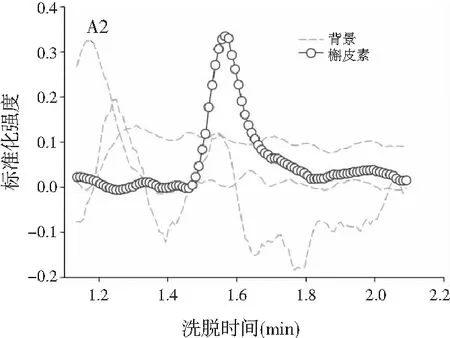
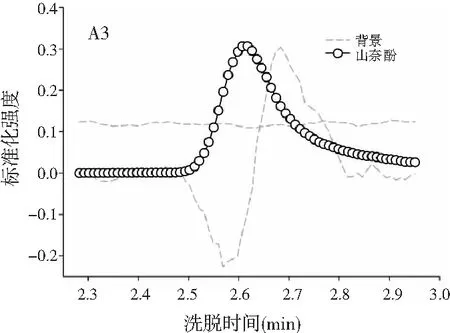
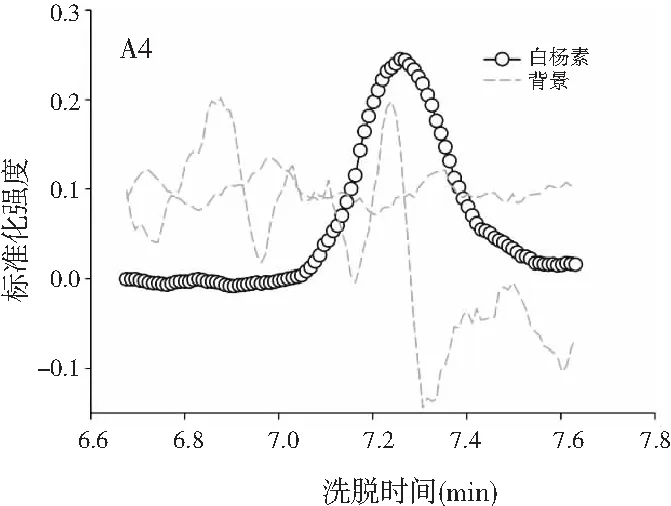
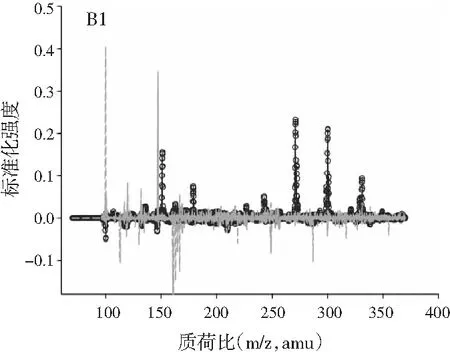
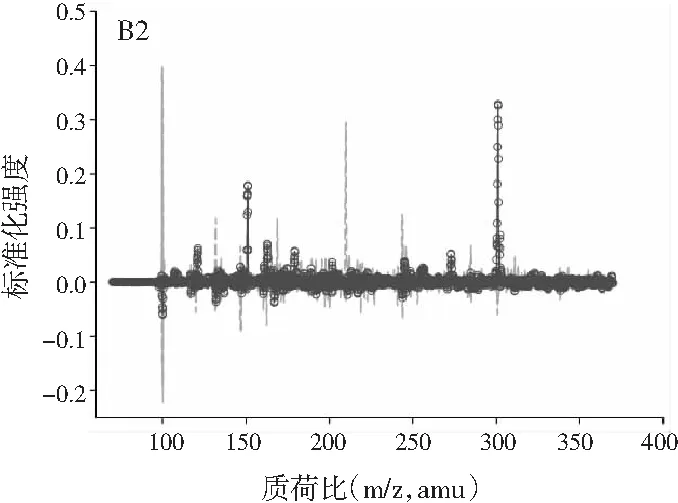
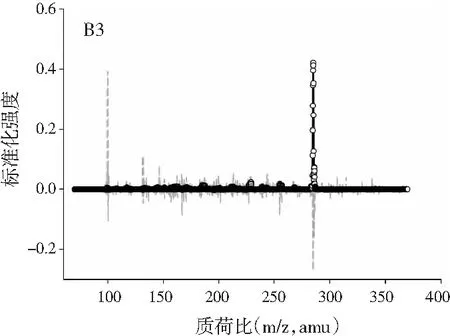

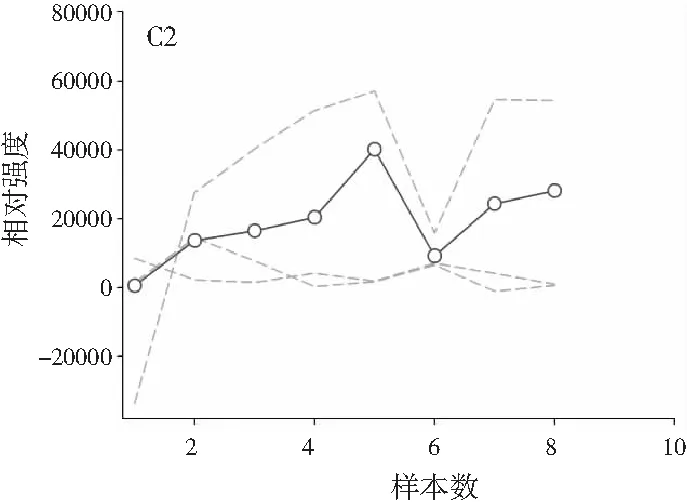
3.3 利用ATLD算法实现蜂蜜样本中4种多酚类物质的定量分析
本部分内容将基于ATLD算法的二阶校正方法直接用于蜂蜜样本中多酚类物质的定量分析。由于蜂蜜背景基质异常复杂,很难客观地预测其真实的组分数,因此本工作中使用核一致方法(core-consistency diagnostic, CORCONDIA)预估计体系的组分数[18]。CORCONDIA法是使用频率较高的组分数的估计方法之一,利用三维数据分解的唯一性,比较PARAFAC模型中超对角阵T和Tucker3模型的核心矩阵G之间的相似程度来进行组分数的估计。
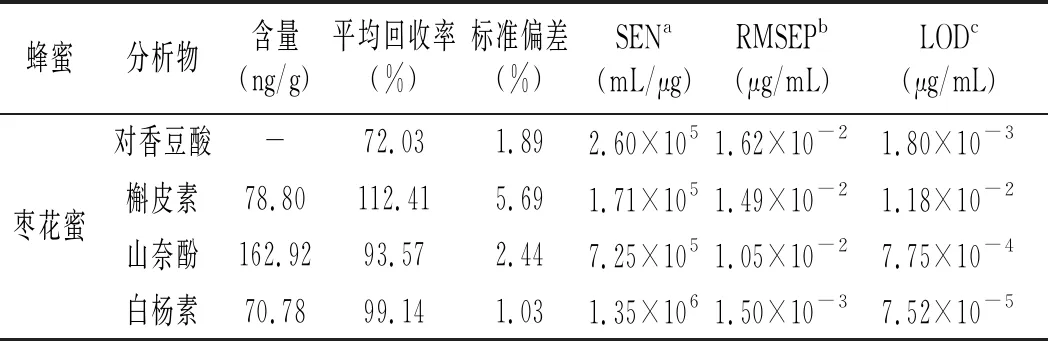
表3 蜂蜜样本中4种多酚类物质的含量、 平均回收率和相对偏差Table 3 The content, average recovery rates and relative deviations of the four polyphenols in honey samples
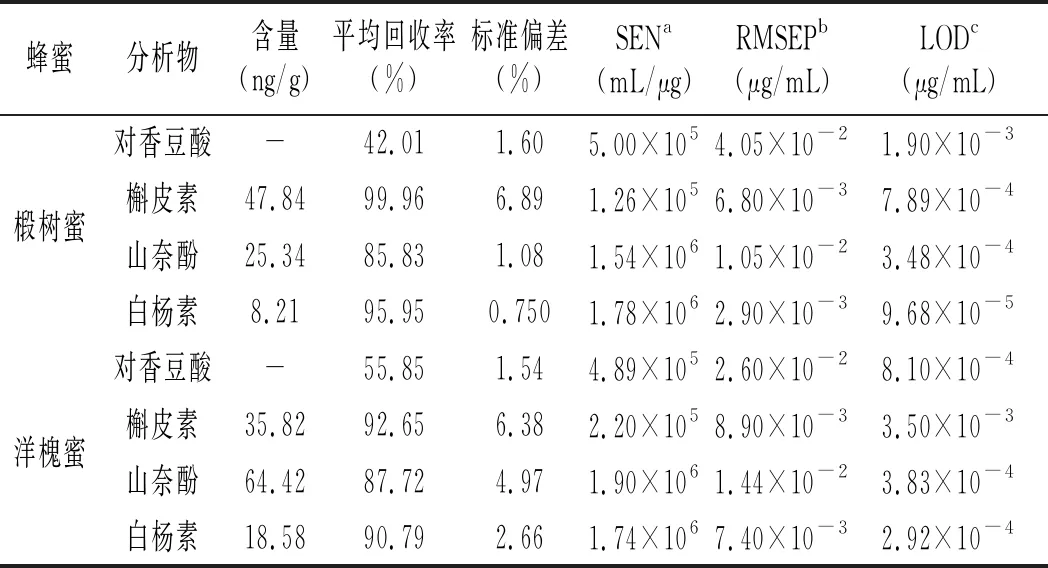
续 表
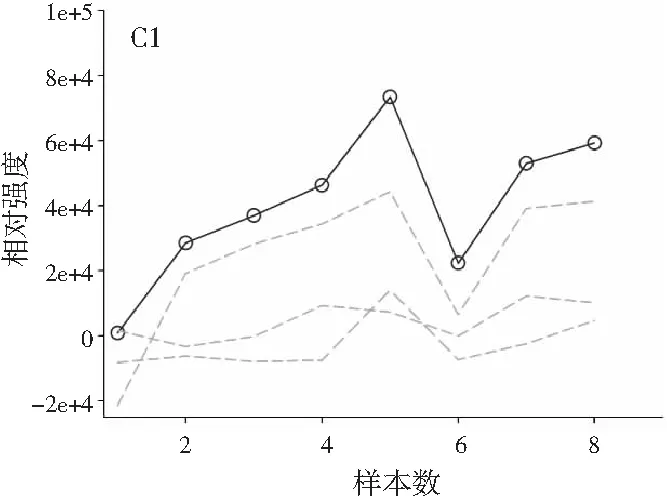
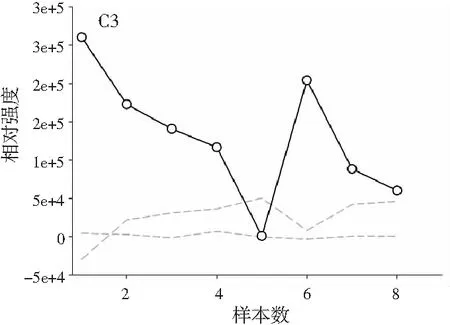
图3分别为分辨得到的洋槐蜜中4种目标分析物归一化的总离子流色谱图、归一化的质谱图和相对浓度图。
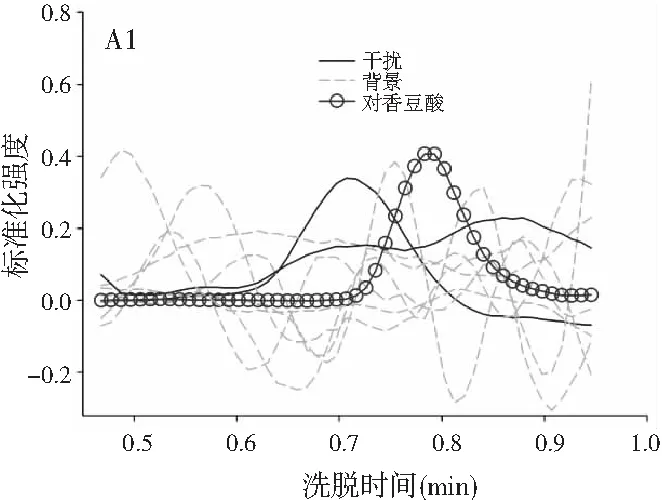
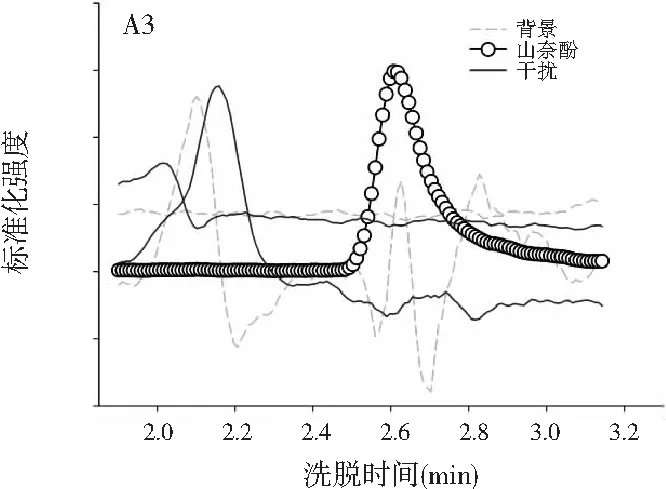
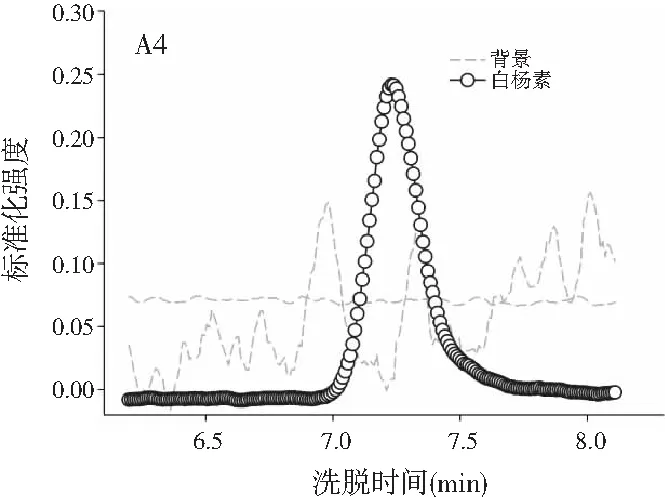
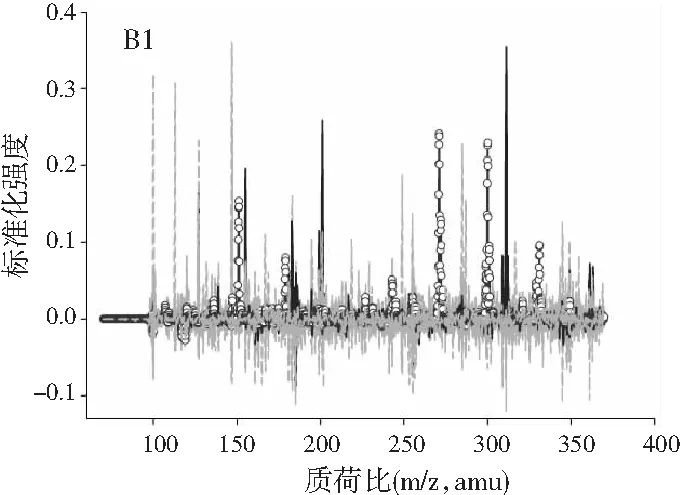
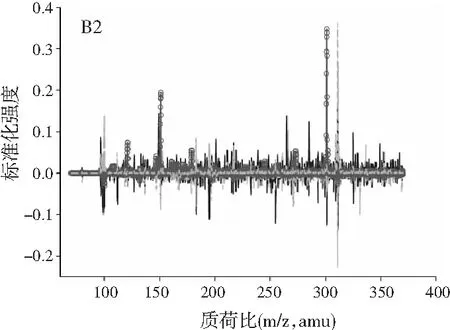
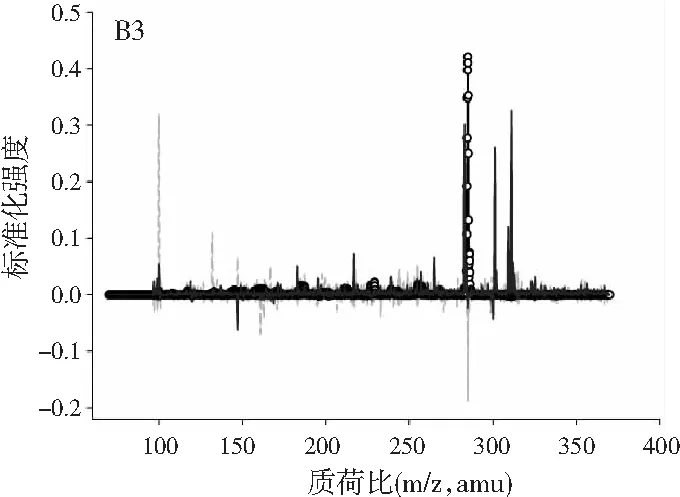
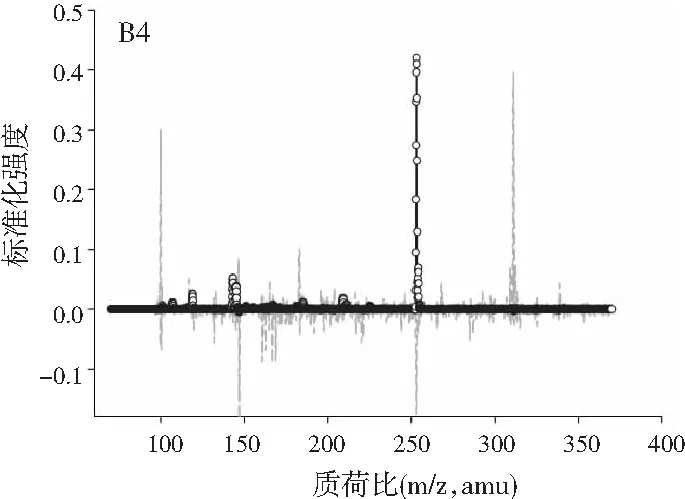
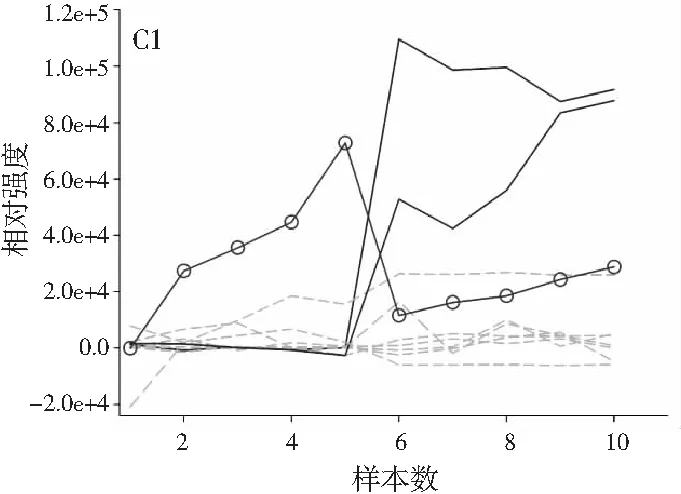
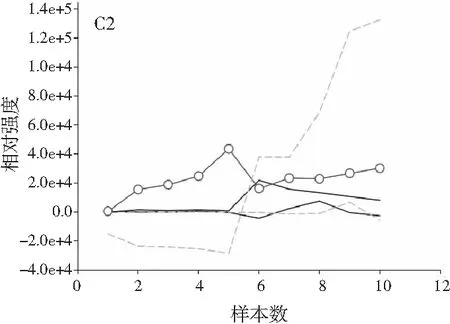
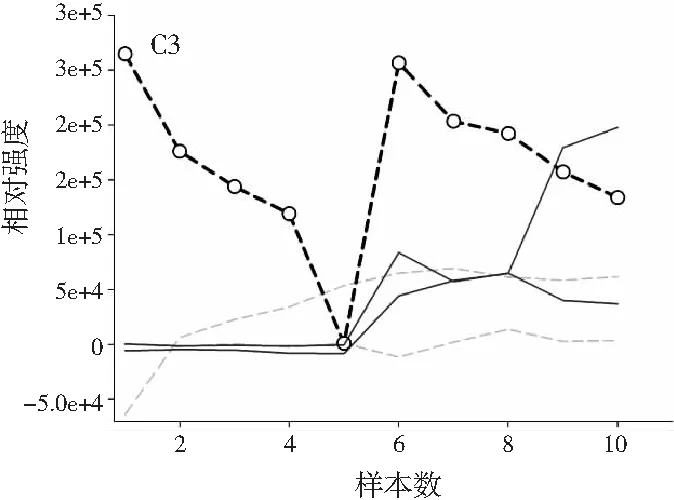
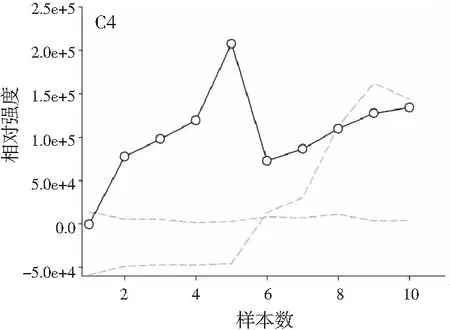
图3 基于ATLD方法的洋槐蜂蜜样本中目标分析物的 归一化色谱图(A1~A4)、归一化质谱图(B1~B4) 和相关浓度图(C1~C4)Fig.3 The normalized chromatogram (A1~A4), normalized mass spectrometry (B1~B4) and relative concentration (C1~C4) of the target analytes in acacia honey samples obtained by ATLD
由图3可知,对于实际的蜂蜜样品,尽管我们对蜂蜜样品进行了一些简单的前处理,但依旧存在大量未知未校正干扰物与目标分析物共流出。如果要实现目标组分与背景中的干扰物完全分离,要么需要很长的分析时间,要么前处理极其复杂。尤其是对香豆酸,其流出时间比较靠前,相对干扰尤为严重,利用ATLD算法进行分辨时,我们选取了10个组分数才得到了正确的色谱-质谱分辨结果以及准确的浓度预测值。其中,2个组分数用于模拟蜂蜜中的未知干扰物质,7个组分数用于扣除背景基线和拟合仪器噪声等。其他两种蜂蜜(枣花蜜和椴树蜜)的分辨结果与洋槐蜜相似。虽然4种目标分析物的流出时间较短,有很强的仪器噪声和背景干扰,但是基于ATLD算法,用“数学分离”的方法在很短的分析时间(t<8.0 min)内获得目标分析物精准的定量分析结果,充分说明了本文发展的ATLD-LC-MS方法用于蜂蜜中的4种多酚类物质的定性识别和定量检测的分析策略是完全可行的,具有良好的应用前景。
对于每一种蜂蜜样本,我们设置了5个加标样来验证定量结果的准确性,其定量结果见表3。由于研究的物质和蜂蜜种类较多,为了简单起见,表3中只列出了各个分析物在各种蜂蜜中的平均回收率。由表3可知,3种蜂蜜中对香豆酸的加标回收率都偏低,分析可能存在的原因主要有3个方面:(1)基质效应的影响,为主要影响因素;(2)蜂蜜中其他干扰物质共流出的影响,流出时间靠前的目标分析物影响较大;(3)蜂蜜处理方法的影响,前处理后蜂蜜pH值也可能产生一定的影响。在后续的实验中我们将尝试进一步加大色谱的分离度,尝试使用二阶标准加入法,考虑其他蜂蜜的处理方法,例如过固相萃取柱等,进一步考察相关原因。
由表3可知,其他3种物质(槲皮素、山奈酚和白杨素)的加标回收率令人满意,其值为 86%~112%,这说明该分析策略基本可以实现复杂基质蜂蜜中多酚类物质的准确定量。3种目标分析物在各种蜂蜜中的含量不尽相同,其中,槲皮素含量由高到低排序为:枣花蜜>椴树蜜>洋槐蜜;山奈酚含量由高到低排序为:枣花蜜>洋槐蜜>椴树蜜;白杨素含量由高到低排序为:枣花蜜>洋槐蜜>椴树蜜。由表3可知,白杨素的含量差别最大,高达8.6倍,为下一步进行蜂蜜品种的鉴别奠定了基础。
3.4 ATLD-LC-MS方法的评价
本文通过选取SEN、LOD和RMSEP等品质因子评价ATLD-LC-MS方法的性能,结果见表3。由3表可知,本方法的灵敏度在1.26×105~1.90×106mL/μg之间,说明该方法的灵敏度较高。此外,检测下限和预测均方根误差范围分别为7.52×10-5~1.18×10-2μg/mL和1.50×10-3~4.20×10-2μg/mL。考虑到所研究背景的复杂性以及强浓度的背景干扰,所得结果基本令人满意。
3.5 蜂蜜的品种鉴别
由表3可知,不同蜂蜜之间各种多酚类物质的含量存在显著的差异。其原因可以归结为花源和一些环境因素(如土壤、季节、温度和气候)等的影响。因此,可以考虑基于多酚类物质的含量进行蜂蜜种类的区分。由于对香豆酸的定量结果不尽如人意,而其他3种多酚类物质的结果较好,所以,本文采用蜂蜜中槲皮素、山奈酚和白杨素的含量对蜂蜜的种类进行了区分,结果见图4。
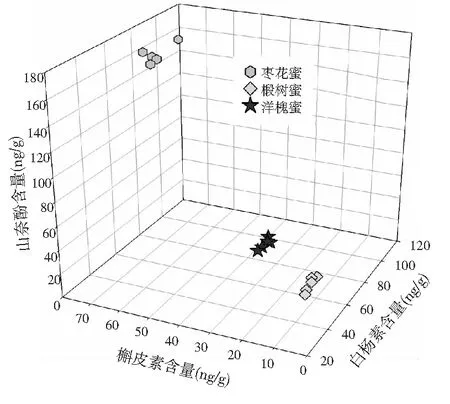
图4 基于ATLD-LC-MS方法的定量结果 进行蜂蜜种类的区分Fig.4 The classification of honey species based on the quantitative results of ATLD-LC-MS
由图4中可以明显看出蜂蜜样本自动聚集为3组,分别对应于本工作中所检测的3种蜂蜜。尽管实验中用于分类的数据有限,基于ATLD方法得到的槲皮素、山奈酚和白杨素的定量结果,结合“简单聚类分析”成功实现了3种蜂蜜的种类区分。实验结果再次表明:该分析方法对于蜂蜜品质控制具有一定的理论意义和实际意义,可以为解决目前蜂蜜市场上品种混乱、品质不佳、掺假造假等问题提供一定的参考和指导。
4 结论
本实验采用ATLD-LC-MS方法实现了蜂蜜中多酚类物质的同时定性和定量分析,借助于二阶校正方法的“数学分离”功能简化了传统的“物理或化学分离”。利用液相色谱单级质谱仪实现了严重未知干扰物质共存的条件下,目标分析物的定性和定量分析。本文通过统计与品质因子(SEN、LOD和RMSEP)对所发展的ATLD-LC-MS方法的性能进行了验证,考虑到所研究蜂蜜背景基质的复杂性,产生了强浓度的背景干扰,结果基本令人满意。另外,基于上述定量结果,成功实现了蜂蜜种类的区分,区分效果明显。该方法进一步优化和改进后,同样可适用于蜂蜜掺假的鉴别等。本文发展的ATLD-LC-MS方法具有快速、精准、绿色环保、廉价和简单等优点,可用于复杂基质中目标分析物的同时定量分析,为蜂蜜的品质控制提供了一定的理论参考。
