内蒙古绒山羊miRNA-1298-5p 与TGF-βR1 基因在绒毛生长周期中的表达规律研究
2020-12-21肖红梅梁加越胡小玉樊晓娟王笑冰
肖红梅,梁加越,冯 娟,胡小玉,樊晓娟,王笑冰
(1.内蒙古农业大学生命科学学院,内蒙古呼和浩特 010018;2.中国农业大学食品科学与营养工程学院,北京 100083)
microRNA 是真核生物中存在的短序列非编码RNA家族[1],其许多家族成员是调控绒山羊绒毛生长的WNT、TGF-β、FGF 等分子信号通路中的重要因子[2-3]。它们通过5'端的6~8 个种子序列碱基与其靶向基因3'-UTR 碱基结合成互补序列,引起靶向mRNA 降解或抑制翻译调节基因表达[4],从而调控绒山羊毛囊发育及绒毛生长[5-8]。Hu 等[9]、张桂山等[10]研究表明,miR-1298 的作用是通过靶向抑制Cx43基因表达,调控血管平滑肌细胞功能。miR-1298-5p 为miR-1298 的一个亚型,是应用高通量测序获得的绒毛生长周期中差异的miRNA,其在不同品种羊毛囊发育中与TGF-βR1基因存在潜在的靶向关系[11],但有关miR-1298-5p 的作用研究较少。TGF-β是转化生长因子超家族[12-14],TGF-βR1是TGF-β的一个重要跨膜受体糖蛋白,相对分子质量为53 000 u,在成熟皮肤毛囊中表达,并且在毛发发育周期和部位具有表达的特异性[15],主要作用是参与信号转导[16-17]。当细胞外的信号分子与跨膜蛋白TGF-βR2结合后,TGF-βR1磷酸化形成四聚体,将信号传至细胞,通过调节细胞生理性活动,调控动物毛发的生长[18]。目前,TGF-βR1基因对绒山羊绒毛生长的作用尚不清楚。本实验通过qPCR 方法对miRNA-1298-5p 和TGF-βR1基因在内蒙古绒山羊绒毛不同生长时期的表达规律进行研究并探讨二者对绒毛生长的作用,为在选育过程中改善绒毛品质提供理论依据。
1 材料与方法
1.1 实验材料 选取内蒙古伊克昭盟绒山羊场放牧条件下体重相同的1.5 岁阿尔巴斯白绒山羊3 只,在绒毛生长的休止期(2 月)、生长初期(4 月)、生长旺盛期(8 月)和退行期(12 月)采集躯干部体侧中线距肩胛骨10~15 cm 处约3 cm 直径的皮肤,经PBS 液快速冲洗后保存于液氮罐中用于实验。
1.2 试剂 TRIZOL、氯仿、异丙醇、无水乙醇、RNasefree 纯水、DEPC、6×DNA Loading Buffer、Gold View核酸染色剂、Agarose、50×TAE、DNA Marker、Revert Aid First Strand cDNA Synthesis Kit(反转录试剂盒)、FastSuper Eva Green qPCR 均购自赛默飞世尔科技(中国)有限公司。
1.3 仪器 迷你水平电泳槽(北京白晶生物技术有限公司)、罗氏LC96 定量PCR 仪(北京科誉兴业科技发展有限公司)、冷冻高速离心机(Thermo Fisher)、ELITE 电泳仪、ND2000 紫外分光光度计(Gene Company Limited 基因有限公司)、微型离心机(SCILOGEX)、PCR 仪(Wealtec Corp)。
1.4 方法
1.4.1 引物设计 选取S-18S为内参基因,根据GenBank数据库中miR-1298-5p、TGF-βR1的mRNA 序列,利用Primer 5 设计相应的引物序列,引物由爱博生物股份有限公司合成(表1)。
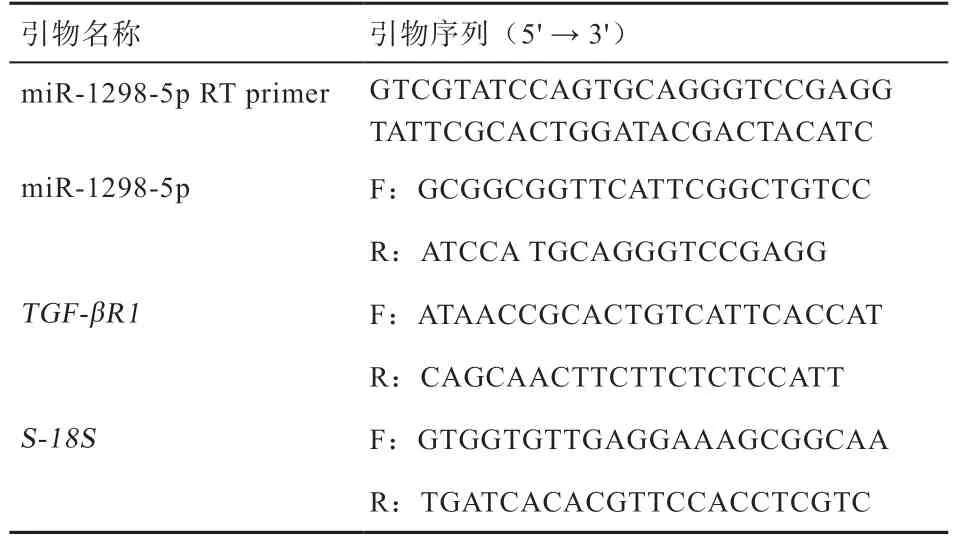
表1 引物序列
1.4.2 RNA 提取及cDNA 合成 将不同时期的阿尔巴斯白绒山羊绒毛生长的皮肤样本用液氮研磨后,使用试剂盒提取各月份总RNA,后用DL2000 紫外分光光度计和琼脂糖凝胶检测其纯度和浓度。对检测后的RNA 在20 μL 体系(包括:5×Reation Buffer 4 μL、RNA 5 μL、RibolockRnase Inhibitor 1 μL、10 mmol/L dNTP Mix 2 μL、RevertAid M-MulV RT 1 μL、Nuclease-Free Water 7 μL;反应程序:42℃ 60 min,70℃ 5 min)的PCR 仪上合成cDNA,并于-80℃保存。
1.4.3 qRT-PCR 检测 利用SYBR Green 技术进行qRTPCR 检测。反应体系:2×Fast Super EvaGreen Master Mix 10 μL、上下游引物(10 μmol/L)各0.8 μL、cDNA模板2 μL、ddH2O 6.4 μL;反应程序:95℃ 2 min,1 循环;95℃ 5 s,60℃ 30 s,45 循环。每个样本均重复3 次,内参基因选择S-18S基因。
1.4.4 数据分析 用△△Ct 法对miRNA-1298-5p 及其靶基因TGF-βR1进行相对定量并运用SPSS 20.0 软件对阿尔巴斯白绒山羊皮肤各月份的相对表达量进行统计分析。
2 结果
2.1 RNA 提取 经紫外分光光度计和琼脂糖凝胶电泳检测,提取的阿尔巴斯白绒山羊绒毛不同生长时期的皮肤RNA 质量较好,28 S 条带亮度较18 S 条带亮度亮(图1),A260/A280在1.8~2.0(表2),可用于后续实验。
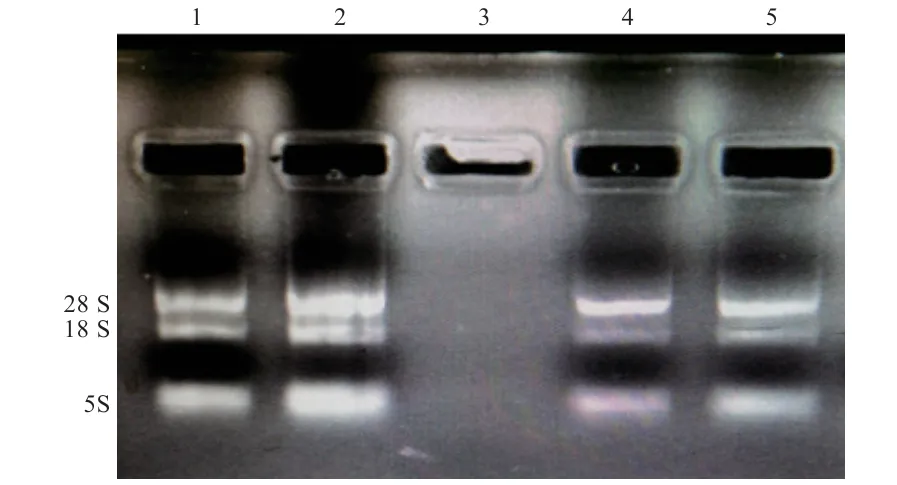
图1 阿尔巴斯白绒山羊绒毛不同生长期皮肤RNA 电泳检测

表2 阿尔巴斯白绒山羊绒毛不同生长期皮肤RNA 吸光值
2.2 miRNA-1298-5p 的相对表达量 以内参基因S-18S为对照,利用qPCR 对miRNA-1298-5p 在阿尔巴斯白绒山羊绒毛生长的各个月份的皮肤表达进行扩增,得到了较好的熔解曲线(图2),熔解曲线图显示扩增产物单一。对扩增结果应用△△Ct 法通过统计分析进行相对定量(图3)。相对定量结果表明,miR-1298-5p 在内蒙古阿尔巴斯白绒山羊绒毛不同发育时期皮肤中的表达不同,其中退行期(12 月)相对表达量最高,为休止期(2 月)的1.31 倍;生长初期(4 月)和生长旺盛期(8 月)相对表达量较少,分别为休止期的0.240 倍和0.507 倍;各月份间相对表达量存在极显著差异。
2.3TGF-βR1基因的相对表达量TGF-βR1基因在阿尔巴斯白绒山羊绒毛不同发育时期的皮肤表达qRTPCR 扩增结果显示(图4),扩增效果较好、产物单一。对扩增结果应用△△Ct 法通过统计分析表明(图5),TGF-βR1基因在阿尔巴斯白绒山羊皮肤绒毛不同发育时期的mRNA 除了2 月与4 月表达量无显著差异外,其他月份间表达量存在极显著差异。其中8 月表达量最高(生长旺盛期),为休止期的2.639 倍;12 月(退行期)表达量最低,为休止期的0.493 倍。推测TGF-βR1基因在绒毛生长过程中起重要作用。
图2 miR-1298-5p 和S-18S 基因在阿尔巴斯白绒山羊绒毛生长不同时期皮肤qPCR 熔解曲线
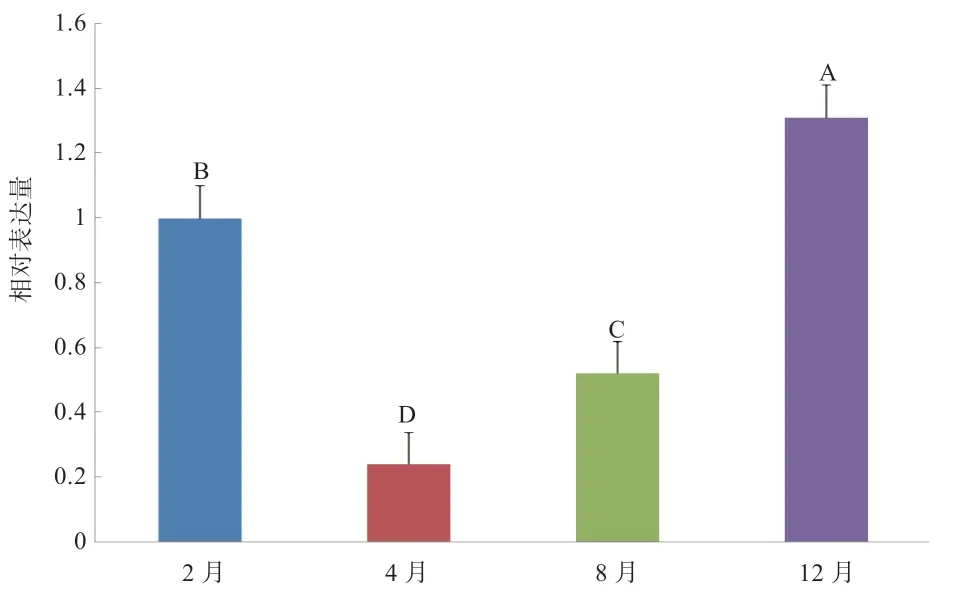
图3 miR-1298-5p 在阿尔巴斯白绒山羊绒毛生长不同时期皮肤相对表达量
3 讨 论
3.1 miRNA-1298-5p 表达研究 miRNA 是新近发现的在绒山羊毛囊发育及绒毛生长过程中起重要调控作用的一类小分子,如Liu 等[5]采用高通量技术鉴定出绒山羊毛囊保守miRNA 为316 个、新miRNA 22 个;Yuan 等[19]鉴定出保守miRNA 为399 个,在毛囊发育3 个不同时期共表达的为36 个,在3 个不同时期特异性表达的为3个。曲海娥[20]研究发现,miRNA-125b 通过负调控靶基因FGFR2和MXD4来调控绒山羊皮肤毛囊发育。鉴于miRNA 的作用,本研究结果显示,miRNA-1298-5p 在绒毛生长的退行期表达最高,在生长期表达最低;表达量与绒毛生长趋势相反,即表达量由退行期经过休止期向生长期逐渐降低;而在生长期中,绒毛生长初期(4 月)miRNA-1298-5p 的表达量显著低于生长旺盛期(8 月)。原因在于生长初期是绒毛生长下一轮周期的开始,旧的毛囊逐渐消亡和脱落,新生的毛囊数量较少,调节绒毛生长的各因子在皮肤中的相对表达量较少;随着时间的推移,到生长旺盛期,毛囊发育活跃,新生毛囊数量增多,调节绒毛生长的各因子相对表达量增大并高于生长初期。综观miRNA-1298-5p 在绒毛生长4 个时期皮肤相对表达量的变化,推测miRNA-1298-5p 是绒毛生长的重要影响因子,可能抑制绒毛的生长发育,但这一作用需后续实验验证。
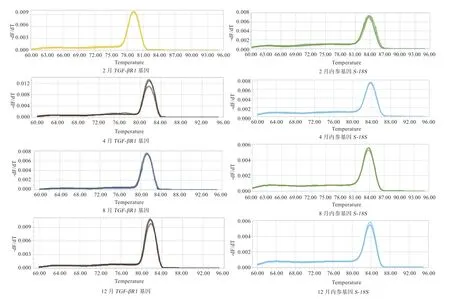
图4 TGF-βR1 基因和S-18S 基因在阿尔巴斯白绒山羊皮肤绒毛生长不同时期qPCR 熔解曲线
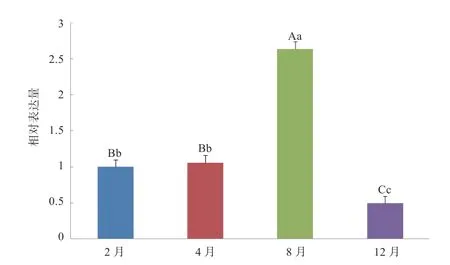
图5 TGF-βR1 基因在阿尔巴斯白绒山羊绒毛生长不同时期皮肤相对表达量
3.2TGF-βR1基因表达研究TGF-β是具调节细胞增殖、分化、凋亡等多种功能的因子,其所在的TGF-β信号通路参与绒山羊毛囊的发育,成为近年来研究的热点。TGF-β有3 种受体,即TGF-βR1、TGF-βR2和TGF-βR3[21]。本研究发现,TGF-βR1基因在内蒙古阿尔巴斯白绒山羊绒毛生长的旺盛期毛囊发育活跃,TGF-βR1基因表达量高;退行期由于外界环境气候逐渐变冷,毛囊发育及绒毛生长趋于减慢甚至停滞,TGF-βR1基因表达量降低;休止期虽然旧的毛发脱落,部分毛囊萎缩,但新的毛囊正在孕育,TGF-βR1基因表达量相比退行期要高,推测TGF-βR1基因促进毛囊的发育。Foitzik 等[22]在实验中发现,敲除TGF-βR1基因的小鼠毛囊由生长期向退行期转变缓慢,当注射TGF-βR1基因时,毛囊的退行期提前,说明TGF-βR1基因在小鼠毛囊由生长期向退行期转变过程的重要作用。TGFβR1在内蒙古绒山羊绒毛生长周期中是否具有同样作用有待进一步研究。
3.3 miRNA-1298-5p 与TGF-βR1基因的关系 绒毛的产量与质量是绒山羊重要的经济性状,由于受到毛囊发育过程中不同分子的调控,基因表达在绒毛生长不同时期存在很大的差异[23]。其中,miRNA 通过与靶向基因3'端非编码区序列的特异性互补结合而调控靶基因表达。张桂山等[11]对辽宁绒山羊和细毛羊不同时期的毛囊组织中miR-1298-5p 和TGF-βR1基因关系进行研究,通过软件预测发现miR-1298-5p 种子序列中有7 个碱基与TGF-βR1基因3' 端序列碱基互补,表明二者具有靶向关系,TGF-βR1基因可能是miR-1298-5p 的靶基因。本研究通过qRT-PCR 检测miR-1298-5p 和TGF-βR1基因在内蒙古绒山羊绒毛生长周期皮肤中的表达,发现二者表达量呈相反趋势,推测miRNA-1298-5p 可能通过负向调控TGF-βR1基因调控内蒙古绒山羊绒毛的生长发育。以上结果表明,虽然不同品种羊的毛囊形态和发育时期不同,但分子调控机制相似。
4 结 论
miR-1298-5p 及其靶基因TGF-βR1均在内蒙古绒山羊绒毛不同发育时期皮肤呈差异性表达,且miR-1298-5p 可能通过负调控TGF-βR1基因在不同发育时期的皮肤表达对绒山羊绒毛生长起调节作用,促进绒毛的周期生长。
