FBXL3 和FBXL21 基因表达与苏尼特羊季节性发情关系初探
2020-12-21钟英杰向光明贺小云刘树军张效生张金龙储明星刘秋月
钟英杰 ,向光明,贺小云,刘树军,张效生,张金龙,储明星*,刘秋月*
(1.中国农业科学院北京畜牧兽医研究所,农业农村部动物遗传育种与繁殖重点实验室,北京 100193;2.乌拉特中旗农区畜牧业专项推进办公室,内蒙古巴彦淖尔 015300;3.天津市畜牧兽医研究所,天津 300381)
苏尼特羊是内蒙古优良的地方肉羊品种之一,以肉质嫩、口感好而著名[1]。但苏尼特羊是一种典型的季节性发情绵羊,其肉产量远远达不到人们的需求,因此很有必要阐明季节性发情的分子机制,寻找绵羊季节性发情的关键基因,从而利用分子育种改善其繁殖性能。影响绵羊季节性繁殖的因素有很多,包括纬度、温度、营养水平和湿度等[2-3],而光照条件是影响绵羊季节性繁殖的主要因素,一般情况是绵羊在短光照条件下发情,长光照条件下不发情。研究发现位于下丘脑的核心生物钟控制着生物的各种生理节律,如冬眠、新陈代谢和繁殖等[4-6]。有研究进一步表明,哺乳动物繁殖是由一系列依靠激素影响的行为及生理活动组成,而这些过程又受生物钟的调控[7]。生物钟直接或间接接收到外界的光信号后,钟基因表达水平会发生变化[8],通过调控松果体节律性合成和分泌褪黑激素(Melatonin,MEL),褪黑激素又通过神经内分泌作用影响下游的器官,最终导致动物生殖机能改变[9-10]。目前还不清楚在上游通路中光照如何引起钟基因表达水平发生变化,以及在发情周期转换的这个过程中钟基因的变化。
FBXL3基因编码蛋白是F-box 和LRR 蛋白家族的成员,也是SCF 泛素连接酶复合体四大主要成分之一[11]。最早于2007 年被3 个独自的团队发现,Siepka 等[12]发现了小鼠中的FBXL3基因的超时突变(Overtime Mutation,Ovtm)导致节律周期延长,Luca 等[13]发现FBXL3基因的滞后突变(After Hours,Afh)也会导致自发活性周期增长,Maggi 等[14]发现在哺乳动物中FBXL3 蛋白可以诱导CRY 蛋白的降解,从而激发CLOCK 和BMAL1 蛋白的转录活性。FBXL21是FBXL3 最近的相似物,其主要分布在细胞质中(FBXL3主要在细胞核中表达),它同样可以结合CRY 蛋白,阻止FBXL3 的泛素化从而使CRY 蛋白稳定表达[15]。Yoo 等[16]在小鼠中研究发现FBXL21有双重功能,它可以在细胞核中阻止CRY 蛋白被FBXL3 蛋白降解,在细胞质中促进CRY 蛋白的降解,FBXL21和FBXL3基因在细胞内不同的区域分布及平衡决定了CRY基因的表达,从而控制着哺乳动物昼夜节律周期的变化。Dardente 等[17]在绵羊中发现FBXL21和FBXL3基因的表达昼夜节律周期性,而且进一步研究表明两者作用与在小鼠中一样,FBXL3基因在各个组织内广泛表达,FBXL21组织特异性地在下丘脑SCN 中表达。目前很多研究发现FBXL3和FBXL21基因与人的各种疾病有关,如Wang 等[18]研究发现miRNA-4735-3p 可以通过调控FBXL3基因从而抑制非小细胞肺癌的迁移和增殖,Chen 等[19]研究发现FBXL21与爱尔兰人的精神分裂症有关,但目前还不清楚FBXL3和FBXL21基因与绵羊季节性发情是否相关。因此,本研究通过人工控光羊舍模拟了不同发情状态下苏尼特羊在短光照(发情期)和长光照(休情期)FBXL3和FBXL21基因的表达情况,同时探究不同光照时间点对生物钟基因FBXL21和FBXL3表达的影响,分析光照对生物钟的影响,从上游通路找到影响季节性发情的关键分子,为进一步理解季节性发情机制和分子育种提供理论基础。
1 材料与方法
1.1 实验样品 选择来自同一羊场、在相同饲养条件和环境中饲养、体重接近、年龄为3 周岁的18 只健康苏尼特母羊,根据本课题组前期预实验结果,构建成年苏尼特母羊双侧卵巢切除(OVX)模型,OVX 母羊饲养于人控光羊舍内。短光照(SP)为8 h 光照,16 h 黑暗;长光照(LP)为16 h 光照,8 h 黑暗。自然饲养条件下先转换为短光照,短光照后的第1 天记为短光照第1 天(标记为SP1),接着短光照转换为长光照,转换后的第1 天记为长光照第0 天(标记为LP0),长光照的第2 天,即完成第1 次完整长光照记为长光照第1 天(标记为LP1)。采样时间点分别为SP21、LP3、LP15、LP21、LP42 和LP49,每个时间点取3 只羊。每次均在同一天同一时刻采集下丘脑组织和血液。在最短时间内用专门处理过的RNA 实验取材用的手术器械采集动物下丘脑组织,一部分样品立即投入液氮保存,另一部分样品投入液氮速冻后转入-80℃低温冰箱中保存。
1.2 组织总RNA 的提取和检测及cDNA 第1 链合成采用动物组织总RNA 提取试剂盒(天根生化科技有限公司,北京)加Trizol(Invitrogen,美国)提取各组织总RNA[20],并用Nanodrop2000 检测提取RNA 浓度和OD 值,用1.0% 的琼脂糖凝胶电泳检测RNA 的完整性。反转录试剂盒合成获得cDNA 第1 链,反转录体系和反应条件见表1,具体步骤参照本实验室前期RNA提取和cDNA 合成的方法[20]。
1.3 引物合成FBXL3和FBXL21基因mRNA 的序列在GenBank 中的登录号分别为NM_001129739.1 和NM_001129738.1,利用Primer3 在线软件进行跨外显子引物设计,以β-actin(NM_001009784)作为内参基因。引物由北京天一辉远生物科技有限公司合成。引物名称和序列、退火温度、扩增片段大小以及用途见表1。
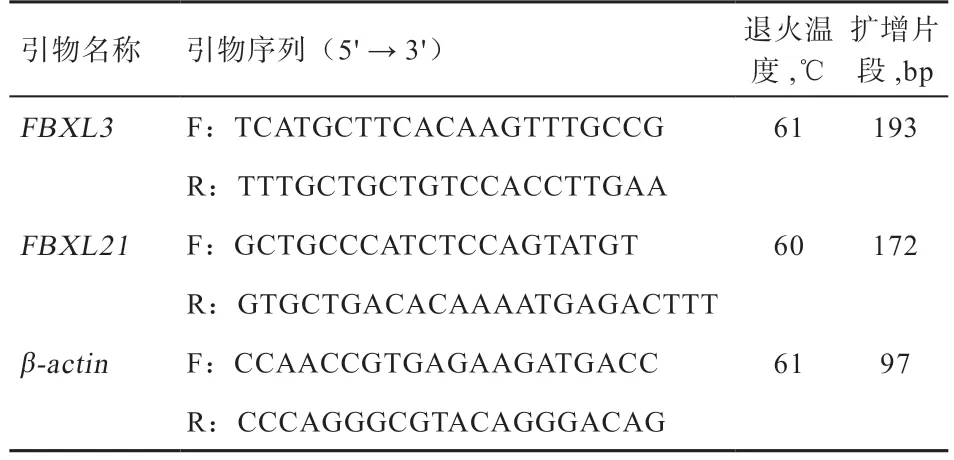
表1 绵羊FBXL3 和FBXL21 基因的引物信息
1.4 实时荧光定量PCR 反应
1.4.1 实时荧光定量PCR 体系和程序 实时荧光定量PCR 反应体系总体积为20 μL:SYBR Premix Ex Taq Ⅱ10 μL,上、下游引物各0.8 μL,cDNA 模板2 μL,RNase-Free ddH2O 6.4 μL。PCR 程序:95℃预变性5 s,95℃变性5 s,60℃ 30 s,40 个循环;反应结束后对熔解曲线进行分析。
1.4.2 标准曲线的建立 将cDNA 样本5 倍稀释后,再进行2 倍梯度稀释获得5 个浓度梯度的cDNA 样品,以5 倍稀释的cDNA 样本浓度为1,则这5 个cDNA 样品的浓度梯度分别为1、1/2、1/4、1/8 和1/16。用这些cDNA 作为模板对目的基因和持家基因进行荧光定量PCR,以浓度梯度的对数值(10 为底数)为横坐标,以检测所得Ct 值为纵坐标,绘制目的基因和内参基因标准曲线。得到单一且锐利的熔解曲线,符合qPCR 的要求。
1.4.3 实时荧光定量PCR 检测 实时荧光定量PCR 检测利用Roche Light Cycler®480 Ⅱ型荧光定量PCR 仪进行,以β-actin为内参基因,每个样品重复检测3 次。
1.5 统计分析 荧光定量结果用2-ΔΔCt法计算目的基因相对表达量[21],用SPSS22.0 统计软件中的一般线性模型中的单因素方差分析的最小显著差异(Least Significant Difference,LSD)法对不同光照时间点之间目的基因相对表达量进行分析。
2 结果与分析
2.1 由短光照转长光照过程中FBXL3基因在苏尼特羊下丘脑中不同光照时间点的表达分析 如图1 所示,由短光照SP21 转长光照LP3 时,FBXL3基因表达量显著升高,说明FBXL3基因在季节性发情转换调控中可能起着重要作用。而从不同时间点来看,其表达量从SP21 到LP3、LP15、LP21 依次显著增高,LP21 时到达峰值。LP21 到LP49 时又显著降低,这与哺乳动物由短光照(发情期)转长光照(休情期)过程中催乳素的分泌形式一样[22],以及垂体中发情关键调控因子EYA3和TSHb基因表达趋势一样[23]。
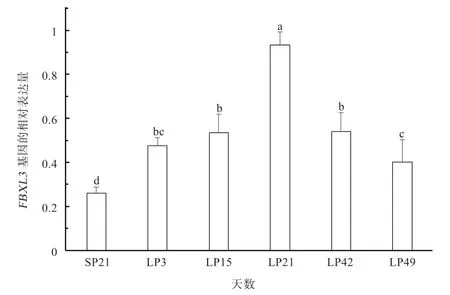
图1 FBXL3 基因在苏尼特羊下丘脑中不同光照时间点的表达
2.2 由短光照转长光照过程中FBXL21基因在苏尼特羊下丘脑中不同光照时间点的表达分析 由图2 可知,由短光照SP21 转到长光照LP3 时,FBXL21基因的表达量降低(P<0.05),直到LP15 时到达最低值,在LP21 时FBXL21基因到达最高,在LP42 时显著降低,LP49 升高。
3 讨 论

图2 FBXL21 基因在苏尼特羊下丘脑中不同光照时间点的表达
哺乳动物的核心生物钟位于下丘脑视交叉上核(SCN),也是季节性发情的调控中心[24],动物机体直接或间接接收到外界的光信号经SCN 传至松果体,分泌褪黑激素(Melatonin,MEL)作用于下丘脑-垂体-性腺轴(Hypothalamic-Pituitary-Gonadal Axis,HPGA),从而对季节性繁殖进行调控[25]。Wood等[22]研究发现在长光照条件下,垂体结节部(Pars Tuberalis,PT)表达的褪黑激素受体感知到MEL 的变化后,PT 区一系列光照信号分子发生改变,如促甲状腺细胞中EYA3表达量上升,与其他因子一起活化TSHβ的表达,引起HPGA 生殖激素的变化。因此光照对生物钟的影响是最上游的调控通路,对整个发情过程起着关键作用。Dardente 等[17,26]在绵羊中研究发现FBXL3和FBXL21也是钟基因,但它可以通过泛素化调节核心分子CRY 的稳定来影响整个生物钟,从而对下游的各种生理节律产生影响。本试验探究苏尼特羊由发情期转非发情期过程中FBXL3和FBXL21基因表达的变化,从激素水平层次上来看,由短光照转长光照过程中催乳素浓度升高,抑制整个性腺轴的活性,导致哺乳动物进入休情期,具体的调控通路与EYA3和TSHb分子有关,而后由于长光照的回溯性,使其降低而后又升高[22]。FBXL3基因表达呈现这样的规律也证实了FBXL3基因也很有可能在长光照季节发情调控这一通路上。qPCR 结果表明,FBXL3基因最相近的同源物是FBXL21,由短光照转长光照FBXL21的表达量显著降低,说明它也可能在发情调控中起着作用。研究发现,FBXL3基因能使CRY 降解,FBXL21能使CRY更加稳定,且发现FBXL3基因功能缺失使周期延长,FBXL21基因缺失使周期延长[15],推测FBXL21表达趋势应该与FBXL3相反,那么FBXL21在LP21 时间点应该存在一个相对最低值,而本研究却出现最高值,与预期的结果矛盾。有研究发现FBXL21基因有双重功能,在细胞质能使CRY 降解,而在细胞核中能拮抗FBXL3对CRY 的降解[16],可能会导致出现与假想不一致的结果,而且本实验中qPCR 结果表明FBXL21整体表达水平较低,这可能是由于FBXL21基因属于钟基因,表达水平受昼夜节律影响,而采样时间恰好在FBXL21基因一天中的低表达时间点导致[26]。综上,节律钟基因的功能缺失会使生物钟正常功能受到影响,最终影响哺乳动物的发情排卵[27-29];本研究发现FBXL3基因的表达模式与长光照条件下发情调控因子(基因)表达一致(如EYA3和TSHb等),同样与催乳素分泌趋势也一致,推测FBXL3基因很有可能是长光照季节发情调控的关键因子,且在上游影响下丘脑核心生物钟来实现对整个发情通路进行调控,而FBXL3基因同源物FBXL21也可能在这个过程中起着重要调控作用。
4 结 论
本研究发现季节性发情的苏尼特羊由短光照(发情期)转长光照(休情期)FBXL3基因表达量升高,FBXL21基因表达量降低,FBXL3和FBXL21基因可能在季节性发情上游通路通过下丘脑核心生物钟对季节性发情进行调控。
