甲烷-正庚烷双燃料二阶段着火的动力学特性
2020-12-21张尊华梁俊杰李格升
李 锋, 张尊华, 梁俊杰, 万 琦, 李格升
(武汉理工大学 能源与动力工程学院, 武汉 430063)
天然气是一种清洁高效的发动机替代燃料,几乎不含硫、粉尘等有害物质,储量丰富,受到了国际社会的广泛关注[1]. 因为天然气的辛烷值较高,不易被压燃,所以为实现其在压燃式发动机上的应用,可采用柴油作为着火源引燃天然气的双燃料运行方式[2-3]. 碳氢燃料根据其着火特性的不同,可以被分为只具备单阶段着火的燃料,以及具备二阶段着火特性的燃料,其中后者的二阶段着火现象通常在初始温度低于850 K时出现[4]. 柴油有着明显的二阶段着火现象[5],燃料二阶段着火发生的温度区域内存在燃料着火的NTC(负温度系数)现象,该现象与发动机的敲缸、爆震等燃烧现象有很大的关系. 因此,为了深入理解实际双燃料在中低温条件下的着火过程、优化缸内燃烧,有必要对此开展研究. 天然气和柴油都是复杂的混合物,柴油更是包含上千种组分. 构建双燃料的详细化学动力学机理难度非常大,一般对天然气和柴油着火特性的研究主要通过构建相关燃料替代物进行分析. 甲烷是天然气的主要成分,经常被用作天然气的单组分替代燃料[2,6-7]. 柴油的十六烷值(CN)较高,一般为40~56[8],正庚烷的十六烷值(CN=56)与柴油较为接近,因此以正庚烷作为柴油替代物开展的研究也十分广泛[9-12]. 因此本文选择甲烷和正庚烷分别作为天然气和柴油的替代燃料,开展甲烷-正庚烷双燃料二阶段着火特性的动力学研究.
关于燃料的二阶段着火特性已有学者开展了一些研究. 早在1998年,Curran等[13]就已经通过激波管、喷射射流搅拌反应器及快速压缩机等试验设备对正庚烷着火特性进行了综合研究. 研究表明正庚烷作为经典的高碳烷烃,其具有显著的二阶段着火特性,这也与冷焰及NTC现象有关. Herzler等[14]于2005年对温度为720~1100 K、压力为50 bar条件下正庚烷着火延迟时间的NTC现象进行了试验研究,发现正庚烷的二阶段着火现象只出现在900 K以下,且第一阶段着火延迟时间会随温度和当量比发生明显变化. 2016年Zhang等[4]采用快速压缩机开展异辛烷、甲基环己烷及正庚烷低温条件下的着火试验,并着重对正庚烷第一阶段着火的NTC现象进行分析,研究表明第一阶段着火特性与第二阶段着火延迟时间的NTC现象之间存在一定关系. 目前关于二阶段着火过程的研究主要是正庚烷等单燃料燃烧,而对甲烷-正庚烷双燃料的二阶段着火特性研究则鲜见报道.
关于甲烷和正庚烷的化学动力学机理,国内外已经开展了一些研究. 甲烷的氧化反应机理主要有USC Mech II机理、Aramco Mech 2.0 机理[15]和 GRI-Mech 3.0 机理,正庚烷的氧化机理主要包括Mehl等[16]的LLNL 3.1机理和Zhang等[17]的NUI 2016机理. 甲烷是正庚烷等碳氢燃料燃烧过程中涉及的组分之一,一个详细的正庚烷化学动力学机理也包含甲烷燃烧的化学动力学机理,可以使用正庚烷的化学动力学机理对甲烷-正庚烷双燃料的燃烧过程进行模拟分析. 对于正庚烷的化学动力学机理,还需要燃料着火过程中特征参数的进一步验证.
综上所述,本文主要针对甲烷-正庚烷双燃料二阶段着火特性的动力学开展研究.
1 研究方法
利用化学动力学软件CHEMKIN PRO中定容绝热模型对甲烷-正庚烷双燃料进行着火延迟时间模拟. 定义OH摩尔浓度最大值对应的时刻为着火时刻.
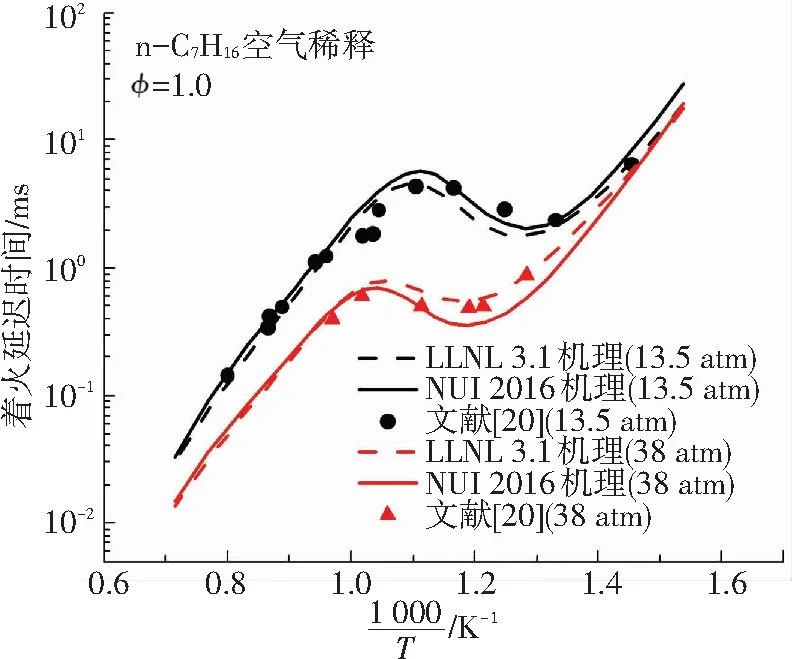
作为一种典型的高碳烷烃,正庚烷是柴油最主要的替代物模型燃料,其化学动力学机理也得到了十分充分的发展. 其中使用较广泛的正庚烷机理是LLNL 3.1机理,该机理对正庚烷在不同条件下的基础燃烧特性均有较为理想的预测效果. 2016年,爱尔兰国立高威大学发布了一个包含1268种组分、5336个基元反应的正庚烷详细机理(本文中简称为NUI 2016机理),该机理的C0-C4子机理取自经典的Aramco Mech 2.0机理,使得该机理能够对燃烧中的低碳反应表现出较为理想的预测效果. 本文将这两种机理的数值模拟结果分别与同等条件下Heufer等[18]及Ciezki等[19]的正庚烷着火延迟时间试验数据进行比较,以验证机理的准确性,对比结果如图1.
(a)

(b)
Fig.1 Comparison between the experimental and modeled values of ignition delay times for n-hanptane
从图1可以得出,LLNL 3.1机理与NUI 2016机理的模拟结果与文献中的着火延迟时间试验数据保持良好的一致性. 两种机理在不同条件下对NTC区域的着火延迟时间预测效果也都较为理想,说明所选择的两种机理在中低温条件下都具有较好的适用性. 二阶段着火现象出现在低温着火过程中,因此两种机理均可以用来进行模拟研究. NUI 2016机理是在LLNL 3.1机理的基础上更新的详细机理. 综合比较,本文选择更详细的NUI 2016机理对甲烷-正庚烷双燃料在中低温条件下二阶段着火特性的化学动力学开展研究.
2 研究结果与讨论
2.1 甲烷-正庚烷双燃料着火延迟时间
图2是通过模拟获得的50%甲烷-50%正庚烷双燃料在初始条件T=700 K、P=10 atm、φ=1.0时,OH摩尔浓度和温度的变化曲线. 分析图2中OH摩尔浓度曲线可以得出,在双燃料着火过程中OH摩尔浓度分别在23.57 ms时出现一个较小的峰值,在161 ms时出现一个较大的峰值. 伴随OH摩尔浓度峰值的出现,温度变化曲线也呈现出两个阶段的上升过程,且在OH峰值对应的时刻,温度上升斜率达到最大值. 因此,甲烷-正庚烷双燃料的着火过程可以被划分为两个阶段(又称二阶段着火过程),第二阶段着火为总的着火过程.
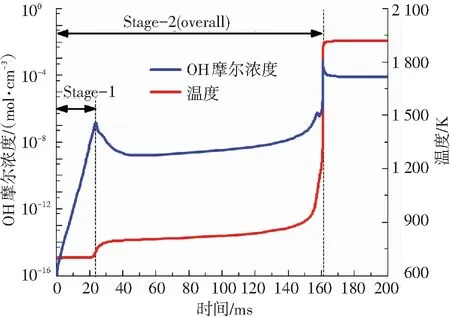
图2 OH摩尔浓度与温度变化(50%甲烷-50%正庚烷,T=700 K,P=10 atm,φ=1.0, 95%氩气稀释)
Fig.2 Variations of mole fraction of OH and temperature (50%methane-50%n-heptane,T=700 K,P=10 atm,φ=1.0, 95% argon dilution)
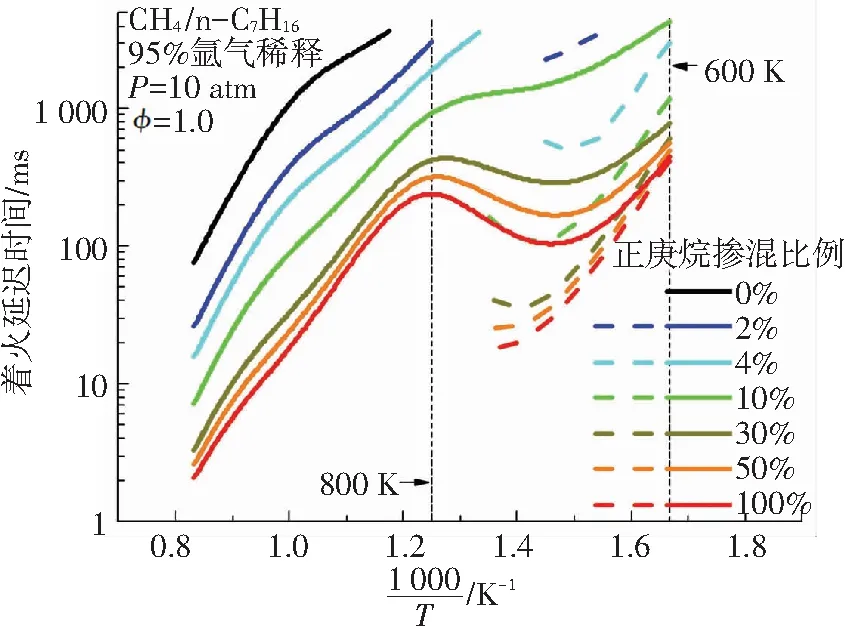
基于NUI 2016化学动力学机理,模拟得到了甲烷-正庚烷双燃料在不同正庚烷掺混比例下的二阶段着火延迟时间. 正庚烷掺混比例分别为0%、2%、4%、10%、30%、50%、100%,初始条件为T=600~1200 K、P=10 atm、φ=1.0. 图3为中低温条件下双燃料着火延迟时间随正庚烷掺混比例变化关系图. 图3(a)是不同掺混比例下双燃料的着火延迟时间,由图3(a)可知,在中低温条件下,甲烷-正庚烷双燃料在初始温度低于750 K的条件下表现出二阶段着火现象. 二阶段着火过程均表现出一定的NTC现象. 当正庚烷掺混比例降低时,总的着火延迟时间的NTC现象也趋于平缓. 由图3(b)可知,甲烷-正庚烷双燃料二阶段着火延迟时间都随正庚烷掺混比例发生着非线性变化,且变化趋势一致,都是随正庚烷掺混比例的增加而减小. 正庚烷掺混比例较低时,正庚烷含量对双燃料的着火延迟时间影响更显著,在正庚烷掺混比例高于75%时,正庚烷含量对双燃料二阶段着火延迟时间的影响逐渐变小.
2.2 化学动力学分析
本文为深入了解甲烷-正庚烷的着火过程,进行了甲烷-正庚烷双燃料的相关化学动力学分析,主要对着火过程中双燃料的消耗情况、重要基元反应的反应速率及自由基浓度等变化规律进行了分析.
(a)

(b)
图3 不同正庚烷掺混比例下的着火延迟时间 (虚线代表第一阶段着火延迟时间,实线代表第二阶段着火延迟时间)
Fig.3 Variations of ignition delay time at different n-heptane contents (The dash lines denote the first stage ignition delay time; the solid lines denote the second stage ignition delay time)
2.2.1 双燃料的浓度变化
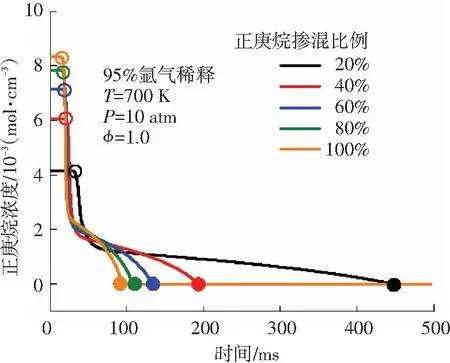
由图4可知,在不同的正庚烷掺混比例下,甲烷-正庚烷双燃料系统中甲烷和正庚烷的含量都会在初始水平维持一段时间后再开始发生变化,而对比这些条件下的第一阶段着火延迟时间可以发现,甲烷和正庚烷含量在初始水平维持的这段时间正好等于第一阶段着火延迟时间. 在第一阶段着火发生时刻之前,整个系统中的燃料浓度变化不是很明显,此时双燃料处于准备阶段,直到第一阶段着火发生时刻附近系统中才开始出现一些较为剧烈的化学反应.
由图4(a)可知,在双燃料第一阶段着火过程中甲烷浓度的变化与正庚烷掺混比例有关. 当正庚烷掺混比例较低时,甲烷浓度会在第一阶段着火过程中小幅度降低,其降低速度极其缓慢,说明在双燃料第一阶段着火过程中甲烷的消耗非常少,直到第二阶段着火发生时甲烷浓度才迅速下降,被完全消耗. 随着正庚烷掺混比例的增加,甲烷被完全消耗的时刻逐渐提前,这说明正庚烷在一定程度上促进了甲烷的消耗. 由图4(b)可知,在双燃料第一阶段着火发生时刻正庚烷浓度迅速下降,说明有大量正庚烷在第一阶段着火过程中参与反应被消耗. 在第一阶段着火结束后,正庚烷的消耗速度开始下降,随后正庚烷浓度一直在持续、平缓地下降,最终在第二阶段着火过程中被完全消耗.

(a)
(b)
图4 着火过程中双燃料浓度变化(空心圆代表第一阶段着火时刻,实心圆代表第二阶段着火时刻)
Fig.4 Variations of mole fractions of dual fuel during the ignition time(The hollow circles denote the first stage ignition time ; the solid circles denote the second stage ignition time)
2.2.2 重要消耗反应的反应速率
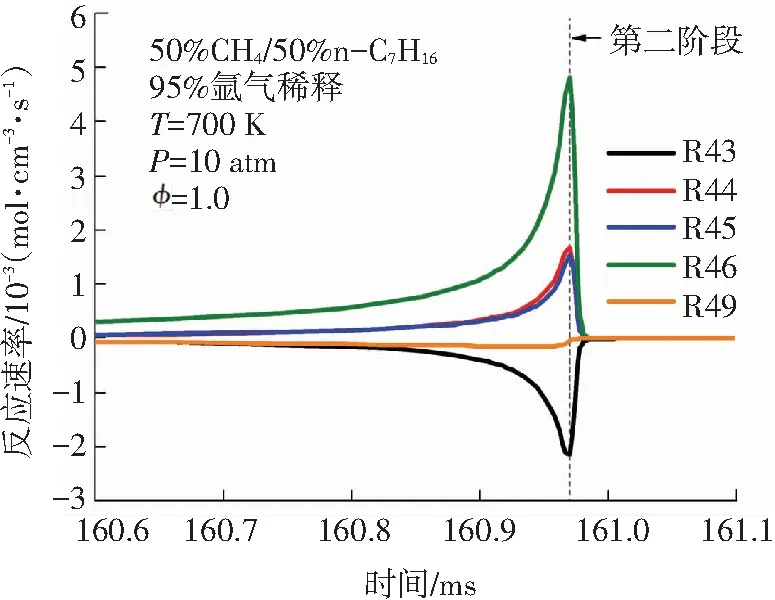
针对图4中双燃料的消耗趋势,本文进一步对双燃料的主要消耗反应在二阶段着火过程中的反应速率变化进行分析. 甲烷和正庚烷在二阶段着火过程中的主要消耗基元反应见表1. 由图5(a)可知,甲烷参与的主要反应不仅有R44、R45、R46等消耗反应,还有R43、R49等生成反应. 这说明甲烷在低温条件下,消耗与生成反应共同存在,其中甲烷的主要消耗反应速率大于其生成反应速率. 甲烷的消耗反应主要是甲烷与OH、H 、O等自由基进行的脱氢反应. 甲烷在第一阶段着火过程中的R46: CH4+ OH <=> CH3+ H2O反应速率峰值最大,这与甲烷在氧化起始反应中R46所需的活化能最低有关. 由图5(b)可知,相较于第一阶段,甲烷在第二阶段着火过程中的消耗反应的反应速率非常高,该现象与图4(a)中甲烷含量在第二阶段着火过程中大量下降完全一致. 由图5(c)、5(d)可知,正庚烷在OH作用下发生的脱氢反应是其消耗的主要方式,这些反应的反应速率在第一阶段着火时就开始突然增大,在第一阶段着火发生时刻之后迅速减小,在第二阶段着火过程中又有小幅上升,比较二阶段着火过程中的正庚烷主要消耗反应的反应速率可发现其第一阶段反应速率是第二阶段反应速率的近50倍. 综合来看,甲烷的消耗主要发生在双燃料的第二阶段着火过程,而正庚烷的消耗主要发生在双燃料的第一阶段着火过程. 图5中甲烷和正庚烷的主要消耗反应的反应速率变化进一步解释了图4中甲烷和正庚烷含量变化趋势的原因.

表1 主要基元反应
2.2.3 重要自由基的浓度变化
在双燃料二阶段着火过程中,重要自由基的浓度变化对燃料消耗的化学反应非常重要. 如图6所示,是双燃料二阶段着火过程中参与甲烷和正庚烷消耗反应的主要自由基浓度变化曲线. 在双燃料的第一阶段着火之前,有一定量的H2O2和HO2生成,其中H2O2浓度在第一阶段着火之后持续增加,在第二阶段着火时刻前大量的H2O2通过分解生成OH,因此H2O2浓度迅速下降. HO2的浓度在第一阶段着火发生时有所下降,然后维持在相对稳定的水平,在第二阶段着火时刻前大量生成后完全消耗. 在第一阶段着火过程中OH、H、O的浓度相比H2O2及HO2较低,但其在第一阶段着火发生时均出现了浓度峰值. 在第二阶段着火发生时,OH、H和O的浓度均达到最大峰值. 随着双燃料第二阶段着火的发生,OH浓度维持在一个稳定的值,其余自由基都被完全消耗.

(a)

(c)
(b)

(d)
图5 重要消耗反应的反应速率
Fig.5 Rates of consumption of methane and n-heptane during the main elementary reactions
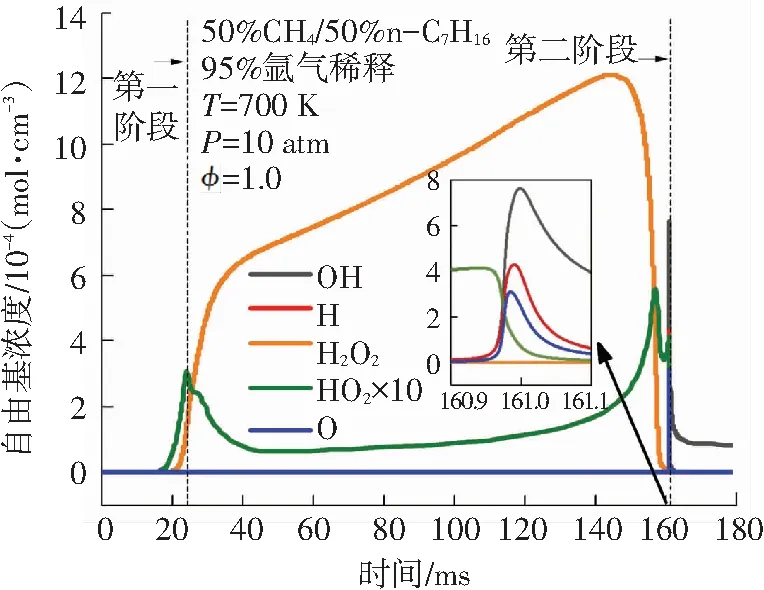
图6 重要自由基浓度变化
2.2.4 反应路径分析
为探究甲烷-正庚烷双燃料在二阶段着火过程中的具体消耗路径及主要消耗方式,分别进行温度700 K、压力10 atm、当量比1.0、掺混比例50%条件下的第一阶段和第二阶段着火过程中的反应路径分析,如图7、图8所示. 由于正庚烷脱氢、加氧异构化等进一步反应后会产生多种同分异构体,所以图7、图8中正庚烷中间组分的同分异构体由同一分子式表示,该分子式相关反应通道旁百分比表示这些同分异构体通过这一通道反应的反应量占这些同分异构体总反应量的百分比. 图中“R”代表正庚烷基(包含C7H15-1、C7H15-2、C7H15-3、C7H15-4),“Q”代表正庚烷基中失去了一个氢原子(如C7H141-3、C7H142-4等),“Q′”和“Q′′”则分别代表物质Q再失去一个和两个氢原子.
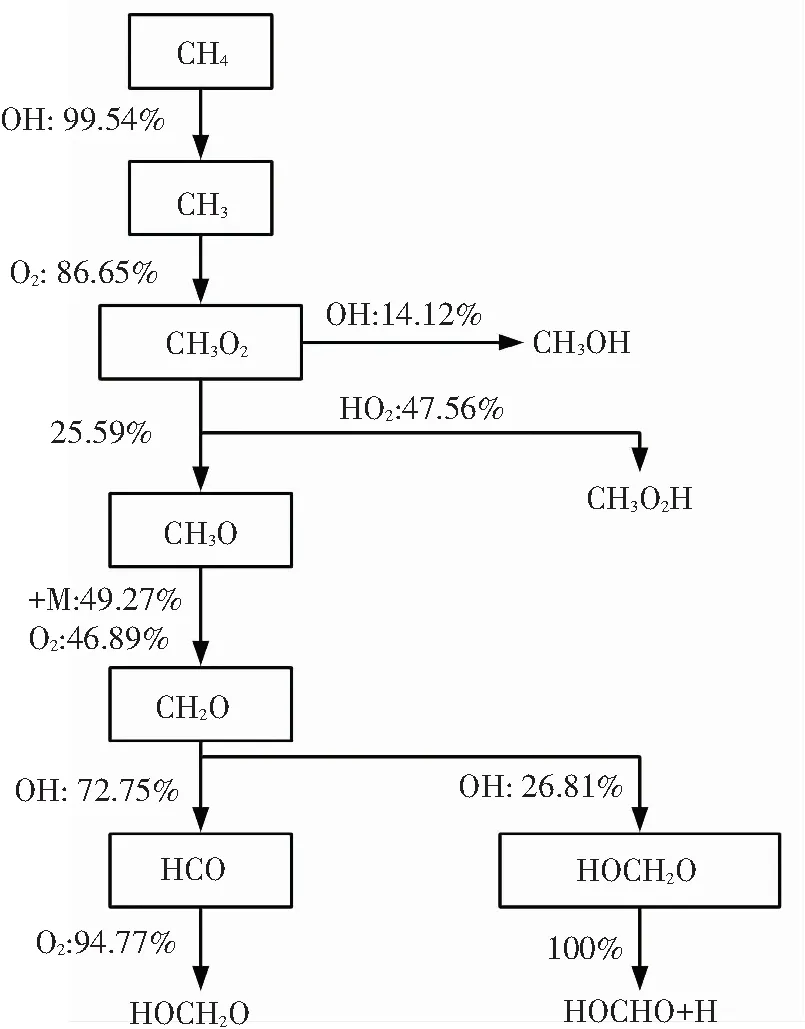
根据图4(a)中甲烷浓度含量变化曲线可知,甲烷在第一阶段的消耗量非常微小,即在双燃料第一阶段着火过程中,只有微量甲烷按图7(a)反应路径参与反应. 由图7(a)可知,在第一阶段着火过程中参与反应的CH4几乎全部与OH反应脱氢生成CH3. 这些生成的CH3有85%以上会发生加氧反应生成CH3O2,其中大部分CH3O2会进一步与OH或HO2反应变为CH3OH或是CH3O2H,而所生成的这两种组分不会在第一阶段着火过程中发生进一步反应. 剩下的CH3O2则会反应生成CH3O,然后通过第三体M或是O2转化为CH2O,最后大部分变为HCO,再被氧化为CO和HO2.
由图7(b)可知,在第一阶段着火过程中参与反应的绝大部分正庚烷同样会与OH反应脱氢生成正庚烷基R,然后发生加氧反应变为过氧化物RO2,其中24.13%的RO2会继续分解为烯烃和HO2,其它RO2则会发生异构化,即RO2中的一个C-H键断裂,这个氢原子会与末端的O形成O-H键,使得RO2变为QOOH. 这些QOOH一部分分解为QO和OH,生成的QO不再参与第一阶段着火中的反应. 其他大部分QOOH继续发生加氧反应生成O2QOOH,大部分O2QOOH分解为酮类过氧化物和OH,剩余的发生异构化变为HOOQ′OOH,然后分解为OQ′OOH、OH或是Q′OOH、HO2,生成的OQ′OOH和Q′OOH也不再继续参与第一阶段着火反应.
(a)

(b)
图7 双燃料第一阶段着火过程反应路径分析(50%甲烷-50%正庚烷,T=700 K,P=10 atm,φ=1.0, 95%氩气稀释)
Fig.7 Reaction path analyses for first stage ignition of dual fuel (50%methane-50%n-heptane,T=700 K,P=10 atm,φ=1.0, 95% argon dilution)
通过分析中低温条件下双燃料在第一阶段着火过程的反应路径可以发现,甲烷和正庚烷的脱氢加氧反应是其第一阶段着火过程中重要的反应路径之一,在第一阶段着火过程中会生成许多中间产物(醛类、酮类等)和重要的自由基(OH、HO2等). 第一阶段生成的中间产物和自由基为第二阶段着火过程提供了良好的初始条件.
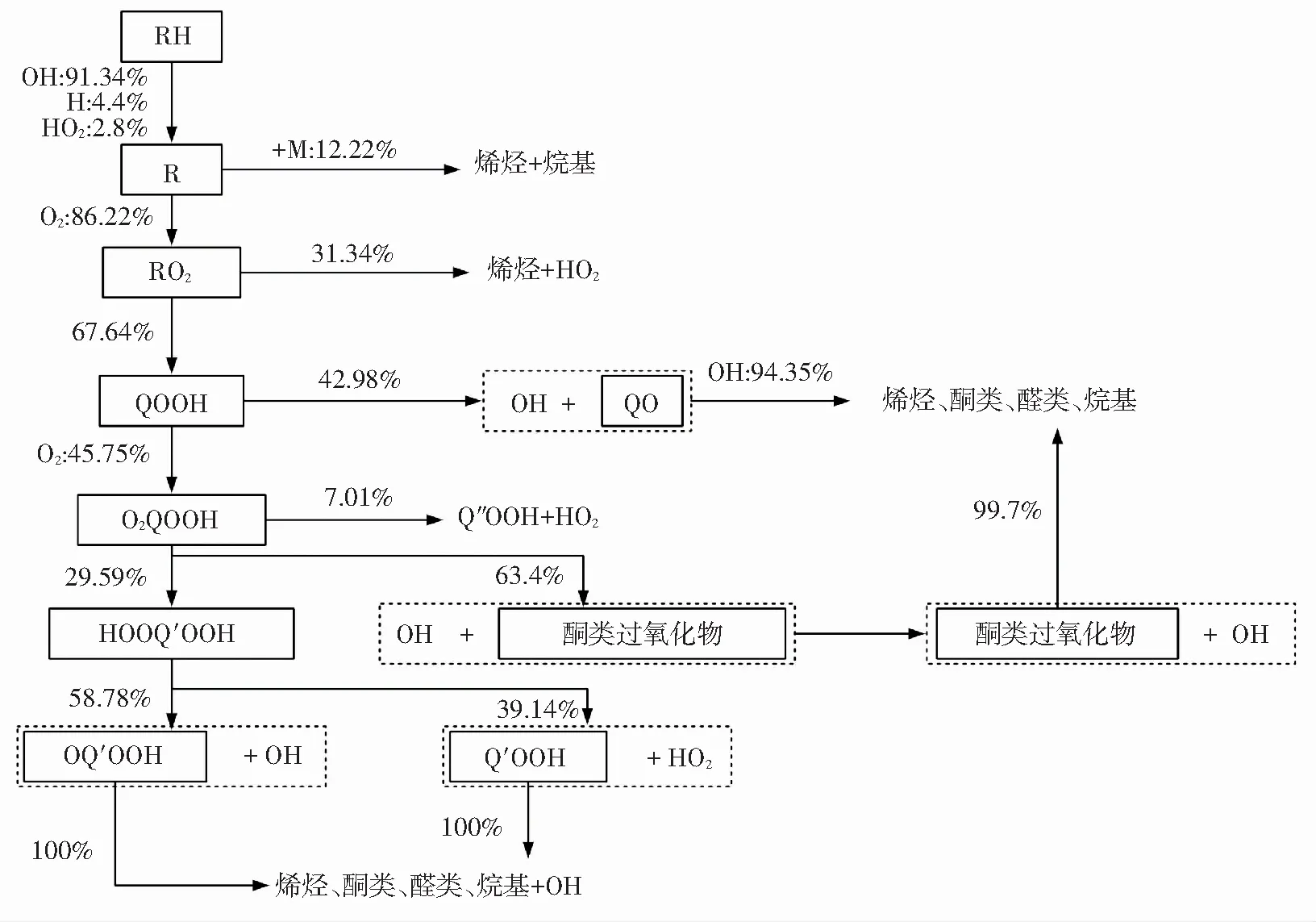
如图8所示,是双燃料第二阶段着火过程的反应路径. 图8(a)与图7(a)相比较,可发现甲烷在第二阶段着火过程中表现出比第一阶段更为复杂的反应机理. 由图8(a)可知,O、H等自由基参与了甲烷的脱氢反应,生成的CH3有一部分会继续发生氧化反应,最后生成H、HO2等自由基和CO2等最终产物. 另有相当一部分CH3会在H和HO2的作用下再次生成CH4. 其他CH3则会在第三体的作用下与自身发生反应生成含碳量更多的C2H6,在双燃料第二阶段着火过程中C2H6被完全氧化. 由图8(b)可知,正庚烷在第二阶段着火过程中反应路径的主干部分与其第一阶段反应路径相似. 两个阶段着火过程的差异仅在于其第一阶段着火过程中生成并停止反应的中间产物(如QO、酮类过氧化物等)会在第二阶段着火过程中继续反应,最后生成烯烃、酮类、醛类和烷基等相对较小的碳氢组分,最后被完全氧化.
通过图7、图8对双燃料二阶段着火过程的反应路径对比分析. 甲烷在第一阶段着火过程中反应量较少且过程较为简单,随着系统温度上升,甲烷在第二阶段着火过程中的反应变得更为复杂,结合图4(a)可以进一步证实甲烷的主要化学反应发生在双燃料的第二阶段着火过程中. 正庚烷在第一阶段着火过程中主要发生氧化反应,生成有较大分子结构的组分,其在第二阶段进一步氧化分解形成较小的烯烃、烷基等简单分子结构,然后完全氧化. 同时,对比第一阶段与第二阶段双燃料各组分反应路径变化,可以发现双燃料在第一阶段着火过程中双燃料系统中的组分及自由基种类较少,随着第二阶段着火的发生,自由基种类快速增加,OH、H、O和CH3等自由基对燃料的氧化起到了极大的促进作用,使系统活性快速增加.

(a)
(b)
Fig.8 Reaction path analyses for second stage ignition of dual fuel (50%methane-50%n-heptane,T=700 K,P=10 atm,φ=1.0, 95% argon dilution)
3 结 论
1)甲烷-正庚烷双燃料在初始温度低于750 K时表现出二阶段着火现象. 二阶段着火延迟时间随着正庚烷的掺混比例增加而减小,当掺混比例小于75%时影响最显著. 二阶段着火过程均表现出一定的NTC现象,随着正庚烷掺混比例降低,总的着火延迟时间的NTC现象趋于平缓.
2)甲烷-正庚烷双燃料在二阶段着火过程中燃料的消耗表现为:甲烷的消耗主要在第二阶段着火过程中完成;正庚烷主要在第一阶段进行分解反应,发生不完全氧化,并在第二阶段着火过程中反应完全.
3) 通过反应路径分析可知,在第一阶段着火过程中参与反应的自由基种类较少,且反应路径较为单一,主要生成大量的自由基和中间产物;第二阶段着火过程中,H、O、HO2等自由基参与反应,提高了系统活性,促进了双燃料的着火过程.
