甲醇-正庚烷混合燃料两阶段着火的动力学特性
2021-12-16蒲一帆庄远
蒲一帆,庄远
合肥工业大学 汽车与交通工程学院,安徽 合肥 230009
0 引言
随着化石燃料的不断消耗和内燃机排放标准的日益严格,使用替代燃料已成为解决能源危机和环境问题的新方案。甲醇为含氧化合物,燃烧更充分,不含C—C键,预混燃烧模式下碳烟排放很小,排放的有害物质明显降低,很适合作为柴油的替代燃料[1]。甲醇可以从生物质、煤和天然气的转化中得到[2],我国煤炭资源丰富,甲醇生产工艺成熟,是一种很有应用前景的替代燃料。
甲醇含氧,具有密度小、黏度低、辛烷值高、抗爆性好、汽化潜热大等理化性质,有利于燃料充分燃烧和减少排放[3]。甲醇存在与柴油不相溶、着火温度高、蒸发困难等问题,姚春德等[4]提出了一种柴油-甲醇组合燃烧模式,在进气道喷射甲醇,用柴油引燃甲醇与空气混合气的方法将甲醇应用在压燃发动机中,减少柴油机的碳烟和NOx排放。文献[5-7]表明,在柴油-甲醇组合燃烧模式下,甲醇替代了部分柴油,甲醇燃烧速率快,着火后燃烧剧烈,缸内压力急剧增加,压力峰值明显高于纯柴油燃烧模式,随着甲醇掺混增多,缸内温度降低,滞燃期延长,燃料混合更均匀,富燃区域减少,降低了碳烟的生成并加快燃烧获得更高的效率。文献[8]表明,甲醇高汽化潜热特性使混合气温度下降,导致柴油的着火延迟。文献[9]表明,甲醇的存在抑制了烃类燃料的低温放热反应,延缓了高温放热反应,导致着火延迟。大量的研究和试验结果表明,柴油掺混甲醇可改善柴油机的动力性和排放性能,但柴油掺混甲醇后影响柴油机的缸内温度、压力、着火时间和化学反应,需要对柴油-甲醇混合燃料的着火及燃烧特性有更深刻的认识。
着火延时反映燃料分解和氧化速度,是研究碳氢燃料着火性能的重要参数[10]。燃料根据不同的着火特性可分为单级着火燃料和多级着火燃料。柴油具有明显的两级着火特性[11]。高十六烷值和高含碳量的烷烃也具有“两阶段”特性[12],这类燃料的两阶段着火初始温度通常低于900 K。文献[13]在对直链烷烃(如正庚烷)着火特性的研究中发现,温度对着火延时影响权重远大于当量比和压力,着火延时随温度升高而缩短;在中温区,链烷烃加氧后生成过氧烷基,发生β裂解并分解成共轭烯烃和HO2自由基,β裂解反应是链传播反应,与燃料的低温反应链争夺中间物质,造成负温度系数(negative temperature coefficient, NTC)现象[14],NTC现象与发动机的敲缸、爆震燃烧等有关,与两阶段着火过程也存在一定关系。文献[15]在柴油替代燃料二甲醚的定容弹试验和相关模拟研究中发现,燃料的着火阶段可以通过温度及中间产物的变化加以区分,甲醛在高温着火前浓度不断积累,而在高温反应时H浓度急剧增加。文献[16]在对正庚烷等均质压燃着火(homogeneous charge compression ignition,HCCI)试验研究中发现,燃料在第一阶段燃烧过程中积累的过氧化氢(H2O2)分解产生的OH自由基促使燃料和中间产物氧化,放热增加,引发第二阶段着火。吕兴才等[17]使用正庚烷机理结合甲醇模型,研究了甲醇添加量对正庚烷在HCCI发动机中着火的影响,通过简单的化学分析,认为甲醇的抑制作用与反应过程中过氧化氢酮和OH自由基浓度下降有关。
甲醇与柴油之间复杂的化学作用影响混合气的着火和燃烧特性。为了进一步研究柴油-甲醇的多级着火过程,揭示着火过程中不同燃料的化学反应相互作用机理,本文中以正庚烷为参比燃料,研究正庚烷-甲醇混合燃料的两阶段着火动力学特性。
1 研究方法
利用CHEMKIN软件中定容绝热模型对正庚烷-甲醇混合燃料的着火燃烧过程进行模拟。柴油和汽油的成分复杂,研究中多用具有相似燃烧特性的主要参考燃料(primary reference fuel, PRF)来模拟柴油和汽油的燃烧化学反应。PRF通常为正庚烷和异辛烷的混合物,劳伦斯利弗莫尔国家实验室(Lawrence Livermore National Laboratory, LLNL)开发的PRF反应机理含有1389种物质和5935个反应[18],可以为不同条件下PRF的燃烧特性提供可靠的预测效果。H2、CO和醇类的化学反应动力学是构建大型烃类和醇类氧化反应机理的基础,Metcalfe等[19]建立了详细的化学动力学机理Aramco Mech 1.3,包括263种物质和1542个反应。Aramco Mech 1.3用来描述C1、C2小烃类和含氧化合物的燃烧化学反应,其中包括甲烷、甲醇、乙烷和乙醇等。本文中研究的重点为甲醇掺混对正庚烷着火特性的影响,需要一个同时包含正庚烷和甲醇的化学动力学机理。文献[20]在正庚烷和甲醇的化学动力学机理的基础上,开发了简化PRF-醇-二叔丁基过氧化物(di-tert-butyl peroxide, DTBP)燃烧动力学反应机理(本文中称为简化机理),包括108种物质和435个反应,保留了详细机理中正庚烷、异辛烷、甲醇和乙醇等大部分主要反应路径,既确保简化机理的准确性和扩展性,也保证了简化机理的计算效率。通过对着火延迟、物质摩尔分数分布和层流火焰速度等进行广泛的验证试验,简化机理计算结果与试验结果基本吻合,简化机理可为柴油和汽油发动机的燃烧模拟提供可靠的预测效果。本文中采用包含正庚烷和甲醇的化学动力学机理的简化机理,重点研究在正庚烷中掺混甲醇对着火特性的影响。
为了衡量甲醇-正庚烷混合燃料燃烧模式下甲醇替代情况,定义甲醇完全燃烧的热值占总热值的百分比为甲醇替代率Rm,计算式为:
(1)
式中:ma和md分别为甲醇和正庚烷的初始质量,kg;QLHV,a和QLHV,d分别为正庚烷和甲醇的低热值,MJ/kg。
当量比
(2)
式中:Za和Zd分别为甲醇和正庚烷的空燃比;mair为空气的质量,kg;下标符号st代表化学计量条件。
固定初始条件(初始压力p=2 MPa,φ=1,Rm=0、20%、40%、60%、80%)下,初始温度T=650~1300 K,纯正庚烷(Rm=0)作为参比工况,以便与混合工况作对比。不同Rm时甲醇-正庚烷混合燃料各组分摩尔分数如表1所示。

表1 甲醇-正庚烷混合燃料各组分摩尔分数
2 研究结果及分析
2.1 甲醇-正庚烷混合燃料着火延迟时间
初始条件下,T=800 K时,通过简化机理模拟获得的正庚烷燃料OH自由基浓度和燃烧温度的变化如图1所示。

图1 正庚烷燃料OH自由基浓度与温度的变化
由图1可知,燃烧过程中OH自由基浓度经过0.21 ms出现一个较小的峰值,经过1.66 ms出现一个较大的峰值。随着OH自由基浓度峰值的出现,温度变化曲线呈现出两阶段的上升过程,且温度的变化率在OH自由基浓度峰值时刻达到最大。正庚烷的着火过程可以分为2个阶段,定义OH自由基浓度最大值对应的时刻为着火时刻,第一阶段着火延迟时间记为t1;第二阶段着火延迟时间t2定义为第一阶段着火与高温点火之间的时间间隔,总着火延迟时间t=t1+t2;ΔT1为低温反应放热所造成的温升,ΔT2为第二阶段燃烧反应所造成的温升,总温升ΔT=ΔT1+ΔT2。
T=650~1300 K,不同Rm的正庚烷-甲醇混合燃料着火延迟时间变化如图2所示。
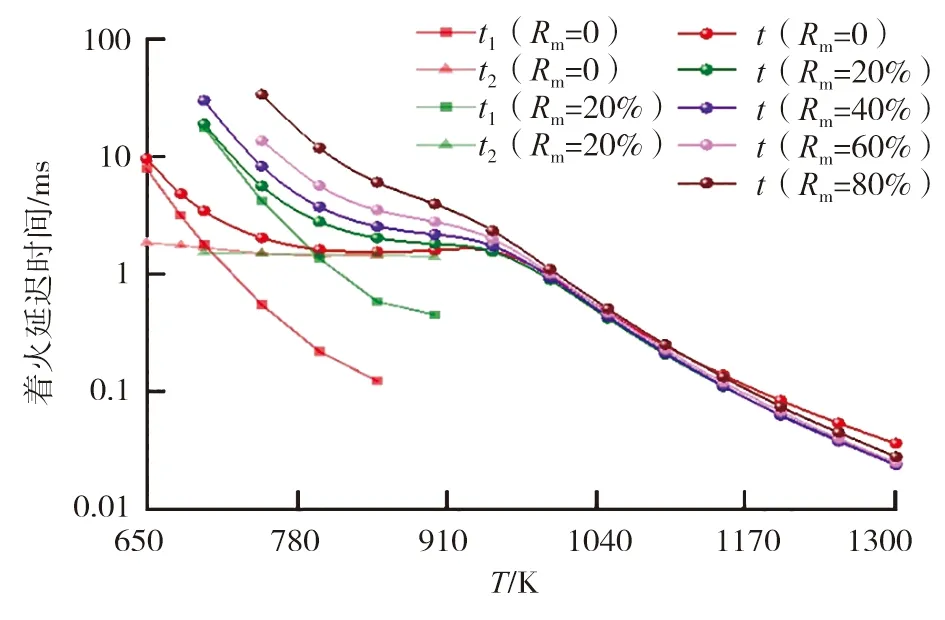
图2 不同Rm时着火延迟时间的变化
由图2可知,T=800~900 K,纯正庚烷(Rm=0)的着火延迟时间基本保持不变,呈明显的零温度系数[21](zero temperature coefficient, ZTC)现象,此时正庚烷没有表现出明显的NTC现象,这是由于所研究工况的压力较高(2 MPa),随着压力升高,正庚烷氧化过程中NTC现象逐渐弱化,并有转变为ZTC现象的趋势;当T<900 K、Rm=20%,第一阶段着火延迟时间增加,第二阶段着火延迟时间基本不变,混合气的ZTC特征消失,说明掺混甲醇明显抑制了正庚烷的低温反应;随着Rm增加,低温反应强度进一步被抑制,以至于不能再检测到明显的低温着火现象,但总着火延迟时间不断增加;当T>900 K,燃料的一阶段着火现象消失,不同Rm的着火延迟时间曲线逐渐靠近,随着温度升高,添加甲醇渐渐趋向于促进着火,表明甲醇在高温环境下对正庚烷着火的影响与低温环境相反。
不同Rm下正庚烷-甲醇混合燃料两阶段着火时温升随T的变化如图3所示。由图3a)可知,掺混甲醇(Rm=20%)后的正庚烷-甲醇混合燃料ΔT1比纯正庚烷(Rm=0)时降低15~20 K,降幅随T的升高逐渐减小,说明温度的提高一定程度上削弱了甲醇的抑制作用;由图3b)可知,掺混甲醇后正庚烷-甲醇混合燃料ΔT2略高于纯正庚烷工况,说明加入甲醇对于燃料两阶段的温度变化有不同的影响,ΔT随着Rm增大而减少,可能是由于甲醇热值低,造成最高燃烧温度降低。

a)ΔT1 b)ΔT2和ΔT图3 不同Rm下2阶段着火温升随T的变化
2.2 化学动力学分析
为了深入研究正庚烷-甲醇的着火过程,本文中对着火过程中重要组分的浓度、生成和消耗反应路径变化情况及相关基元反应的反应速率进行分析,从反应动力学层面研究掺混甲醇对正庚烷着火特性的影响。
本文中研究涉及的组分消耗反应如表2所示。

表2 主要基元反应
2.2.1 甲醇对一阶段着火延迟的影响(初始低温)
初始条件下,Rm=0、20%时,正庚烷消耗反应的化学反应速率如图4所示。
由图4a)可知:Rm=0时,第一阶段着火过程中R4反应速率峰值最大;第一阶段着火结束后,R4的反应速率迅速减小,R5取代R4成为正庚烷的主要消耗反应,但R5的反应速率远小于第一阶段R4的反应速率。由图4b)可知:Rm=20%时,R4的反应速率比Rm=0时大幅降低,R5为正庚烷的主要消耗反应。Rm=0时,正庚烷的消耗主要发生在第一阶段的着火过程,在OH自由基的作用下发生脱氢反应是主要的消耗方式,Rm=20%时,正庚烷整体的消耗反应速率明显降低,约为Rm=0时反应速率的10%,HO2自由基是主要的脱氢来源,说明甲醇的加入影响了正庚烷和自由基的反应路径。

a)Rm=0 b)Rm=20%图4 正庚烷相关消耗反应的反应速率
初始条件下,T=800 K,Rm=0、20%时,OH自由基相关的基元反应速率如图5所示。反应速率为正,表示OH自由基的生成反应;反应速率为负,表示OH自由基的消耗反应。
由图5a)可知,Rm=0时,第一阶段着火时OH自由基的生成主要为R12和R13基元反应。这2个反应是正庚烷低温链支化的重要反应,在短时间内生成大量OH自由基,OH自由基的活性较强,整个反应系统的活性提高,导致低温着火;第一阶段着火过后,正庚烷被大量消耗,R12和R13的反应速率逐渐降低,R126的反应速率逐渐增加。R12、R13、R126反应中的nC7ket和C3ket21都属于过氧化氢酮类,按化学结构的复杂程度分为C3和C7,由过氧烷基的自由基异构化等反应产生,是正庚烷发生低温链分支反应的标志性中间反应物[18]。随着C7H16大分子被降解,燃料中C3、C4、C5等中间小分子产物迅速增多,系统中生成的酮类过氧化物C3ket21浓度上升,导致了R126的反应速率增加。
在着火的第一阶段,加入甲醇使OH自由基的反应略有改变。由图5b)可知,Rm=20%时,甲醇的加入抑制了正庚烷的低温反应,OH自由基的生成反应速率峰值远低于Rm=0时(约为1/20),第一阶段的着火时间从0.21 ms推迟到1.36 ms。加入甲醇后R126的反应速率曲线与R12和R13极为相似,为OH自由基的生成的主要基元反应。从第一阶段的着火过程来看,由于正庚烷的消耗速率降低,一阶段低温反应进程延长,R126相当于提前参与OH自由基的生成反应。
对于OH自由基的消耗反应,添加甲醇的最大区别是原本为正庚烷脱氢的OH自由基大部分转为甲醇脱氢。甲醇的脱氢反应消耗了大量的OH自由基,导致正庚烷捕获的OH自由基极少。另外较为明显变化的是R419反应,甲醛(CH2O)是烃类燃料降解末期的重要中间体,也是甲醇氧化过程的中间体,添加甲醇后系统中CH2O的浓度上升[22]。在低温燃烧时CH2O主要消耗OH自由基生成HCO,所以CH2O的浓度变化在一定程度上影响了系统中OH自由基的浓度。纯正庚烷着火第一阶段,CH2O对于OH自由基消耗的贡献不足15%;掺混甲醇后,CH2O对OH自由基的消耗反应在低温反应进程中明显提前,CH2O对于OH自由基消耗的贡献达到40%,仅次于甲醇对于OH自由基消耗的贡献。
由图4、5可知:系统中由正庚烷低温支链反应产生的OH自由基,在添加甲醇后绝大部分通过与甲醇和甲醛的反应被消耗,而用于正庚烷脱氢的OH自由基极少,正庚烷低温支链反应产生的OH自由基远远不能满足正庚烷自身的消耗需求,正庚烷转而通过反应活性相对不强的HO2自由基脱氢,这大大降低了正庚烷的消耗速度,反应活性较强的OH自由基浓度增长相对变缓,导致系统整体的反应活性降低,造成着火延迟。
2.2.2 初始低温下甲醇对第二阶段着火的影响
初始条件下,T=800 K,Rm=0、20%时,燃料各主要组分浓度和系统温度变化曲线如图6所示,为了便于观察和研究添加甲醇对第二阶段着火的影响,图中OH自由基和HO2自由基浓度参数分别扩大200倍和20倍(图中分别用OH*和HO2*表示)。
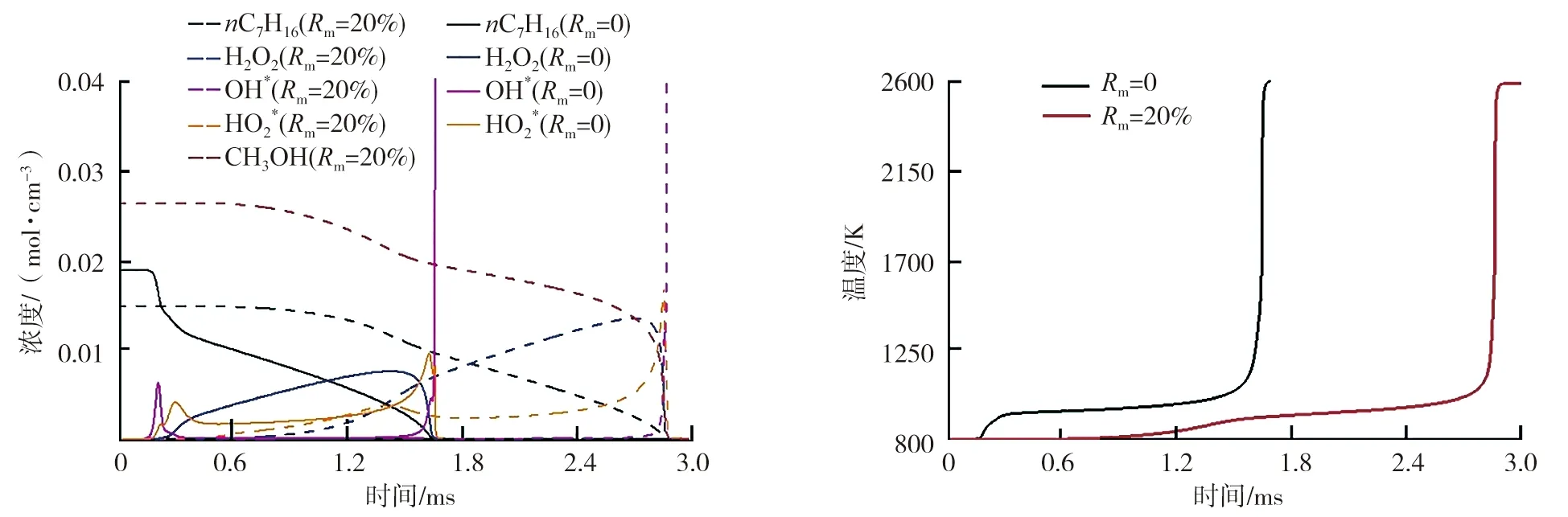
a)浓度 b)温度图6 正庚烷-甲醇氧化过程中主要组分浓度和系统温度变化曲线
由图6可知,正庚烷在第二阶段着火前几乎全部消耗,说明燃料对高温着火的影响较小。H2O2由于具有较高的能量壁垒,在低温下较为稳定,在第二阶段着火前H2O2浓度持续增长(Rm=20%时H2O2浓度峰值约为纯正庚烷时的2倍),说明甲醇对H2O2浓度的增长起积极的作用。从甲醇的氧化机理可知[19],甲醇分子中O—H键的键能大于C—H键,因此C—H键更易断裂形成羟甲基(CH2OH)。而CH2OH具有相当高的热稳定性,更容易与O2反应生成甲醛和HO2自由基。因此掺混甲醇有助于增加HO2自由基的浓度,一方面大量的HO2自由基将会促进R390反应生成H2O2,另一方面正庚烷通过主要消耗途径R5生成H2O2,这2个因素导致H2O2的浓度不断增加。当H2O2浓度和系统温度上升到一定程度时,积累的H2O2迅速热解,生成大量的OH自由基,使整体反应活性增加,温度急剧上升,高温着火。
掺混甲醇后HO2自由基的浓度增加,促进H2O2生成,H2O2通过R391生成大量的OH自由基,使第二阶段着火提前。这也解释了添加甲醇后正庚烷低温反应被抑制,而第二阶段着火延迟却没有增加的原因。
2.2.3 初始高温下甲醇对第二阶段着火的影响
T>950 K时,低温反应强度很弱,而高温下混合气着火较快,仅从着火延迟的宏观现象无法完全体现在不同Rm时,掺混甲醇对燃料高温着火燃烧的影响。初始条件下,T=1300 K,不同Rm时的混合气放热率如图7所示。由图7可知,与甲醇在初始低温下的抑制作用不同,初始高温下掺入少量甲醇,放热率峰值出现明显提前,但甲醇掺混过多时,放热率峰值又逐渐推迟。

图7 不同Rm的混合燃料的放热率
初始条件下,T=1300 K,Rm=0、20%时,HO2自由基相关反应的反应速率如图8所示。

图8 HO2自由基主要反应的反应速率
由图8可知,在Rm=20%时,HO2自由基生成和消耗反应更加活跃,出现新的HO2自由基的生成反应R314,同时R409反应速率明显加快。这2个基元反应都与甲醇密切相关,CH2OH是甲醇脱氢产物,HCO是甲醛脱氢产物。同时R390的反应速率增加,加速消耗HO2自由基生成H2O2。此外,R385的反应速率峰值更大,这说明Rm=20%时,甲醇有助于高温着火时的燃烧反应。通过分析HO2自由基的反应速率可以看出,高温下添加适量的甲醇可使自由基的反应速率加快,高温着火提前。
系统中某一组分的生成(或消耗)贡献率(rate of production, RoP)可由其相关的基元反应的反应速率计算得到。定义反应j对于组分k在某段计算区域的生成(或消耗)量
(3)
式中:x1为所选计算区域起始时间,s;x2为所选计算区域结束时间,s;ωk,j为反应j对于组分k的瞬时生成速率(或瞬时消耗速率),mol/(cm3·s)。
定义反应j对于组分k的生成(或消耗)的贡献率
(4)
式中:n为与组分k相关的生成(或消耗)反应的总数,jr为与组分k相关的第r个反应。
贡献率为正,表明反应为该组分的生成反应;贡献率为负,表明反应为该组分的消耗反应,其大小为生成(或消耗)的比例。通常把OH自由基浓度的快速增长当作着火标志,T=1300 K,不同Rm时OH自由基生成或消耗的贡献率如图9所示。

图9 不同Rm时OH自由基的生成或消耗贡献率
随着Rm增加,甲醇和CH2O与OH自由基的反应R32和R419逐渐成为OH自由基的主要消耗途径。根据前面的分析,甲醇和正庚烷的反应路径在形成甲醛处汇合,Rm越大,甲醛的浓度越大。添加甲醇促进了HO2自由基和H2O2的生成,但也增加了OH自由基的消耗。掺混甲醇越多,甲醇的氧化反应对活性自由基的需求增加,导致混合物的整体化学反应性降低,这也是高温下掺入过量甲醇,着火时刻反而推迟的原因。
3 结论
1)在初始低温下,加入甲醇后正庚烷低温支链反应产生的OH自由基绝大部分被甲醇和甲醛反应消耗掉,正庚烷转而通过反应活性相对不强的HO2自由基脱氢,大大降低了正庚烷的消耗速度,造成第一阶段点火延迟。当Rm>20%时,低温反应强度进一步被抑制,以至于无法检测到明显的低温着火现象。但甲醇混合后HO2自由基浓度增加促进了H2O2形成,并通过R391反应生成大量OH自由基,加速了第二阶段着火。
2)在初始高温度下,甲醇对正庚烷着火的抑制作用消失,掺入适量甲醇可以使系统内活性自由基的反应速率加快,混合物的高温反应性加强,高温着火提前;然而甲醇掺混越多,甲醇氧化反应路径对活性自由基的需求也大大增加,导致混合物整体的化学反应性降低,着火延迟时间增加。
