RDW、血清OPN在肝硬化病程及Child-pugh分级中的应用
2020-12-21李韫池史也孙中磊田蕾
李韫池 ,史也,孙中磊 ,田蕾
1.锦州医科大学研究生学院,辽宁 锦州 121000;2.辽阳市中心医院消化内科,辽宁 辽阳 111000;3.枣庄矿业集团中心医院消化内科,山东 枣庄 277400
肝硬化(liver cirrhosis,LC)是由各种慢性病因引起肝脏损害、肝细胞变性坏死导致的[1]。其主要机制是由于机体的自我修复作用,正常肝小叶结构被增生的纤维组织、再生的结节状肝脏细胞所取代而形成假小叶结构[2]。慢性肝病诱导肝星状细胞的活化,加速肝纤维化,这也是细胞外基质的胶原蛋白主要来源[3]。肝星状细胞的活化是由多种生长因子、细胞因子和趋化因子介导的,骨桥蛋白(OPN)就是其中之一[4]。在生理状态下OPN 表达于肾和骨,而在病理情况下,OPN的表达可以被归因于炎症、血管生成、肝纤维化和不同器官的癌变[5]。同时肝脏在造血过程中起着十分重要的作用,是合成、储存造血必不可少的蛋白质、铁、维生素和凝血因子的工厂,同时也是调节机体凝血与抗凝机制的重要器官[6]。肝硬化患者由于肝功能下降,肝脏合成造血原料不足,凝血-抗凝平衡被打破,凝血功能、红细胞及血小板参数发生改变。红细胞分布宽度(RDW)是反映红细胞(RBC)体积异质的一种参数,与红细胞形态改变关系密切,在临床应用广泛,在许多器官甚至系统疾病中都有着重要的评估意义。本研究拟通过分析肝硬化患者OPN、RDW 变化与肝硬化病程及Child-Pugh 肝功能分级的关系,寻找评估肝硬化患者病情严重程度、降低患者死亡率的方法,为临床研究提供依据。
1 资料与方法
1.1 一般资料 选择辽阳市中心医院2017年11月至2019 年7 月诊断为肝硬化的患者87 例。纳入标准:①性别不限,年龄在18 周岁及以上;②根据相关标准确诊为肝硬化者;③临床资料完整,住院当天皆行血常规、生化系列、凝血功能等检测;④因肝硬化初次于我院住院治疗的患者;⑤依从性良好,能配合试验及治疗患者。排除标准:①肝硬化合并肝癌患者;②合并其他器官严重疾病患者;③血液病患者;④依从性差,不能配合试验者。87 例肝硬化患者中,男性45 例,女性42 例;年龄31~75 岁,平均(58.83±6.59)岁。将同期于我院体检科健康体检的87 例健康人群作为对照组,其中男性41 例,女性46 例;年龄35~70 岁,平均(58.91±6.44)岁。两组受检者的年龄、性别比较差异无统计学意义(P<0.05),具有可比性。本研究经辽阳市中心医院伦理批准且皆得到入选患者知情同意。
1.2 分组方法 按肝硬化患者贫血程度分为无贫血组42例、轻中度贫血组23例、重度贫血组22例;按肝硬化患者发病原因分为为肝炎后肝硬化组31例、酒精性肝硬化组27例、其他病因肝硬化组29例;按肝硬化患者病程分为代偿期组21 例、失代偿期组66 例;按Child-Pugh分级分为A组38例,B组29例,C组20例。
1.3 观察指标与检测方法 患者入院时血常规检测中收集RDW、RBC、血红蛋白(Hb)、白细胞(WBC)、血小板(PLT)(采血细胞分析仪测定);生化系列检测中收集谷丙转氨酶(ALT)、谷草转氨酶(AST)、谷氨酰转肽酶(GGT)、血肌酐(Scr)、总胆红素(TBil)、白蛋白(Alb)(采用全自动生化分析仪测定);凝血功能检测中收集凝血时间(PT)、纤维蛋白原(FIB)(全自动凝血分析仪测定),以及OPN指标(采用酶联免疫吸附法测定,Abcam公司ab254514)。
1.4 统计学方法 应用SPSS24.0统计学软件进行统计学分析。其中计量资料应用均数±标准差()来表示,两样本间比较采用t检验,多组间比较则采用单因素方差分析,计数资料比较采用χ2检验,相关性分析采用Spearman相关性分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 肝硬化组与对照组受检者的主要检测指标比较 肝硬化组患者RDW、OPN、AST、ALT、GGT、TBil、PT、FIB等指标均明显高于对照组,而RBC、Hb、PLT 及Alb 等指标则明显低于对照组,差异均具有统计学意义(P<0.05);其余指标两组间比较差异均无统计学意义(P>0.05),见表1。
2.2 肝硬化患者的RDW、OPN 值与肝功能重要指标及凝血指标间的相关性 RDW 值与ALT、AST、TBil、PT和GGT呈正相关(P<0.05),与ALB、FIB呈负相关(P<0.05),但与 Scr 不相关(P<0.05);OPN 值与 ALT、AST、TBil、PT和GGT呈正相关(P<0.05),与ALB、FIB呈负相关(P<0.05),而与Scr不相关(P>0.05),见表2。
表1 肝硬化组与对照组受检者的主要检测指标比较()

表1 肝硬化组与对照组受检者的主要检测指标比较()
指标 肝硬化组(n=87)对照组(n=87)t值P值RDW(%)OPN(ng/mL)RBC(g/L)WBC(×1012/L)Hb(g/L)ALT(U/L)AST(U/L)Scr(μmol/L)Alb(g/L)PLT(×109/L)GGT(U/L)TBil(μmol/L)PT(s)FIB(g/L)15.66±2.02 125.64±31.25 3.47±0.93 10.19±2.35 117.75±18.26 72.85±15.68 75.37±16.33 83.61±19.23 32.47±7.67 104.35±23.95 183.13±19.65 73.97±14.65 16.45±2.67 2.74±0.25 13.71±1.96 26.71±4.85 4.78±1.13 9.65±1.72 136.47±12.26 11.72±2.69 9.87±2.17 79.81±21.64 42.65±11.05 131.57±26.97 36.17±4.25 12.85±3.35 10.83±1.74 2.21±0.36 6.46 29.18 8.21 1.73 7.94 35.84 37.09 1.22 7.052 7.04 68.18 37.93 16.45 11.28<0.05<0.05<0.05>0.05<0.05<0.05<0.05>0.05<0.05<0.05<0.05<0.05<0.05<0.05

表2 RDW、OPN值与肝功能重要指标及凝血指标间的相关性
2.3 不同贫血程度肝硬化患者的RDW、OPN 比较 重度贫血组患者的RDW、OPN 值明显高于轻中度贫血组和无贫血组,差异均具有统计学意义(P<0.05),见表3。
2.4 不同病情程度肝硬化患者的RDW 和OPN值比较 肝功能失代偿组患者的RDW、OPN 值明显高于代偿组和对照组,差异均具有统计学意义(P<0.05),见表4。
表3 不同贫血程度肝硬化患者的RDW、OPN比较()

表3 不同贫血程度肝硬化患者的RDW、OPN比较()
注:与无贫血组比较,aP<0.05;与轻中度贫血组比较,bP<0.05。
组别无贫血组轻中度贫血组重度贫血组F值P值例数42 23 22 RDW(%)14.65±2.16 15.95±1.85a 17.64±2.52ab 13.69<0.01 OPN(ng/mL)82.75±22.64 113.57±32.56a 141.56±36.27ab 30.25<0.01
表4 不同病情程度肝硬化患者的RDW和OPN比较()
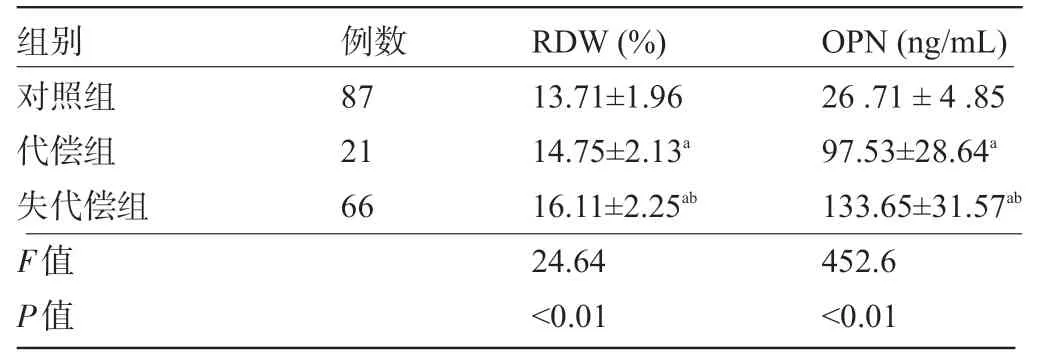
表4 不同病情程度肝硬化患者的RDW和OPN比较()
注:与对照组比较,aP<0.05;与代偿组比较,bP<0.05。
组别 例数RDW(%)OPN(ng/mL)对照组代偿组失代偿组F值P值87 21 66 13.71±1.96 14.75±2.13a 16.11±2.25ab 24.64<0.01 26.71±4.85 97.53±28.64a 133.65±31.57ab 452.6<0.01
2.5 不同病因肝硬化患者的RDW和OPN比较 酒精肝硬化组、肝炎肝硬化组和其他病因肝硬化组患者的RDW、OPN 值比较差异均无统计学意义(P>0.05),见表5。
表5 不同病因肝硬化患者的RDW和OPN值比较()
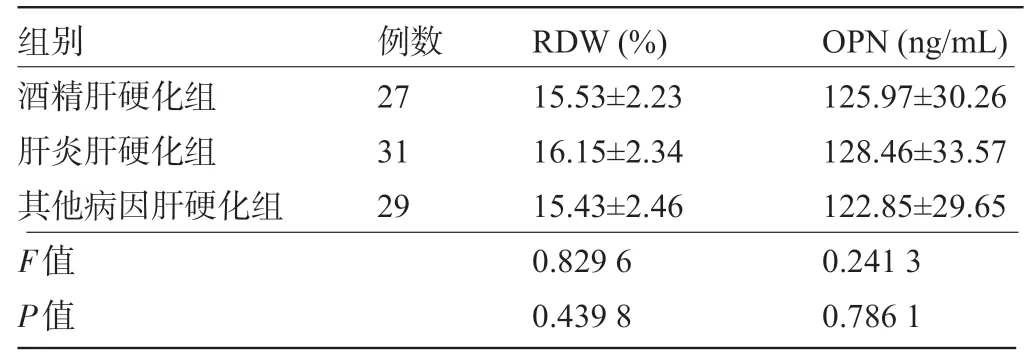
表5 不同病因肝硬化患者的RDW和OPN值比较()
组别 例数RDW(%)OPN(ng/mL)酒精肝硬化组肝炎肝硬化组其他病因肝硬化组F值P值27 31 29 15.53±2.23 16.15±2.34 15.43±2.46 0.829 6 0.439 8 125.97±30.26 128.46±33.57 122.85±29.65 0.241 3 0.786 1
2.6 不同Child-Pugh分级肝硬化患者的RDW和OPN 比较 按照Child-Pugh 分级评分表分组,A 级、B级和C级三组RDW、OPN值均明显高于对照组,差异具有统计学意义(P<0.05);C 级RDW、OPN 值明显高于B级、A级,差异具有统计学意义(P<0.05),见表6。
表6 不同Child-Pugh分级肝硬化患者的RDW和OPN比较()

表6 不同Child-Pugh分级肝硬化患者的RDW和OPN比较()
注:与对照组比较,aP<0.05;与A组比较,bP<0.05;与B组比较,cP<0.05。
组别 例数RDW(%)OPN(ng/mL)对照组A组B组C组F值P值87 38 29 28 13.71±1.96 14.31±2.10a 15.95±1.24a,b 17.12±1.85a,c 24.64<0.01 26.71±4.85 92.15±28.27a 140.04±31.37a,b 170.65±36.41a,c 452.6<0.01
3 讨论
引起肝硬化的主要原因有慢性肝炎、酒精性肝硬化、药物性肝损害、自身免疫及胆汁淤积性肝炎等,其机制主要是大量肝细胞变性坏死、广泛肝纤维化、肝假小叶及再生结节形成[7-8]。RDW升高常通常表明机体内存在炎症反应和/或伴铁代谢异常[9],而有研究证实RDW与肝纤维化程度密切相关[10],然而肝硬化患者的RDW值升高的具体原因仍不明确。自从首次发现OPN蛋白在肝脏中的表达增加,越来越多的证据证实了OPN在慢性肝病、纤维化和肝硬化进展中的病理作用[11-12]。OPN是细胞外基质蛋白网络中的重要细胞因子,有助于肝纤维化发生[4]。在过表达OPN 转基因小鼠模型实验中证实即使没有促纤维化因子的作用,小鼠仍发生肝纤维化[13]。尽管研究表明OPN 在肝纤维化发生中可能发挥的作用,但OPN在促进肝纤维化中的详细机制仍不完全清楚。
本研究结果显示,肝硬化患者RDW、OPN、ALT、AST、TBil、GGT指标较对照组明显升高,而RBC、Hb、PLT 及Alb 较对照组明显降低,这也与先前的研究结论相吻合,也符合肝硬化患者的病情变化特点[9,13-19]。同时,肝硬化患者 RDW、OPN 与 ALT、AST、GGT、TBil、PT呈正相关,与Alb呈负相关,随着肝功能下降,RDW、OPN 值不断增加,证实了RDW、OPN 值与肝功能变化密切相关,可用于评价肝功能的恶化程度;肝硬化失代偿期组RDW、OPN值明显高于代偿期组,证实RDW、OPN 值与肝硬化严重程度有关。而不同病因的肝炎后肝硬化组、酒精性肝硬化组和其他病因肝硬化组见RDW、OPN值没有差异,因此RDW、OPN值不能用于区分肝硬化病因。但是,RDW、OPN 值与Child-pugh 分级密切相关,随着Child-pugh 评分的升高,RDW值也明显增大,且在A、B、C三组组间差异有统计学意义,可作为Child-pugh分级参考指标。
有研究表明,肝硬化患者因门脉高压导致消化吸收功能减退而造成的叶酸、铁元素及维生素B12的缺乏,引起RDW 升高[20]。机体氧化与抗氧化作用失衡,红细胞因氧化应激寿命缩短,导致部分未成熟红细胞入血,炎症因子抑制红细胞成熟,促进未成熟的网织红细胞入血,血浆脂蛋白代谢异常,使红细胞膜形态改变,红细胞失去正常结构更容易被破坏,多因素共同作用引起RDW 升高[21-23]。OPN 被认为是调节成纤维细胞转化生长因子-1,性别决定区Y-box 9在活化的造血干细胞上可以促进OPN 的产生,OPN 刺激HSCs细胞内HMGB1 的乙酰化,导致胶原的上调促进肝脏纤维化[24-25]。有研究表明OPN 的作用与OPN 的代谢有关,通过凝血酶切割OPN暴露额外的整合素结合基序,OPN裂解水平与肝纤维化程度呈正相关[26]。还有研究表明OPN与Hedgehog通路的活性以及纤维化程度相关,在肝硬化患者中明显上调[27-28]。
肝硬化根据病程可分为代偿期与失代偿期[29],代偿期肝硬化患者临床上常无症状或仅有轻微症状却无特异性,其肝功能可能在正常范围或仅有轻度减低,随着病情进一步恶化,进入肝功能失代偿期,引起不同程度的脾大脾亢、腹腔积液、消化道出血、肝性脑病及营养不良等,患者生活质量明显下降。因此,RDW、OPN 值对早期评估肝硬化患者肝功能状态进行临床干预,延缓肝功能衰退改善患者生活状态至关重要。肝硬化的病因繁多,在我国肝炎肝硬化占比最大,占总患患者数的半数以上[30-32]。由于生活水平的改善,酒精性相关因素导致的肝硬化比例也逐年增加,仅次于肝炎肝硬化[14]。自身免疫性肝硬化常见于欧美国家[33],近年来我国患患者数亦呈上升趋势,其病因可能与遗传易感性及免疫缺陷相关,该类型肝硬化女性较男性发病率高[34],与酒精性肝硬化相反[35]。肝硬化发病主要与上诉病因密切相关,然而RDW、OPN 值不能用于区分肝硬化病因。Child-pugh 评分标准广泛应用于临床,用于分析肝硬化患者的肝功能损害程度,评价肝脏储备功能及预测预后[36]。RDW、OPN 作为现阶段研究热点,其与Child-pugh 评分之间的关系一直备受关注,本研究证明了RDW、OPN值与Child-pugh 分级呈正相关,可作为Child-pugh 分级参考指标。
综上所述,RDW、OPN 值在肝硬化患者中明显升高,虽然无法用于诊断肝硬化病因,但是对肝硬化患者贫血程度的鉴别和肝硬化病程的判断有着重要意义。遗憾的是本研究样本量不足,没有得出评估肝硬化的RDW、OPN 参考值,课题组将在以后逐渐完善。总之,RDW、OPN 值对推断肝硬化患者病情严重程度、Child-pugh分级有着重要价值,为肝硬化患者的临床诊疗提供了帮助。
