木犀草素对MHCC97H 源性肝癌干样细胞HADC1 活性和自我更新的影响
2020-12-18邱叶贝曹建国崔迎红
邱叶贝,蔡 霈,许 畅,曹建国,崔迎红
(1.湖南省小分子靶向药物研制与创制重点实验室,湖南师范大学医学院,长沙 410006;2.湖南省妇幼保健院,长沙 410028)
新近研究表明肝癌干细胞是HCC 发生发展的根本原因[1,2]。我们前期研究证明HDAC 抑制剂曲古霉素 A(trichostatin A,TSA)抑制MHCC97H 源性肝癌干样细胞(liver cancer stem-like cells,LCSLCs)自我更新能力[3]。提示HDAC 可能参与调节LCSLCs 的生物学功能。研究报道木犀草素(Luteolin,LUT)可诱导HCC 细胞凋亡,抑制细胞增殖[4]。然而,LUT 对MHCC97H 细胞系源性LCSLCs自我更新是否有抑制作用及其作用机制尚不清楚。据此,本文旨在阐明LUT 是否通过抑制HADC1 活性和表达从而抑制MHCC97H 源性LCSLCs 自我更新能力。
1 材料与方法
1.1 细胞培养人肝细胞癌 MHCC97H 细胞系购自中国科学院细胞库(中国上海);用含10%胎牛血清(FBS)、100 IU/ mL 青霉素和100μg/mL 链霉素的高糖DMEM 置37°C、含5%CO2的增湿培养箱中培养。
1.2 MHCC97H 细胞系球细胞培养与扩增MHCC97H 细胞以2×103个细胞/孔的密度悬浮在由无血清DMEM / F12(Invitrogen,Carlsbad,CA,USA)和100 IU / mL 青霉素、100μg/ mL 链霉素、20ng/ mL hrEGF(Invitrogen)、20ng/ mL hbFGF(Invitrogen)、2%B27(Invitrogen)、0.4%BSA(Invitrogen)和4μg/ mL 胰岛素(Sigma-Aldrich)组成的肿瘤干细胞培养基(CSC-M)中,培养6 d,获得第一代球细胞,再次球形成培养,得到第二代球形成细胞用作LCSLCs。
1.3 HADC 活性测定根据制造商说明书提供的实验方案,用比色测定试剂盒(美国Bio Vision 公司)分析MHCC97H 源性LCSLCs 的HDAC1 活性。简言之,使用Nuclear Extract 试剂盒(比利时Active Motif 公司)提取细胞核裂解物,与HDAC1 的底物一起温育6 h,用多功能酶联免疫仪(美国Promega 公司)取405 nm 波长读取吸光度值。
1.4 实时荧光定量 PCR用TRIzol 试剂(美国Life Technologies 公司)提取总RNA。用Transcriptor First Strand cDNA Synthesis 试剂盒(美国Life Technologies 公司)将RNA 逆转录成cDNA。用SYBR PremixEx Taq II方法(美国Life Technologies 公司)以ABI 7500 实时PCR系统(美国Thermo Fisher 公司)进行qRT-PCR 分析。2-ΔΔCt方法计算表达水平。在本研究中,使用上海生工公司(中国上海市)合成的引物:HDAC1 正向:5′-GC CATCCTGGAACTGCTAAA-3′,反向:5′-GGCTTGA AAATGGCCTCATA-3′。
1.5 Western blot按照先前发表的文献[5]所述,在冰上,用RIPA 裂解缓冲液(美国Beyotime Biotechnology 公司)裂解收集的细胞。每个样品的等量蛋白质(50μg)用10%SDS-PAGE 分离。以半干印迹仪(Bio-Rad)用转移缓冲液把分离的蛋白质转移至聚偏二氟乙烯(PVDF)膜(Merck,Germany)。用含5%BSA 的TBST 室温下封闭膜1h,在4℃下,用抗HADC1 多克隆抗体(ABclonal,Cat No. A0238)轻轻摇动过夜。作为一抗,辣根过氧化酶标记山羊抗兔Ig G 二抗室温下孵育1h。用增强化学发光(ECL)试剂检测目的蛋白的条带,并通过化学发光系统(英国Syngene 公司)获得印迹条带图谱。通过Image J 软件测量每个条带的灰度值。β-actin 作为加样对照。
1.6 球形成率测定用或不用10μM LUT(Sigma Chemical)或10μM TSA(Selleck)或两者合用处理第1 代球细胞6 d,然后,在再次球形成培养中,用不含药物的CSC-M 以2000 个细胞/孔的密度接种于24 孔超低粘附培养板(美国Corning Inc 公司)培养6 d。球形成率(%)=(每孔形成的肿瘤球均数/每孔接种的活细胞数)×100%。
1.7 统计学分析使用SPSS 20.0 for windows evaluation软件(SPSS Inc,Chicago,IL)进行数据分析,数据以平均值±标准差表示,单因素方差分析(One Way ANOVA)检验组间均数的统计学意义。首先方差齐性检验,当方差齐性时,各组均数间的两两比较用 LSD 法,如果方差不齐,各组均数间的两两比较用Dunnett 法,P<0.05为有统计学意义。
2 结果
2.1 LUT 抑制MHCC97H 源性LCSLCs HADC1 活性和表达为了确定LUT 是否抑制MHCC97 H 细胞源性LCSLCs HADC1 活性和表达,我们评估10μM LUT处理的MHCC97 H 细胞源性LCSLCs HADC1 活性和HADC1 mRNA 表达水平以及HADC1 蛋白表达量。结果表明LUT 抑制MHCC97H 源性LCSLCs HADC1 活性(图1A,P<0.05),降低HADC1 mRNA 表达水平(图1B,P<0.05),并下调HADC1 蛋白表达(图1C,P<0.05)。
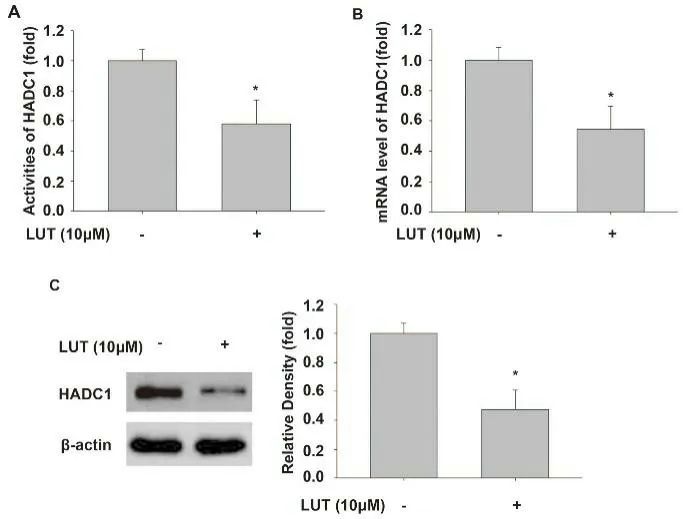
图1 LUT抑制MHCC97H源性LCSLCs HADC1活性和表达
2.2 LUT 抑制MHCC97H 源性LCSLCs 球形成能力为了确定LUT 是否抑制MHCC97 H 细胞源性LCSLCs 自我更新能力,我们采用10μM LUT 处理MHCC97 H 细胞源性LCSLCs。图2 结果表明LUT 处理显著减少MHCC97H 源性LCSLCs 的肿瘤球数目(P<0.05)。
2.3 LUT 联合TSA 对MHCC97H 源性LCSLCs HADC1 活性和表达的影响我们接下来评估LUT、TSA 以及两者合用对HADC1 活性和HADC1 mRNA 表达水平以及HADC1 蛋白表达量的影响。结果表明,与LUT 或TSA 单独处理相比,两者合用协作性抑制HADC1 活性(图3A,P<0.05),降低HADC1 mRNA 表达水平(图3B,P<0.05)以及下调HADC1 蛋白表达量(图3C,P<0.05)。

图2 LUT抑制MHCC97H源性LCSLCs球形成能力

图3 LUT联合TSA对MHCC97H源性LCSLCs HADC1活性和表达的影响
2.4 LUT 联合TSA 对MHCC97H 源性LCSLCs 球形成的影响我们最后评估LUT、TSA 以及两者合用对MHCC97 H 细胞源性LCSLC 的球形成的影响。球形成率测定结果表明,与LUT 或TSA 单独处理相比,两者合用协作性减少MHCC97H 源性LCSLCs 的肿瘤球数目(图 4,P<0.05)。
3 讨论
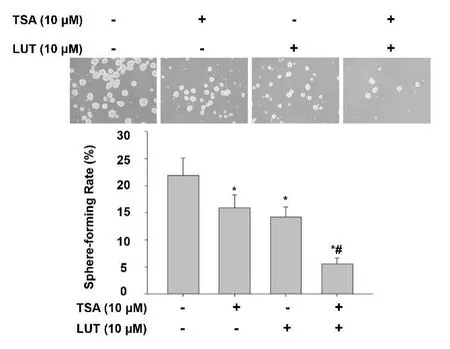
图4 LUT联合TSA对MHCC97H源性LCSLCs球形成的影响
本研究实验结果表明:LUT 能减弱MHCC97H 源性LCSLCs 的HADC1 活性,降低HADC1 mRNA 表达水平,下调HADC1 蛋白表达,并平行地减少肿瘤球数目。提示:LUT 能通过抑制HADC1 抑制LCSLCs 自我更新。相比于单用LUT 或TSA 处理,LUT 与TSA 联合应用协作性减弱 MHCC97H 源性LCSLCs HADC1 活性,降低HADC1 mRNA 表达水平,下调HADC1 蛋白表达,并平行地减少肿瘤球数目。提示:LUT 能够增强TSA 抑制MHCC97H 源性LCSLCs HADC1 活性和表达及其自我更新的作用。
许多研究证明,肝癌干细胞是肝癌患者预后不良的主要原因,因为它具有很高的肿瘤发生、发展、复发和转移的潜能[6]。因此寻求能够靶向LCSLCs 的新药物是治疗HCC 的一种有前景的策略。HDAC1 和HDAC2在大多数肝癌组织中上调[7,HDAC 抑制剂诱导癌细胞周期停滞,分化和细胞死亡,减少血管生成并调节免疫反应,它被认为是有前途的抗癌药物,尤其是与其他抗癌药物和/或放疗联合使用时[8]。我们团队先前的研究表明,人HCC MHCC97H 源性第二代球细胞比亲本细胞自我更新能力更强、HADC1 活性和表达更高,TSA能抑制人肝细胞癌MHCC97H 源性LCSLCs HADC1 表达以及自我更新作用[6]。本文首次证明LUT 单独应用或联合TSA 能通过下调HDAC1 的活性和表达抑制MHCC97H 源性LCSLCs 自我更新能力,且证实LUT 与TSA 联合应用具有协作效应,相比与单独应用LUT 或TSA 作用更强,为发现靶向LCSLCs 治疗HCC 更高效,更低毒副作用的治疗方案提供了实验证据。
总而言之,本文的研究提供了HADC1 介导LUT 抑制LCSLC 自我更新能力的新见解,为临床应用 LUT 治疗HCC 提供了实验依据,揭示了LUT 抗HCC 作用的一种新机制,同时,也为HADC1 抑制剂联合用药治疗HCC 提供了一个新策略。这些结果表明,LUT 是治疗人HCC 患者有希望的候选药物。
