运动诱导的生理性心肌肥大中miR-497-3p的表达变化及作用
2020-12-18张波齐洁张钧
张波 齐洁 张钧
1 濮阳医学高等专科学校(河南濮阳457000)
2 上海师范大学体育学院(上海200234)
研究认为[1]心肌肥大是心脏重塑的主要表现之一,并且将心脏重塑分为生理性重塑和病理性重塑。运动性心脏肥大是一种典型的生理性心脏肥大。microRNAs 是生物体内的一组具有高度保守性的非编码RNA,由20~30个核苷酸组成,长度为19~25个碱基,它们主要通过与靶基因3’端结合抑制靶基因mRNA的翻译,进而调控靶基因的表达[2-3],其在运动性心肌肥大中起着重要作用[4],相关研究指出过表达miR-130b、miR-653、miR-103-1 等或抑制miR-126、miR-181a 等均可形成生理性心脏肥大[5-8]。细胞自噬是一种普遍存在的代谢方式,可降解心肌细胞中错误折叠的蛋白质、损伤的细胞器等来调节运动性心肌肥大。亦有文献指出,miRNAs可通过调节不同自噬相关基因调节自噬活性,如miR-181a 可调节Atg-5[9],miR-16 可调节Atg-14[10]等。有研究指出在运动性心肌肥大中,miR-497-3p发生显著下调[5];李丽等[11]发现有氧运动可上调心肌细胞自噬的作用。但miR-497-3p是否可通过Beclin1影响自噬水平,进而参与运动性心肌肥大的发生发展仍不明确。本研究通过检测miR-497-3p 及其下游Beclin1在运动性心肌肥大组织中的表达,探讨其在运动性心肌肥大形成过程中的分子机制。
1 材料与方法
1.1 实验动物
6周龄Sprague-Dawley纯系雄性健康大鼠24只,体重130 ± 20 g,购自上海杰思捷实验动物有限公司,许可证编号:SCXK(沪)2012-0002。分笼喂养,每笼4 ±1只。室温22 ± 3℃,相对湿度45%~55%,自然光照,自由摄食和饮水。
1.2 实验分组及大鼠心肌肥大模型的制备
大鼠适应性饲养1周后随机分为2组:安静对照组(n=12)、运动性心肌肥大模型组(n=12)。参照Fernandes 和Hashimoto 等[12]的研究制定10 周游泳运动训练方案。运动结束后通过检测大鼠体重、心脏质量指数和左心室质量指数,并进行HE 染色,采用实时荧光定量PCR法检测大鼠心肌病理性肥大相关标志物基因心钠素(atrial natriuretic polypeptide,ANP)、心肌肌球蛋白重链(myosin heavy chain)α 和β(α-MHC、β-MHC)、α-肌动蛋白(α-actin)、肌浆网钙ATP 酶(sarcoplasmic reticulum Ca2+-ATPase ,SERCA2α)的表达,综合评价运动性心肌肥大动物模型的建立。
1.3 取材
运动组大鼠于末次游泳运动后,与对照组大鼠一起禁食12 小时。次日用10%水合氯醛按50 mg/kg 体重腹腔麻醉后,取大鼠心脏称重,切取左心室壁,计算全心指数及左心室指数(全心指数=全心重量/体重,左心室指数=左心室重量/体重);经多聚甲醛固定后用于制作石蜡切片。组织经石蜡包埋后,于切片机切取5 μm 厚的石蜡切片,将切片粘在干净的载玻片上,进行HE染色。用光学显微镜放大400倍观察处理好的载玻片并拍照,并用Image-Pro Plus6.0软件测量细胞直径,多次测量取平均值。其余组织迅速装入标记好的冻存管中,投进液氮,然后转入-80℃保存,用于mRNA 及蛋白检测。
1.4 RNA提取与RT-qPCR
严格按照Trizol 法进行组织总RNA 提取,按标准方法进行定量。根据反转录试剂盒的说明,首先通过逆转录合成互补脱氧核糖核酸(cDNA):miR-497-3p采用加尾反转录,将样品RNA 浓度稀释为2ng/μl,按照Mir-XTMmiRNAFrist-Strand Synthesis and SYBR®RT-qPCR UserManual 试剂盒(TaKaRa 公司)的说明书进行实验操作(10 μl 体系);Beclin1 反转录:将样品RNA 的浓度稀释为100 ng/μl,按照PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒(TaKaRa 公司)的说明书进行实验操作。然后用聚合酶链反应(PCR)扩增出互补的脱氧核糖核酸(cDNA):实验步骤按SYBR®Premix Ex TaqTMII(TilRNaseH Plus)试剂盒(TaKaRa 公司)说明书进行操作。实时荧光定量检测采用2-△△Ct法,内参为GAPDH。每个样品重复3 次,结果取平均值。
在NCBI的Nucleotide 数据库中寻找目标mRNA的核酸序列,使用PrimerPremier5.0设计目的基因的扩增引物,通过Blast软件对引物的特异性进行匹配,最后使用Oligo7.37筛选最优化的引物,具体引物结构参考表1。

表1 引物序列
1.5 总蛋白提取及Western Blotting
从心肌组织和心肌细胞中提取总蛋白,使用BCA蛋白测定试剂盒(23227,ThermoScientific,Rockford,Illinois,USA)按标准方法进行定量。蛋白样品经电泳、转膜后,一抗GAPDH、Beclin1(1∶1000,Cell Signaling Technology公司)4℃孵育过夜,次日洗膜、孵育二抗(1∶1000,CellSignaling Technology 公司),洗膜然后进行显色分析。
1.6 双荧光素酶报告基因实验
通过生物信息学在线软件Targetscan(http://www.targetscan.org)、Pic Tar(https://pictar.mdc-berlin.de/)及DIANAmicroT(http://www.microrna.gr/microT)预测miR-497-3p 的靶基因,GenBank 中查找miR-497-3p 靶基因Beclin1 3'UTR 序列,分别构建两端带有Not Ⅰ和XhoⅠ酶切位点的含有野生型Beclin1 3’-UTR 序列的荧光素酶报告基因质粒(Beclin1-WT)和含有突变型Beclin1 3’-UTR 序列的荧光素酶报告基因质粒(Beclin1-Mut)。之后重组入双荧光素酶报告基因质粒psi-CHECK2多克隆位点,分别获得野生型及突变型克隆并测序鉴定正确性。
构建成功后与miR-497-3p mimics、mimics-NC、miR-497-3p inhibitors、inhibitor-NC 共转染到H9C2 细胞中,H9C2 细胞采用DMEM 培养基加10%胎牛血清、1%双抗,于37℃、5%CO2细胞培养箱中培养。取对数生长期细胞,按3×105个/ml 的密度接种细胞,待细胞密度达80%时进行转染。转染48 h 后,收集细胞,用Promega Dual LuciferaseAssayKit 处理,用GloMaxTM96 Microplate Luminometer测定荧光活性。
1.7 统计学方法
采用SPSS 23.0统计软件,对组间数据进行单因素方差分析和显著性t检验,采用LSD 法进行多重比较,所有数据以平均数±标准差(x±s)表示。P<0.05表示有显著性差异,P<0.01表示有非常显著性差异。
2 结果
2.1 运动性心肌肥大动物模型的建立
2.1.1 大鼠全心指数、左室指数的变化
如表2 和图1 所示,10 周游泳运动后,模型组大鼠全心指数、左室指数及心肌细胞直径均高于对照组(P<0.05,P<0.01,P<0.05)。以上结果表明:10 周游泳运动刺激使大鼠心脏左心室肥大。

表2 大鼠心脏肥大状况评价

图1 大鼠心肌细胞形态(HE染色)
2.1.2 大鼠心肌组织ANP、α-MHC、β-MHC、α-actin mRNA的表达变化
表3 显示,与对照组相比,模型组大鼠心肌内ANP、α-actin、α-MHC、β-MHC、SERCA2α的mRNA 表达水平并未发生显著的变化。结合全心指数、左心室指数、心肌细胞直径及病理性指标结果可知:10周游泳运动并未导致大鼠心脏病理性肥大,运动性心脏肥大模型建立成功。
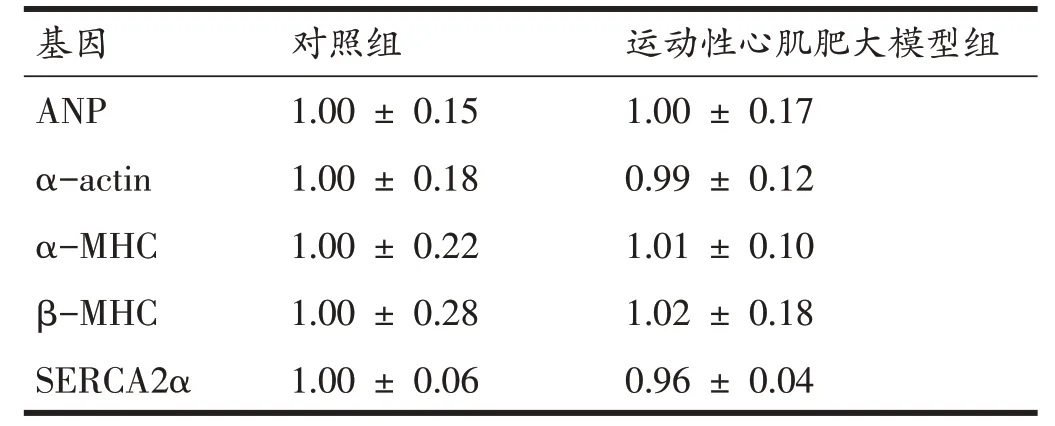
表3 心肌病理性标志物的mRNA表达量
2.2 大鼠心肌miR-497-3p的表达变化
本实验结果显示:运动10周后运动性心肌肥大模型组(0.77 ± 0.13)大鼠心肌组织miR-497-3p 表达水平较对照组(1.00 ± 0.06)显著降低(P<0.01)。
2.3 大鼠心肌组织Beclin1 蛋白和mRNA 表达水平的变化
实验结果显示:与对照组(1.00 ± 0.24)相比,运动性心肌肥大模型组(2.09 ± 0.72)大鼠心肌组织中Beclin1 mRNA 显著上升(P<0.01),蛋白表达水平也显著上调(P<0.01)(图2)。

图2 大鼠心肌Beclin1蛋白表达水平变化
2.4 过表达及干扰表达miR-497-3p腺病毒感染H9C2心肌细胞中Beclin1表达水平变化
如表4 及图3 所示,与H9C2 空白细胞和对照病毒感染细胞组相比,miR-497-3p过表达腺病毒感染细胞后Beclin1 mRNA 及蛋白的表达水平显著降低(P<0.01,P<0.01),空白细胞无差异。表5及图4表示:与对照病毒感染细胞相比,miR-497-3p干扰表达腺病毒感染细胞中Beclin1 mRNA 和蛋白的水平显著升高(P<0.01,P<0.01),空白细胞无差异。

表4 miR-497-3p过表达病毒感染心肌细胞Beclin1 mRNA表达水平变化

图3 miR-497-3p过表达病毒感染心肌细胞Beclin1蛋白表达水平变化

表5 miR-497-3p干扰表达腺病毒感染心肌细胞Beclin1 mRNA表达水平变化
2.5 miR-497-3p 靶向调控Beclin1调控运动性心肌肥大
如图5所示,双荧光素酶报告基因实验结果表明:共转染野生型Beclin1(Beclin1-WT 3’UTR)和模拟过表达miR-497-3p(miR-497-3pmimics)组相对荧光素酶活性显著低于mimics-NC组;与之相反,共转染突变型Beclin1 (Beclin1-WT 3’UTR)和模拟抑制表达miR-497-3p(miR-497-3p inhibitor)组相对荧光素酶活性显著高于inhibitor-NC 组,而两组分别与Beclin1-MT 3’UTR共转染后,与NC组无差异。
3 讨论
3.1 运动性心肌肥大动物模型的建立评价
运动性心肌肥大是运动训练中普遍出现的一种生理现象,主要表现为心脏增大、重量增加、心肌肥大、体积增大、心室壁增厚等[13-15]。在运动性心脏肥大中,运动刺激激活心肌蛋白质合成的信号通路,抑制代谢通路,导致心肌蛋白质合成增多从而形成运动性心肌肥大[16]。在病理性心肌肥大中,心肌纤维不仅变肥大,还会出现边缘不整齐、纵横交错,纤维间产生水肿、细胞核增大等现象[17]。在病理性心脏肥大中,ANP 和骨骼肌α-actin的表达量上升,同时心肌细胞中的α-MHC转换为β-MHC,因此α-MHC/β-MHC 的比值降低[18]。本研究结果表明:10 周的游泳运动导致模型组大鼠全心指数、左室指数及心肌细胞的直径显著增加,病理性心脏肥大相关指标均未发生改变,提示SD大鼠运动性心肌肥大模型建立成功。

图4 miR-497-3p干扰表达腺病毒感染心肌细胞Beclin1蛋白表达水平变化
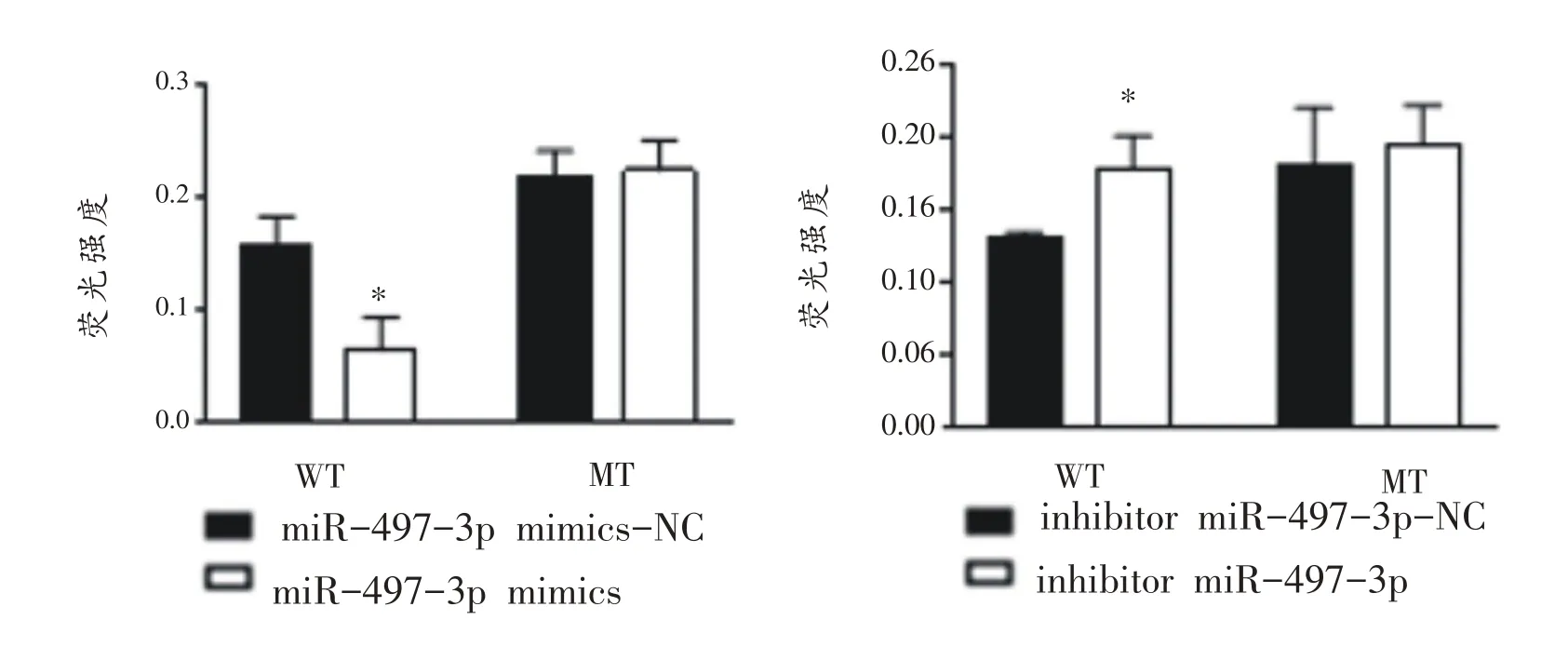
图5 野生型及突变型Beclin1在过表达、抑制表达miR-497-3p后的变化
3.2 miR-497-3p 负性调控Beclin1调控运动性心肌肥大
研究表明,miRNAs表达水平的变化与运动性心肌肥大有关[13,19-21]。为了进一步研究引起大鼠运动性心肌肥大的机制,在前期研究的基础上,本研究选择了参与调控自噬相关基因的miRNAs 进行研究。前述的实验研究已经明确在运动性心肌肥大中miR-497-3p 表达下降。有研究发现:运动主要通过控制心肌蛋白质的质量进而增加心肌细胞自噬水平,从而维持心肌细胞正常的能量代谢,保持正常心功能,调节心脏生理性肥大。为了探讨在运动性心肌肥大中自噬水平的变化,本研究检测了大鼠心肌组织自噬标记物——Beclin1 mRNA及蛋白表达水平。结果显示,在运动性心肌肥大模型组大鼠心肌中,自噬相关蛋白Beclin1的表达显著上升。
既往也有文献指出下调miR-497可使自噬活性增强[22]。为了进一步验证miR-497-3p 是否通过自噬相关基因Beclin1调控运动性心肌肥大,本研究通过选取H9C2心肌细胞感染过表达及干扰表达miR-497-3p之后检测Beclin1 mRNA和蛋白水平。本研究结果表明,H9C2 心肌细胞感染过表达miR-497-3p 腺病毒后,抑制了自噬相关基因Beclin1 的mRNA 和蛋白表达水平;感染干扰表达miR-497-3p 腺病毒后,Beclin1 mRNA和蛋白的水平显著升高。通过miRNA 靶点的生物信息学预测发现,大鼠Beclin1 的基因序列中,编码区第1595-1601 碱基的位置序列(TGGTTTG)是miR-497-3p的结合位点,通过双荧光素酶报告基因实验验证后,确定Beclin1 是miR-497-3p 的靶基因。综上所述,在运动性心肌肥大中,miR-497-3p可靶向负性调控自噬相关基因Beclin1的表达。
3.3 运动通过影响miR-497-3p 调控运动性心肌肥大的机制探讨
细胞自噬是生命体中普遍存在的一种代谢通路,是物种进化过程中高度保守的代谢机制[23]。目前已发现30 余种自噬相关基因(autophagyrelatedgenes,Atg),这些蛋白质调控了细胞自噬的起始、进展、成熟及与溶酶体融合[24]。由Atg1、Atg13、Atg17、Atg9组成的泛素激酶(ubiquitin like kinase,ULK)复合物,与Beclin-1 结合的IP3复合物,Atg5-Atg12-Atg16多聚复合物参与自噬起始阶段[25-26]。一旦自噬激活,Beclin1便从内质网上Bcl-2/Beclin1 复合物中解离,与UVRAG(Ultra-Violet Radiation Resistance-Associated Gene)、AMBRA(Activating Molecule in Beclin1-Regulated Autophagy)形成复合物,然后再由Atg7 和Atg10 介导形成Atg5-Atg12-Atg10 多聚复合物。Beclin1 是自噬小泡形成的起始调节因子[27],减少其表达则会干扰自噬的发生,所以Beclin1是自噬体成核的关键基因之一[28]。多种因素可调控细胞自噬,相关研究已明确指出雷帕霉素靶蛋白(mTOR)可负性调控自噬水平[29],又有研究指出心肌中的单磷酸腺苷活化蛋白激酶(AMPK)活性可被有氧运动上调[30]。这提示自噬可通过运动训练这种机械刺激来调节[31],进而平衡运动中、运动后心肌细胞的能量代谢。
大量研究指出,自噬在运动性心脏肥大产生中扮演着重要角色。一方面,自噬激活后可促进细胞增殖、抑制凋亡[32-34],亦有文献提出抑制细胞凋亡是产生运动性心肌肥大的重要途径之一[35]。另一方面,心肌细胞自噬可通过自噬溶酶体途径清除衰老或受损的细胞器、衰老或错误折叠的蛋白质、自由基等代谢产物,产生游离脂肪酸和氨基酸等能源物质,而后通过三羧酸循环生成ATP,供心肌细胞能量代谢需要[36,17],这些物质也是产生心脏肥大的原材料,促进心肌增殖。在运动刺激下,自噬还能够通过清除心肌细胞衰老或受损的细胞器及错误折叠的蛋白,有效预防心脏产生过度肥大,或抑制生理性肥大向病理性肥大的转变,这在心肌对运动的适应中起着重要作用。另外有研究发现,心肌细胞中miRNAs可调控自噬水平[37-40]。本研究结果也表明,运动通过下调miR-497-3p靶向促进自噬相关蛋白基因Beclin1的表达提高自噬水平,最终调控运动性心肌肥大的发生。
细胞自噬在保持心脏正常结构与生理功能方面具有极其重要的作用。本研究结果显示:运动性心肌肥大模型组大鼠心肌组织中的miR-497-3p 表达显著下调,Beclin1 作为miR-497-3p 的靶基因,其表达水平显著升高。这表明10 周的运动不仅促进心脏生理性肥大形成,还诱导了自噬通路的激活。运动不仅可以上调心肌细胞自噬水平,维持心肌细胞正常的能量代谢,也能调节心脏生理性肥大,保持正常的心功能。
4 结论
综上,本研究通过靶基因预测、靶基因表达检测及双荧光素酶报告基因实验证实,Beclin1是miR-497-3p的靶基因;10周游泳运动可下调大鼠心肌miR-497-3p的表达,靶向升高Beclin1 的表达引起自噬水平增强,从而调控运动性心肌肥大的形成。
