地黄花多糖含量测定及其柱前衍生化HPLC指纹图谱分析
2020-12-18周艳张颖张振凌李雅新刘彤彤
周艳,张颖,张振凌,*,李雅新,刘彤彤
(1.河南中医药大学药学院,河南郑州450008;2.河南农业大学农学院,河南郑州450046;3.河南省中药特色炮制技术工程研究中心,河南郑州450008;4.呼吸疾病中医药防治省部共建协同创新中心,河南郑州450008)
地黄花为玄参科植物地黄(Rehmannia glutionsa Libosch.)的花蕾,有治消渴、肾虚腰痛等功效[1];《植物名实图考》异名蜜罐[2];《本草纲目》曰:“为末服食,功同地黄,肾虚腰脊痛,为末,酒服方寸匕,日三”[3];《圣济总录》中亦有地黄花粥的记载[4]。虽然中国药典规定的药用部位是地黄的地下块根[5],地上部分不能入药。但是随着中药资源的不断开发和利用被重视[6],目前已经开展了地黄叶化学成分[7]、药理作用以及作用机制[8]和地黄叶质量控制[9]成份快速分析[10]等方面的研究。而对于地黄花的研究目前较少,仅对鲜地黄花不同部位环烯醚萜苷类成分含量进行了测定[11],对地黄花多糖抗衰老作用及机制进行了研究[12],比较了地黄花对秀丽线虫寿命的影响[13]。目前对中药中非药用部位的相关研究表明,同一种药用中药的不同部位在性味、功效上存在较大的类同性,含有相同或相似的化学成分和药理作用[6],本研究在相关研究文献基础上,拟采用水提醇沉法及苯酚-硫酸法对不同时期地黄花及盛花期地黄花不同部位的9批样品进行多糖的提取和含量测定,同时采用柱前衍生化高效液相色谱(high-performance liquid chromatography,HPLC)建立地黄花多糖的指纹图谱用于分析地黄花多糖中单糖的组成,以期为地黄花的药用及食用领域的进一步开发提供理论依据。
1 仪器与材料
1.1 材料与试剂
鼠李糖对照品(批号:PS010542)、D-葡萄糖对照品(批号:PS160816-03)、阿拉伯糖对照品(批号:PS010529)、D-半乳糖对照品(批号:PS010530):成都普思生物科技股份有限公司,纯度均大于98%;乙腈:北京迪克马科技有限公司;冰乙酸(色谱纯):天津市科密欧化学试剂有限公司;乙醇:天津富宇精细化工有限公司;苯酚:上海麦克林生化科技有限公司;硫酸:烟台市双双化工有限公司;乙酸铵:天津市光复科技发展有限公司。地黄花于2019年4月份采自河南省焦作市武陟县,经河南中医药大学张振凌教授鉴定为玄参科植物地黄(Rehmannia glutionsa Libosch.)的花蕾。采摘花蕾期、盛花期和凋零期的地黄花,花蕾期分为刚有花蕾出现的花蕾初期(S1)、花蕾长为2 cm~3 cm且花蕾头部未见到任何要开放迹象的花蕾中期(S2)、花蕾顶部膨大含苞待放的花蕾后期(S3);盛花期分为花裂片刚打开的盛花初期(S4)和花裂片已经完全打开,且花颜色浅于花开初期的盛花后期(S5);花刚出现衰败但未完全枯萎的凋零期(S6),经低温干燥后,选取盛花后期的一部分地黄花从上到下剪开分为花裂片(S7)、花筒上部(S8)、花筒下部(S9)三部分,分别密封避光保存。
1.2 仪器与设备
UV-3200S型紫外可见分光光度计:上海美谱达仪器有限公司;Waters 600-UV 2487高效液相色谱仪:美国Waters公司;FW-200型高速万能粉碎机:北京中兴伟业仪器有限公司;UPT-Ⅱ-10T型优普系列超纯水器:成都超纯科技有限公司;HH-6仪表恒温水浴锅:上海树立仪器仪表有限公司;GZX-9070 MBE型数显鼓风干燥箱:上海博讯实业有限公司医疗设备厂;BT25S型十万分之一天平、BSA224S-CW型万分之一天平:赛多利斯科技仪器有限公司;KQ-500DV型数控超声波清洗器:昆山市超声仪器有限公司。
2 方法与结果
2.1 多糖含量测定
2.1.1 供试品溶液的制备
取地黄花各样品粉末约0.15 g,精密称定,置索氏提取器中,加入80%乙醇100 mL,加热回流提取4 h,弃去乙醇液,取出残渣,挥干乙醇,残渣置于烧杯中,加水50 mL煎煮1 h,得到多糖提取液,晾凉,转移至25 mL容量瓶,加水定容至刻度,摇匀,从中精密吸取1 mL,加入蒸馏水稀释4倍,备用。
2.1.2 对照品溶液的制备
精密称取D-葡萄糖2.30 mg,置25 mL容量瓶中,加水溶解并稀释至刻度,摇匀,得每1 mL含D-葡萄糖0.092 mg的对照品溶液。
2.1.3 线性关系考察
精密吸取对照品溶液 0.2、0.4、0.6、0.8、1.0 mL,分别置于10 mL具塞试管中,各加水补至1.0 mL,精密加入5%苯酚溶液1 mL,摇匀,迅速加入浓硫酸5 mL,摇匀,置沸水浴中加热10 min,取出,置冷水浴中冷却3 min,另取蒸馏水1 mL,加苯酚溶液和浓硫酸,同上操作作为空白对照,采用紫外-可见分光光度法,在490 nm波长下测定吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程为y=0.067 2 x-0.017 9(r=0.999 7),结果表明,D-葡萄糖在 2.63 mg/L~13.14 mg/L范围内与吸光度呈良好线性关系。
2.1.4 精密度试验
精密吸取“2.1.1”项下S3供试品溶液1 mL,按照“2.1.3”项下方法测定吸光度,连续测定6次,相对标准偏差(relative standard deviation,RSD)值为 0.1%,结果表明,该方法精密度良好。
2.1.5 稳定性试验
精密吸取“2.1.1”项下S3供试品溶液1 mL,按照“2.1.3”项下方法测定吸光度,每隔30 min测定一次,至150 min,RSD值为1.4%,结果表明,该样品在150 min内基本稳定。
2.1.6 重复性试验
精密称取“2.1.1”项下S3样品粉末6份,各约0.15 g,按照“2.1.1”项下方法制备供试品溶液,按照“2.1.3”项下方法测定吸光度,RSD值为1.3%,结果表明,该方法重复性良好。
2.1.7 加样回收率试验
精密称取已知含量的S3样品粉末6份,按照“2.1.1”项方法制备供试品溶液。再精密称取D-葡萄糖对照品5.21 mg,置于25 mL容量瓶中,配成浓度为0.208 4 mg/mL的溶液。精密吸取0.5 mL各样品供试液,置于比色管中,分别精密加入180 μL上述D-葡萄糖对照品溶液,然后按照“2.1.3”项下方法测定吸光度,计算加样回收率,结果见表1。
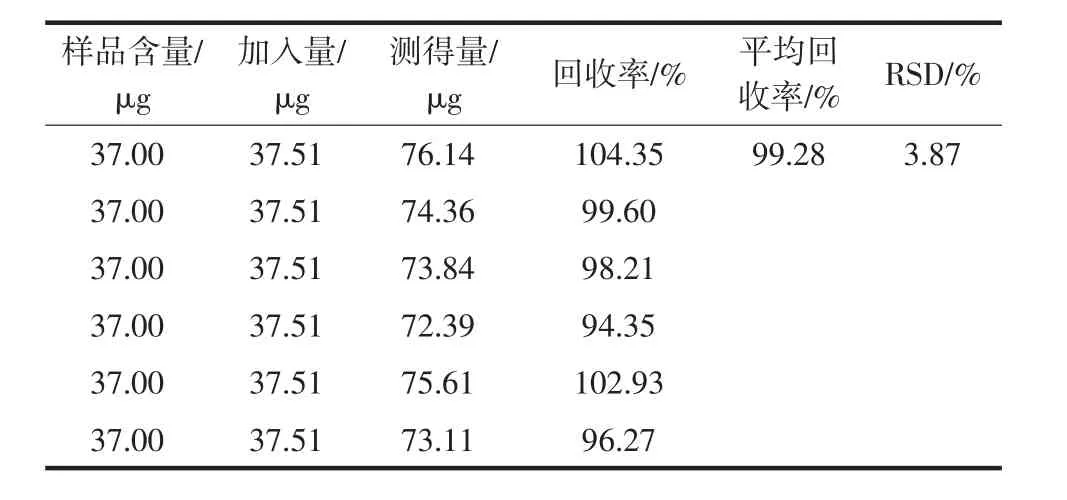
表1 地黄花多糖的加样回收率试验(n=6)Table 1 Recovery test of Rehmannia glutionsa flower polysaccharide(n=6)
2.1.8 样品含量测定
精密吸取“2.1.1”项下的多糖供试品溶液1 mL,加入蒸馏水稀释4倍,取稀释供试品溶液1 mL,按照“2.1.3”项下方法分别测定各样品吸光度,测定结果见表2。

表2 地黄花样品多糖含量结果Table 2 The polysaccharide content results of Rehmannia glutionsa flower
由表2可知,不同时期地黄花及盛花期不同部位的多糖含量具有一定的差异,其中地黄花花蕾期平均多糖含量为3.98%~4.93%,盛花期平均多糖含量为3.65%~3.78%,盛花期花裂片、花筒上部及花筒下部平均多糖含量分别为3.84%、4.05%及2.93%;地黄花花蕾期平均多糖含量高于盛花期,盛花期不同花部位花筒上部平均多糖含量最高,花裂片其次,花筒下部多糖含量最少。
2.2 HPLC指纹图谱的建立
2.2.1 对照品溶液制备
取鼠李糖、D-葡萄糖、D-半乳糖、阿拉伯糖对照品各约2 mg,精密称定,加水定容至2 mL容量瓶中,摇匀,备用。
2.2.2 供试品溶液制备
取地黄花样品粉末约1 g,精密称定,置索氏提取器中,加入80%乙醇100 mL,加热回流提取4 h,弃去乙醇液,取出残渣,挥干乙醇,残渣置于烧杯中,加入50 mL蒸馏水煎煮1 h,晾凉,转移至25 mL容量瓶,加水定容至刻度,摇匀,备用。精密吸取上述多糖溶液1 mL于顶空瓶中,加入3.0 mol/L的盐酸溶液0.5 mL,置110℃烘箱中水解1 h,取出,放凉,用3.0 mol/L的氢氧化钠溶液调节pH值至中性,备用。
2.2.3 单糖衍生化
精密吸取单糖对照品溶液和供试品溶液400 μL,置4 mL离心管中,分别加入0.5 mol/LPMP-甲醇溶液和0.3 mol/L的氢氧化钠溶液各400 μL,混匀,于70℃下水浴反应100 min,取出,放至室温25℃,加入0.3 mol/L的盐酸溶液400 μL,最后加入等体积的氯仿溶液,涡旋后静置,弃去下层,重复萃取3次,取上层溶液过0.45 μm微孔滤膜,取续滤液,备用。
2.2.4 色谱条件
采用 Waters Symmmetry ShieldTMRP18(4.6 mm×250 mm,5 μm)色谱柱;流动相为乙腈(A)-0.2 mol/L 乙酸铵溶液(B),梯度洗脱(0~2 min,10%A;2 min~5 min,13%A;5 min ~15 min,17%A;15 min ~20 min,17%~19%A;20 min ~30 min,20%A;30 min ~40 min,20% ~37%A;40 min ~50 min,37%A);流速为 1 mL/min;柱温为30℃;检测波长为250 nm;进样量为10 μL,色谱图见图1。
由图1可知,采用此色谱条件,能够得到分离度较好的地黄花样品多糖柱前衍生化高效液相色谱图,通过与单糖对照品高效液相色谱对比分析,在地黄花样品多糖柱前衍生化高效液相色谱图中含有的单糖为鼠李糖、D-葡糖糖、D-半乳糖和阿拉伯糖。
2.2.5 精密度试验
精密称取地黄花样品粉末(S3)约 1 g,按“2.2.2”及“2.2.3”项下的方法制备供试品溶液,按“2.2.4”项下色谱条件测定,重复进样6次,记录色谱图,以8号D-葡萄糖的色谱峰为参照峰(S),计算得到各共有峰相对保留时间RSD<0.10%,相对峰面积RSD<2.84%,表明仪器精密度良好。
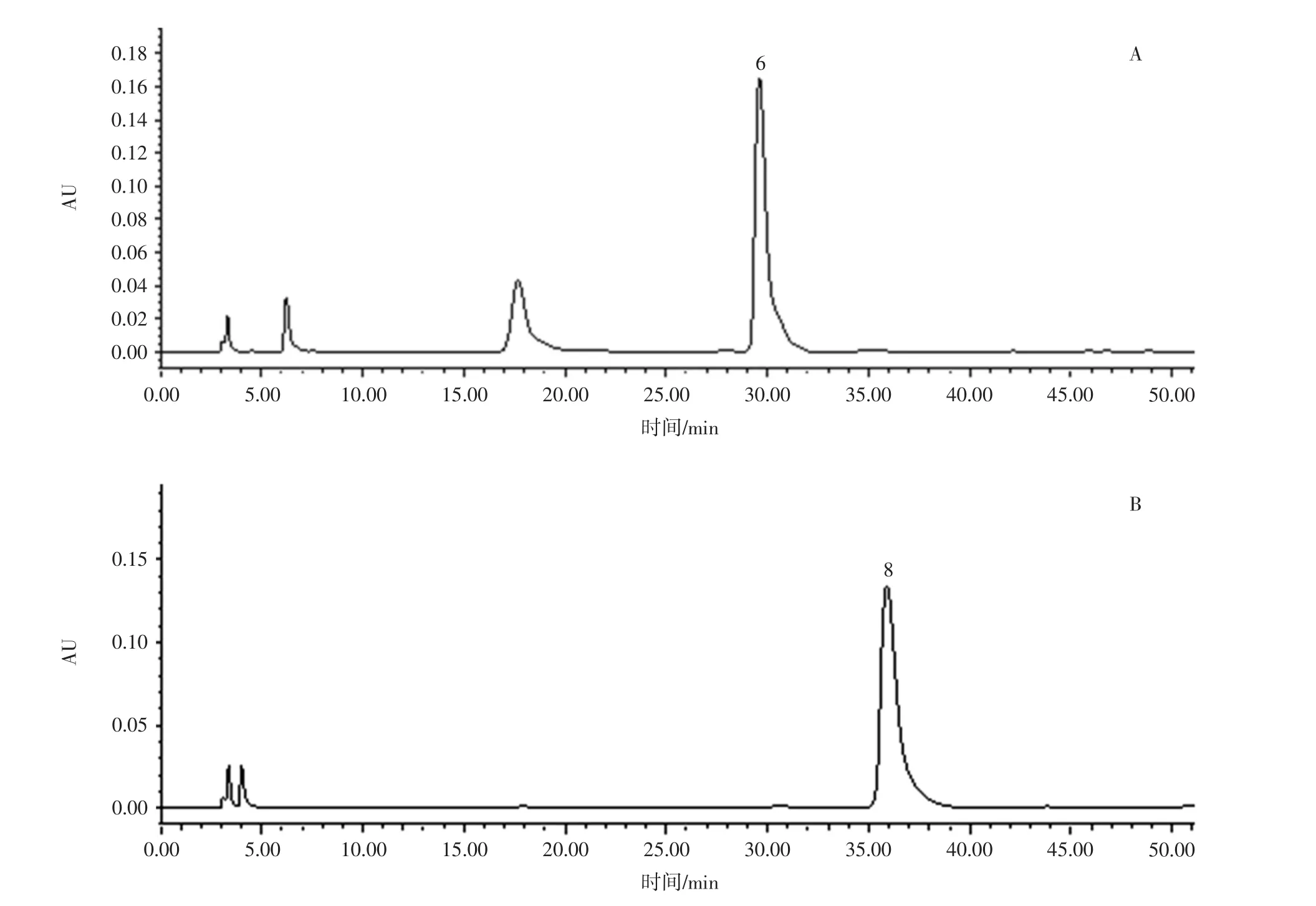

图1 HPLC色谱图Fig.1 HPLC chromatogram
2.2.6 重复性试验
精密称取地黄花样品粉末(S3)约1 g,按“2.2.2”及“2.2.3”项下的方法制备供试品溶液6份,按“2.2.4”项下色谱条件测定,记录色谱图,以8号D-葡萄糖的色谱峰为参照峰(S),计算得到各共有峰相对保留时间RSD<0.43%,相对峰面积RSD<4.01%,表明方法重复性好。
2.2.7 稳定性试验
精密称取地黄花样品粉末(S3)约1 g,按“2.2.2”及“2.2.3”项下的方法制备供试品溶液,分别在 0、2、6、8、12、24 h 按“2.2.4”项下色谱条件测定,记录色谱图,以8号D-葡萄糖的色谱峰为参照峰(S),计算得到各共有峰相对保留时间RSD<0.27%,相对峰面积RSD<3.04%,表明供试品溶液在24 h内稳定性良好。
2.2.8 指纹图谱的建立及相似度评价
取9批地黄花样品,按“2.2.2”项下的方法制备供试品溶液,按“2.2.4”项下色谱条件进行测定,记录色谱图,采用“中药色谱指纹图谱相似度评价系统(2012版)”,以S1作为参照图谱,选择平均数法,时间窗宽度为0.5min,进行多点校正及全谱峰匹配,生成9批地黄花样品的叠加图及共有模式图,见图3、图4,共标定了10个共有峰,通过与对照品比对分析,共指认了4个成分,分别为鼠李糖、D-葡萄糖、D-半乳糖、阿拉伯糖。

图2 9批地黄花样品(S1~S9)的HPLC叠加图谱Fig.2 HPLC overlay chromatogram of 9 Rehmannia glutionsa flower(S1-S9)
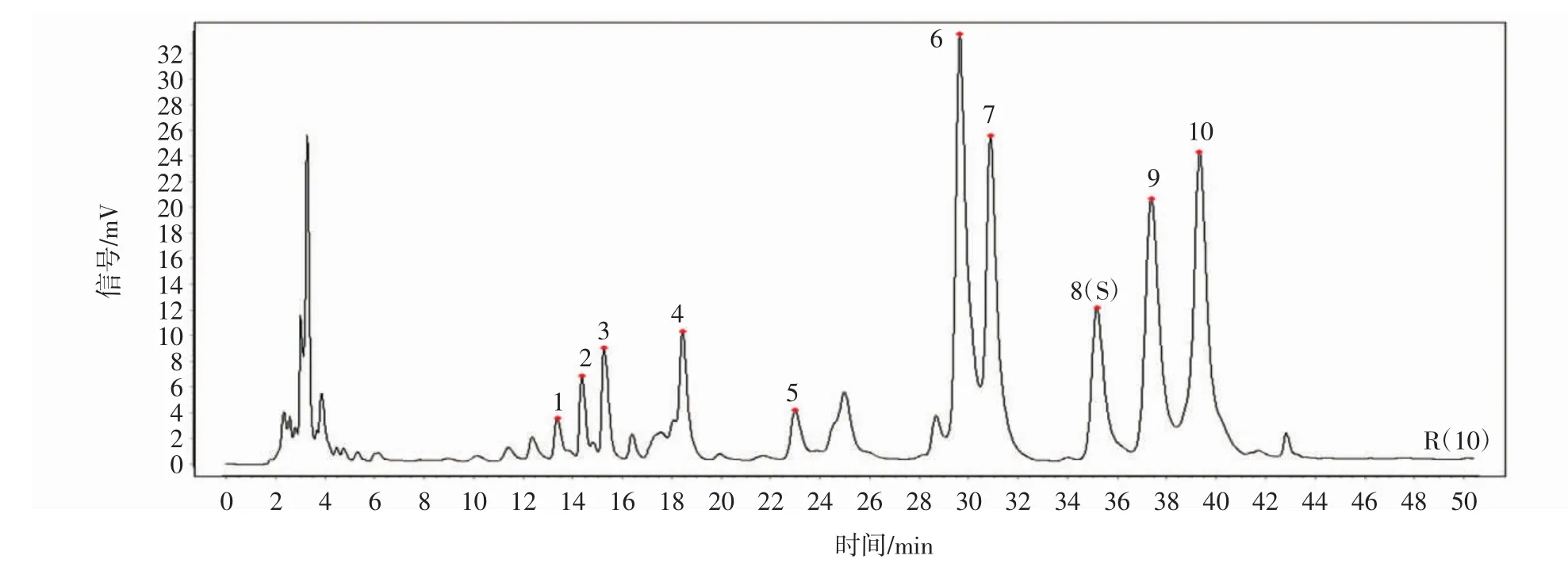
图3 对照指纹图谱(R)Fig.3 The fingerprint reference substance(R)
利用“中药色谱指纹图谱相似度评价系统(2012版)”对9批地黄花样品进行相似度评价,相似度均在0.95以上,说明地黄花不同部位多糖含量虽然不同,但组成多糖的结构相同。结果详见表3。
3 结论与讨论
地黄作为常用大宗中药材,《中国药典》规定入药部位为地黄块根,目前的研究也主要集中在以块根为来源的生地黄的品质评价[14]和炮制研究[15]及不同炮制工艺对饮片化学成分[16-17]、质量控制[17]和药理作用上[18],地黄多糖是地黄发挥药效作用的重要活性成分之一[19],药理试验表明地黄多糖具有抗肿瘤[20]、增强免疫力[21]、促进造血[22]、降血糖[23]、抗氧化[24-26]、抗焦虑[27]、诱导骨髓间充质干细胞向神经元细胞分化等作用[28-30],地黄多糖还可以进一步开发为脂质体[31]和纳米疫苗的佐剂辅助发挥药物的免疫作用[32-33]。本试验中对不同开花时期地黄花及盛花期不同花部位多糖含量研究结果表明,不同开花时期地黄花及盛花期不同部位中多糖含量虽具有一定的差异性,地黄花中多糖含量在花蕾初期和花蕾后期含量相对较高,而后随花的开放而逐渐减少,总体地黄花花蕾期平均多糖含量在3.98%~4.93%,明显高于盛花期3.65%~3.78%;地黄花盛花期不同部位多糖含量具有较大的差异性,多糖含量在2.93%~4.05%,其中花筒上部平均多糖含量最高,花裂片其次,花筒下部多糖含量最少,因此若以地黄花为原料进行产品开发,可考虑将花蕾后期作为地黄花的最佳采收期。
多糖所具有的药理活性往往与其单糖组成密切相关,单糖的组成分析是研究多糖结构、性质及构效关系的重要内容。本试验采用柱前衍生化HPLC指纹图谱对不同开花时期地黄花及盛花期不同花部位多糖单糖组成进行了研究,结果表明:不同时期地黄花及花朵盛期不同部位的多糖中单糖组成相似,均含有鼠李糖、D-葡萄糖、D-半乳糖和阿拉伯糖,这与张艳萍等的研究[34]中生地黄多糖SRPⅠ的单糖组成相一致。地黄花多糖由鼠李糖、阿拉伯糖、葡萄糖和半乳糖等单糖组成,其质量分数分别为6.11%、66.46%、3.93%和21.50%。
本课题组曾对地黄花不同部位梓醇等有效成分进行比较分析[11],结果表明,地黄花不同部位梓醇等有效成分含量虽存在很大差异,但其含量均较高。地黄作为临床常用大宗中药,主产于河南、山西、山东、河北等地,种植区域广泛,而在临床应用时采用的只有其块根,其余部分一般作为废弃物而丢弃不用,很少对非药用部位进行更多的研究以充分地综合利用中药的资源,近年来随着地黄的市场需求量不断增加以及由于地黄的连作障碍和土地资源有限等原因导致地黄资源相对紧缺,地黄叶的开发利用开始逐渐被研究者所关注[7-10],而地黄花同样作为植株的重要组成部分,在花期具有较大的生物量,地黄多糖、环烯醚萜苷及苯乙醇苷类成分作为地黄重要的有效成分[19],在地黄花中的含量同样较高,加上地黄花多糖具有一定的抗衰老作用,因此本研究认为对地黄的非药用部位——地黄花的药用和食用相关领域进行开发,不仅可以提高中药资源的利用度及种植的附加值,同时也可带来广阔的社会效益和经济效益。