N-乙酰半胱氨酸雾化吸入治疗急性鼻窦炎的临床疗效
2020-12-18李树华赵小龙邓伟蒋振华
李树华,赵小龙,邓伟△,蒋振华
急性鼻窦炎是鼻窦黏膜的急性化脓性炎症,是耳鼻咽喉科常见疾病,主要表现为持续性流脓涕、鼻塞、嗅觉下降、头昏痛等症状,严重者可出现眶内感染、视神经炎、失明、颅内感染等严重并发症[1]。传统祛痰治疗途径是经口给药,胃肠道吸收经血液循环分布于组织器官,最终达到稀化鼻腔和鼻窦分泌物、改善鼻黏膜纤毛活性,促进黏液排出、恢复鼻腔鼻窦生理功能的效果[2]。N-乙酰半胱氨酸(NAcety-L-lcysteine,NAC)雾化治疗已经被广泛应用于下呼吸道疾病的祛痰治疗,并证实其祛痰效果佳、安全性好。目前有关NAC 雾化治疗急性鼻窦炎的研究报道尚少见。NAC 通过雾化吸入给药,可以直接作用于鼻腔、鼻窦的黏膜及分泌物,提高局部组织对药物的生物利用度,发挥强效祛痰等作用。本研究通过观察用NAC 雾化吸入治疗急性鼻窦炎的效果,并分析其对机体炎性因子和免疫因子的影响,为急性鼻窦炎的临床治疗寻求一种更为安全、有效的祛痰药物和给药途径。
1 资料与方法
1.1 一般资料 选择2019 年1—12 月于绵阳市中心医院耳鼻咽喉就诊的急性鼻窦炎患者164例,其中男85例,女79例;年龄10~65 岁,平均(35.50±17.32)岁。排除标准:年龄<10岁;病程>12 周;就诊前接受过抗菌、抗炎治疗;对NAC 过敏;有过鼻部手术;合并鼻息肉或者鼻腔肿瘤;患者或家属不愿行相关检查;存在哮喘、呼吸困难、眶内感染、颅内感染等严重合并症。所有患者均同意治疗方案并签署知情同意书。采用随机数字表法将其分为试验组和对照组,每组82例。2组患者性别、年龄、吸烟、饮酒及合并糖尿病比较差异均无统计学意义,见表1。

Tab.1 Comparison of basic characteristics between the two groups表1 2组患者一般资料比较
1.2 治疗方法 2组患者均给予常规治疗方案:头孢呋辛酯片(0.25 g/次,每日2次,口服)+曲安奈德鼻喷雾剂(每侧鼻孔2揿/次,每日2次,喷鼻)+生理盐水鼻喷雾剂(每侧鼻孔2揿/次,每日6次,喷鼻);给药1周。在常规治疗的基础上,试验组联合用NAC注射剂(3 mL∶0.3 g)雾化吸入治疗,对照组联合生理盐水3 mL雾化吸入治疗,每次1支,每日2次。
1.3 主要试剂与仪器 人肿瘤坏死因子(tumor necrosis factor,TNF)-α 检测试剂盒(上海佰晔生物科技中心),人白细胞介素(interleukin,IL)-6/8/10检测试剂盒(上海恒远生物科技有效公司),采用化学发光标记免疫分析仪(型号:A2000,郑州安图生物工程股份有限公司)进行检测。人免疫球蛋白IgG/A/M 定量测定试剂盒(上海科华生物工程股份有限公司),采用西门子BNⅡ特定蛋白分析仪(型号:MCH.CLCI-005,德国西门子医学诊断产品有限公司)进行检测。
1.4 测量指标
1.4.1 标本采集 在治疗初及治疗1周时,清晨空腹采集患者肘静脉血,温室下静置10 min 后,以3 000 r/min 离心10 min,分离、提取血清,于-80 ℃保存,待检测炎性因子和免疫因子备用,注意避免反复冻融。
1.4.2 炎性因子检测 冷冻样本缓慢恢复至室温,轻柔混匀。采用化学发光标记免疫分析法,检测用发光物质吖啶酯类标记的TNF-α、IL-6、IL-8、IL-10,检测过程严格按照试剂盒说明书进行。
1.4.3 免疫因子检测 取制备好的血清标本,于37 ℃混匀,孵育5 min,采用免疫速率散射比浊法检测IgG、IgA、IgM,检测过程严格按照试剂盒说明书进行。
1.4.4 病情评估 采用视觉模拟量表评分(visual analogue scale,VAS)[2]评估患者病情严重程度,评价内容包括脓涕、鼻塞、嗅觉下降、头面部胀痛等方面,得分越高则病情越重,其中0~3分为轻度,4~7分为中度,8~10分为重度。
1.4.5 鼻内镜检查 依据鼻内镜检查结果,采用Lund-Kennedy 评分系统[2]对“水肿”、“鼻漏”进行评价。(1)水肿:0分=无,1分=轻度,2分=严重;(2)鼻漏:0分=无,1分=清亮、稀薄鼻漏,2分=黏稠、脓性鼻漏;每侧0~4分,总分0~8分。
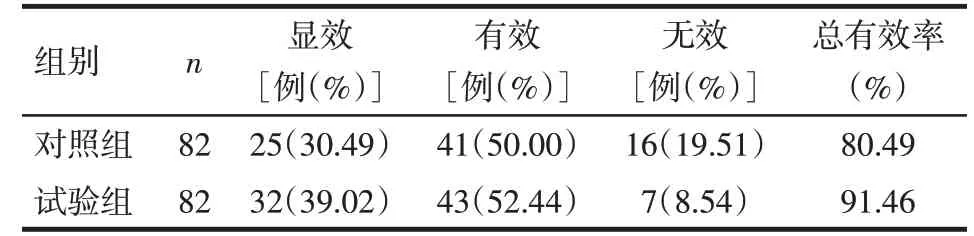
1.4.6 疗效评估 参照文献[3-4]进行疗效评估。显效:临床症状基本消失,鼻窦无明显压痛,鼻腔内未见明显脓性分泌物;有效:临床症状缓解,鼻窦压痛减轻,鼻腔内可见少量脓性分泌物;无效:临床症状仍存在,鼻窦压痛无减轻,鼻腔内可见较多脓性分泌物。总有效率=(显效+有效)/总例数×100%。
1.5 统计学方法 采用SPSS 22.0 软件进行数据分析,计数资料组间比较采用χ2检验;符合正态分布计量资料以均数±标准差(±s)表示,2组间比较采用独立样本t检验,治疗前后比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者治疗前后炎性因子水平的比较 治疗前,2 组患者TNF-α、IL-6、IL-8、IL-10 水平差异均无统计学意义;治疗后,2组患者TNF-α、IL-6、IL-8、IL-10水平较治疗前明显降低,且试验组均低于对照组,差异有统计学意义,见表2。
Tab.2 Comparison of inflammatory factors before and after treatment between the two groups of patients表2 2组患者治疗前后炎性因子水平的比较(n=82,±s)

Tab.2 Comparison of inflammatory factors before and after treatment between the two groups of patients表2 2组患者治疗前后炎性因子水平的比较(n=82,±s)
*P<0.05;表3、4同
组别对照组试验组t TNF-α(μg/L)治疗前3.87±0.72 3.95±0.78 0.782治疗后2.02±0.31 1.12±0.15 3.375*t t 3.732*5.216*IL-6(ng/L)治疗前13.87±3.75 14.26±3.64 1.241治疗后6.39±1.88 4.87±3.75 2.976*16.725*23.271*组别对照组试验组t IL-8(ng/L)治疗前4.63±0.72 4.54±0.64 0.694治疗后2.24±0.83 1.23±0.45 2.551*t t 4.583*8.641*IL-10(ng/L)治疗前23.41±3.58 24.53±3.12 1.078治疗后20.03±4.24 15.62±2.47 6.572*7.365*11.372*
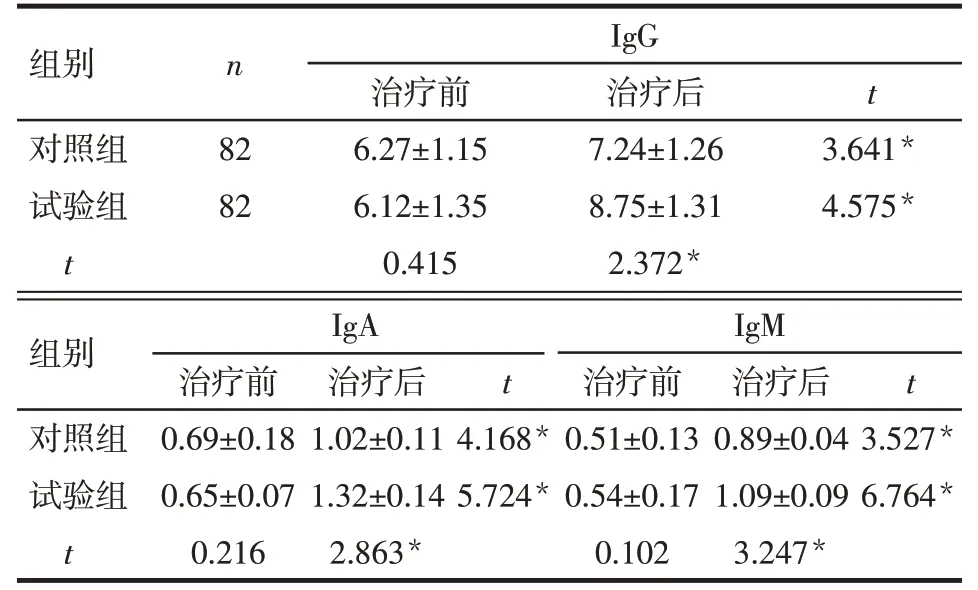
2.2 2组患者治疗前后免疫因子水平的比较 治疗前,2 组患者IgG、IgA、IgM 水平差异均无统计学意义;治疗后,2 组患者IgG、IgA、IgM 水平较治疗前升高,且试验组均高于对照组,差异均有统计学意义,见表3。
Tab.3 Comparison of immune factors before and after treatment between the two groups表3 2组患者治疗前后免疫因子水平的比较(g/L,±s)
Tab.3 Comparison of immune factors before and after treatment between the two groups表3 2组患者治疗前后免疫因子水平的比较(g/L,±s)
组别对照组试验组t n IgG t 82 82治疗前6.27±1.15 6.12±1.35 0.415治疗后7.24±1.26 8.75±1.31 2.372*3.641*4.575*组别对照组试验组t IgA IgM治疗前0.69±0.18 0.65±0.07 0.216治疗后1.02±0.11 1.32±0.14 2.863*t t 4.168*5.724*治疗前0.51±0.13 0.54±0.17 0.102治疗后0.89±0.04 1.09±0.09 3.247*3.527*6.764*
2.3 2 组患者治疗前后VAS、Lund-Kennedy 评分的比较 治疗前,2 组患者VAS 和Lund-Kennedy 评分差异均无统计学意义;治疗后,2 组VAS 和Lund-Kennedy 评分较治疗前明显降低,且试验组均低于对照组,差异均有统计学意义,见表4。
Tab.4 Comparison of VAS and Lund-Kennedy scores before and after treatment between the two groups表4 2组患者治疗前后VAS、Lund-Kennedy评分的比较(分,±s)

Tab.4 Comparison of VAS and Lund-Kennedy scores before and after treatment between the two groups表4 2组患者治疗前后VAS、Lund-Kennedy评分的比较(分,±s)
组别对照组试验组t n 脓涕(VAS)治疗前7.56±1.35 7.85±1.63 0.536治疗后3.75±1.23 3.25±1.32 4.723*t 82 82 8.725*10.372*组别对照组试验组t鼻塞(VAS)治疗前7.87±1.03 7.79±2.51 0.329治疗后3.54±1.52 3.12±1.63 5.271*t t 9.305*11.336*嗅觉下降(VAS)治疗前7.51±1.67 7.62±1.72 0.473治疗后3.23±1.22 2.85±1.71 4.572*11.334*15.276*组别对照组试验组t头面部胀痛(VAS)治疗前7.42±1.41 7.35±2.21 0.741治疗后3.34±1.08 3.02±1.16 3.575*t t 8.792*11.205*Lund-Kennedy评分治疗前7.11±2.12 6.89±1.42 1.023治疗后3.07±1.25 2.75±1.33 2.794*8.247*8.723*
2.4 2组患者临床疗效的比较 试验组治疗总有效率明显高于对照组,差异有统计学意义,见表5。治疗期间所有患者均未出现恶心、呕吐、皮疹、瘙痒等不良反应,且无眶内感染、视神经炎、失明、颅内感染等并发症发生。
Tab.5 Comparison of the clinical efficacy between the two groups of patients表5 2组患者临床疗效的比较
3 讨论
3.1 NAC 与炎性因子和免疫因子 NAC 具有良好的祛痰效果,其主要作用机制是通过活性基团巯基(-SH)断裂黏液蛋白的二硫键,溶解黏液蛋白,降低痰液黏滞性,达到祛痰目的[5-7]。研究发现,NAC 还具有调节细胞代谢活性、抗炎、抑制细菌和病毒、调节免疫等作用,目前已被应用于全身多个器官疾病的治疗[8-11]。本研究通过NAC 雾化治疗急性鼻窦炎,分析治疗前后主要炎性因子和免疫因子的变化,结果显示,2组患者治疗后TNF-α、IL-6、IL-8、IL-10水平较治疗前明显降低,且试验组均低于对照组;治疗后IgG、IgA、IgM 水平较治疗前升高,且试验组均高于对照组;提示NAC可以降低机体主要炎性因子水平,并提高机体免疫球蛋白含量,NAC在治疗急性鼻窦炎过程中亦具有抗炎、免疫调节的作用。
3.2 NAC 与急性鼻窦炎 急性鼻窦炎主要是由细菌和(或)病毒等感染引起的急性鼻窦炎症疾病,其主要以鼻部炎症为主,也可伴有全身症状[12-14]。其发病机制主要由于细菌和(或)病毒感染机体后,出现局部血管扩张、腺体分泌旺盛、纤毛运动障碍、炎性因子浸润、免疫功能障碍等[1]。急性鼻窦炎的治疗主要以全身用药联合鼻喷激素治疗为主[15]。本研究创新之处在于采用NAC 局部雾化治疗代替了传统口服黏液促排剂,避免了全身给药带来的不良反应和患者的心理负担。本研究结果显示,2 组患者治疗后VAS 和Lund-Kennedy 评分较治疗前明显降低,且试验组均低于对照组;另外,试验组治疗总有效率明显高于对照组;提示NAC雾化治疗能明显提高急性鼻窦炎的疗效,其作用机制可能与NAC具有祛痰、辅助抗炎及调节免疫等作用有关。
3.3 雾化治疗与急性鼻窦炎 雾化吸入的给药方式是相当于靶向给药,较全身用药相比,具有起效快、局部药物浓度高、用药量少、全身不良反应少等优点,是呼吸道疾病重要的给药方式[16-17]。本研究采用雾化给药代替了传统口服给药方式治疗急性鼻窦炎,通过对耐受性和安全性的观察,治疗期间所有患者均未出现恶心、呕吐、皮疹、瘙痒等不良反应,且无眶内感染、视神经炎、失明、颅内感染等并发症发生,提示采用NAC雾化给药途径治疗急性鼻窦炎安全有效,值得临床推广应用。
