LncRNA-MALAT1通过miR-142-3p/TEAD1分子轴调控结直肠癌细胞增殖与凋亡
2020-12-18张智成杨清泉
张智成,杨清泉
结直肠癌(colorectal cancer,CRC)是世界第三大最常见的恶性肿瘤[1]。每年全球约有90 万人死于CRC[2]。在我国,由于生活方式和饮食习惯的改变,CRC 已成为迅速增加的恶性肿瘤之一[3]。目前,尽管通过外科手术结合辅助化疗、靶向药物等手段提高了CRC 患者生存率,但控制肿瘤局部复发和转移仍是难题。长链非编码RNA(long noncoding RNA,LncRNA)是一类新型的非编码RNA,长度超过200个核苷酸,在基因表达调控中起着至关重要的作用[4]。作为LncRNA 家族成员之一,LncRNA-肺腺癌转移相关转录子1(MALAT1)在结直肠癌、食管癌等多种胃肠道肿瘤组织和细胞中高表达,具有重要的调控作用。LncRNA 分子内富含微小RNA(miRNA)结合位点,可以作为竞争性内源性RNA(ceRNA),在细胞中起到分子海绵的作用,介导肿瘤进展,使得LncRNA-miRNA-mRNA 调控网络有望成为CRC 诊断与治疗的分子靶点[5]。本研究通过检测人正常结肠上皮细胞与CRC 细胞株中LncRNA-MALAT1、miR-142-3p 与TEA 结构域转录因子1(TEA domain transcription factor 1,TEAD1)的表达水平,探讨LncRNA-MALAT1能否通过与miR-142-4p结合,进而影响其潜在靶基因TEAD1蛋白水平的表达,调控CRC细胞的增殖与凋亡,影响CRC的病理进程。
1 材料与方法
1.1 主要试剂及仪器 结直肠癌细胞株HCT116 细胞、SW480 细胞、DLD-1 细胞、Caco-2 细胞以及McCoy′s 5A 培养基购自武汉普诺赛生命科技有限公司,人正常结肠上皮细胞FHC细胞购自上海青旗生物技术发展有限公司,RPMI-1640培养基、MEM 培养基与DMEM 培养基购自美国Gibco 公司,胎牛血清购自杭州四季青生物工程材料有限公司,CCK-8细胞增殖及细胞毒性检测试剂盒、细胞凋亡检测试剂盒购自沈阳万类生物科技有限公司,荧光素酶检测试剂盒购自南京凯基生物科技发展有限公司,Bax 兔多克隆抗体、Bcl-2 兔多克隆抗体、β-actin 兔多克隆抗体、HRP 标记山羊抗兔IgG 购自沈阳万类生物科技有限公司,CyclinD1兔单克隆抗体购自武汉爱博泰克生物科技有限公司,TEAD1兔多克隆抗体购自中国Affinity Biosciences 公司,TRIpure 购自北京百泰克生物技术有限公司,SYBR Green I 购自北京索莱宝科技有限公司,
si-MALAT1 及阴性对照si-NC 片段、miR-142-3p mimic 及阴性对照NC mimic 片段、miR-142-3p inhibitor 及阴性对照NC inhibitor 片段购自武汉金拓思生物科技有限公司,MALAT1-wtUTR、 MALAT1-mutUTR、 TEAD1-wtUTR 与 TEAD1-mutUTR载体购自南京金斯瑞生物科技有限公司。荧光定量PCR 仪购自韩国BIONEER 公司,多功能酶标仪购自瑞士TECAN 公司,流式细胞仪购自美国艾森生物公司,倒置相差显微镜购自日本OLYMPUS 公司,电泳仪购自北京六一生物科技有限公司。
1.2 细胞培养 HCT116 细胞使用含10% 胎牛血清的McCoy′s 5A培养基,SW480细胞与DLD-1细胞使用含10%胎牛血清的RPMI-1640 培养基,Caco-2 细胞使用含10%胎牛血清的MEM 培养基,FHC 细胞使用含10%胎牛血清的DMEM 培养基,所有细胞均置于37 ℃、5% CO2条件下常规培养。
1.3 细胞转染与实验分组 选取对数生长期结直肠癌细胞株HCT116 细胞、SW480 细胞、DLD-1 细胞与Caco-2 细胞以及人正常结肠上皮细胞FHC细胞,设置为HCT116组、SW480组、DLD-1组、FHC 组与Caco-2组;选取对数生长期HCT116细胞,分别使用si-NC 片段、si-MALAT1片段、si-MALAT1片段+NC inhibitor 或si-MALAT1 片段+miR-142-3p inhibitor 共转染HCT116 细胞,另设置不进行转染仅进行常规培养的HCT116 细胞组别,即si-NC 组、si-MALAT1 组、si-MALAT1+NC inhibitor 组、si-MALAT1+miR-142-3p inhibitor 组 与Control组。
1.4 Real-time PCR 检测LncRNA-MALAT1与miR-142-3p基因的表达 通过TRIpure提取各组细胞总RNA,将1 μg RNA加入至20 μL 混合反应体系中反转录至cDNA,采用ExicyclerTM96 荧光定量PCR 仪进行Real-time PCR 检测与分析。引物序列见表1。PCR 反应体系20 μL:cDNA 模板1 μL,上下游 引物(10 μmol/L)各0.5 μL,SYBR GREEN mastermix 10 μL,ddH2O 8 μL。LncRNA-MALAT1基因检测反应条件:94 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,40 个循环;miR-142-3p基因检测反应条件:94 ℃变性15 s,60 ℃退火15 s,72 ℃延伸15 s,40 个循环。miR-142-3p基因检测以U6基因作为内参,LncRNA-MALAT1基因检测以β-actin基因作为内参,采用2-ΔΔCt方法计算目标基因的相对表达水平。
1.5 Western blot检测TEAD1、Bax、Bcl-2与Cyclin D1蛋白的表达 提取各组细胞总蛋白,BCA法测定蛋白浓度,取40 μg蛋白上样,采用12%或15%分离胶,5%浓缩胶进行聚丙烯酰胺凝胶电泳,湿法转移至PVDF 膜,5%脱脂奶粉封闭,一抗TEAD1 抗 体(1∶1 000)、Bax 抗 体(1∶500)、Bcl-2 抗 体(1∶500)、Cyclin D1抗体(1∶1 000)和β-actin抗体(1∶1 000),4 ℃孵育过夜,TBST 洗涤后加入二抗羊抗兔IgG-HRP(1∶5 000),37 ℃孵育45 min,ECL 法检测。用凝胶图像处理系统(Gel-Pro-Analyzer 软件)分析目标条带的光密度(OD)值。

Tab.1 Real-time PCR primer sequences表1 Real-time PCR引物序列
1.6 CCK-8实验检测细胞增殖 选取对数生长期结直肠癌细胞株HCT116细胞,以3×103个/孔密度接种至96孔板,待细胞贴壁后,按1.3分组转染各组细胞,各转染组细胞转染处理0、24、48、72 h 后,上述HCT116 细胞每孔更换为100 μL 培养基和10 μL CCK-8 试剂,继续培养2 h,使用酶标仪测定450 nm波长下的OD值。
1.7 流式细胞术检测细胞凋亡 选取对数生长期HCT116细胞,以4×105个/孔密度接种至6 孔板,待细胞贴壁后,各转染组设置同1.3 组。各转染组细胞转染处理48 h 后,同步收集上述各组细胞,加入195 μL Annexin V-FITC 结合液,轻轻重悬细胞,随后加入5 μL Annexin V-FITC,10 μL Propidium Iodide,混匀后室温避光孵育10~20 min,流式细胞仪分析凋亡率。
1.8 双荧光素酶报告基因实验验证miR-142-3p 与TEAD1的结合 选取对数生长期HCT116细胞,待细胞贴壁后,分别使 用1.5 μg MALAT1-wtUTR 质 粒(野 生 型)、1.5 μg MALAT1-mutUTR 质粒(突变型)与25 pmol NC mimic 或25 pmol miR-142-3p mimic 片 段 共 转 染HCT116 细 胞,即MALAT1-wtUTR+NC mimic 组、MALAT1-mutUTR+NC mimic组、MALAT1-wtUTR+miR-142-3p mimic 组 与MALAT1-mutUTR+miR-142-3p mimic 组;分别使用TEAD1-wtUTR 质粒(野生型)或TEAD1-mutUTR 质粒(突变型)与NC mimic 或miR-142-3p mimic 片段共转染HCT116 细胞,即TEAD1-wtUTR+NC mimic 组、TEAD1-mutUTR+NC mimic 组、TEAD1-wtUTR+miR-142-3p mimic 组与TEAD1-mutUTR+miR-142-3p mimic组。上述各组细胞转染48 h后,使用荧光素酶活性检测试剂盒,根据其说明检测细胞相对荧光素酶活性。
1.9 统计学方法 使用Graphpad prism 8.0进行实验数据的统计与分析。实验数据以均数±标准差(±s)表示,所有实验重复3 次。多组间比较采用单因素方差分析,并通过Tukey法进行校正;组间多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 人正常结肠上皮细胞与结直肠癌细胞中LncRNA-MALAT1、miR-142-3p基因与TEAD1 蛋白的表达变化 与人正常结肠上皮细胞FHC 细胞相比,结直肠癌细胞株(SW480、DLD-1、HCT116 与Caco-2 细胞)中LncRNA-MALAT1基因、TEAD1 蛋白相对表达量显著升高(P<0.05),miR-142-3p基因相对表达量显著降低(P<0.05)。结直肠癌细胞株中HCT116 细胞LncRNA-MALAT1表达量相对较高,故用于后续实验检测。见图1、表2。
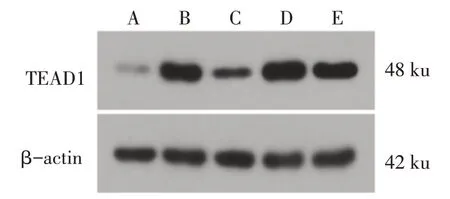
Fig.1 The expression of TEAD1 in human normal colon epithelial cells and colorectal cancer cell lines图1 人正常结肠上皮细胞与结直肠癌细胞TEAD1表达
Tab.2 The expression levels of LncRNA-MALAT1,miR-142-3p and TEAD1 in human normal colon epithelial cells and colorectal cancer cell lines表2 人正常结肠上皮细胞与结直肠癌细胞LncRNAMALAT1、miR-142-3p基因与TEAD1蛋白表达水平(n=3,±s)

Tab.2 The expression levels of LncRNA-MALAT1,miR-142-3p and TEAD1 in human normal colon epithelial cells and colorectal cancer cell lines表2 人正常结肠上皮细胞与结直肠癌细胞LncRNAMALAT1、miR-142-3p基因与TEAD1蛋白表达水平(n=3,±s)
**P<0.01;a与FHC组比较,P<0.05
组别FHC组SW480组DLD-1组HCT116组Caco-2组F LncRNA-MALAT1 1.00±0.03 2.61±0.25a 1.72±0.05a 3.56±0.29a 2.65±0.24a 71.150**miR-142-3p 1.00±0.04 0.30±0.02a 0.56±0.04a 0.25±0.02a 0.40±0.03a 277.700**TEAD1 1.00±0.09 4.10±0.33a 2.05±0.21a 5.06±0.36a 4.33±0.32a 110.900**
2.2LncRNA-MALAT1对TEAD1、Cyclin D1、Bcl-2与Bax 蛋白表达的影响 与si-NC 组细胞相比,si-MALAT1 组细胞Bax 蛋白的相对表达量显著升高,TEAD1 蛋白、Bcl-2 蛋白与Cyclin D1 蛋白的相对表达量显著下降(P<0.05),见图2、表3。
2.3LncRNA-MALAT1通过miR-142-3p调控下游蛋白以及细胞增殖与凋亡 Control 组、si-NC 组、si-MALAT1 组、si-MALAT1+NC inhibitor 组、si-MALAT1+miR-142- 3p inhibitor 组凋亡率分别为(4.15±0.05)% 、(4.29±0.06)% 、(15.38±0.29)% 、(14.22±0.72)% 和(5.85±0.43)%(n=3,F=582.400,P<0.01)。与si-NC 组细胞相比,si-MALAT1 组细胞miR-142-3p基因、Bax 蛋白相对表达量与细胞凋亡率显著上升(P<0.05),LncRNA-MALAT1基因、TEAD1 蛋白、Bcl-2 蛋白、Cyclin D1 蛋白相对表达量,48、72 h细胞增殖水平显著下降(P<0.05);与si-MALAT1+NC inhibitor 组细胞相比,si-MALAT1+miR-142-3p inhibitor 组细胞miR-142-3p基因、Bax蛋白相对表达量与细胞凋亡率显著降低(P<0.05),LncRNA-MALAT1基 因、TEAD1 蛋 白、Bcl-2 蛋白、Cyclin D1蛋白相对表达量,48、72 h细胞增殖水平显著升高(P<0.05)。见图3、4,表4、5。
2.4 LncRNA-MALAT1 与miR-142-3p 以及TEAD1与miR-142-3p 靶向结合验证 MALAT1-wtUTR+NC mimic 组、MALAT1-mutUTR+NC mimic 组、MALAT1-wtUTR+miR-142 -3p mimic 组、MALAT1-mutUTR+miR-142 -3p mimic 组相对荧光素酶活性分别为1.00±0.10、1.07±0.12、0.57±0.06和0.97±0.12,与MALAT1-wtUTR+NC mimic 组细胞相比,MALAT1-wtUTR+miR-142-3p mimic 组细胞相对荧光素酶活性显著下降(n=3,F=14.550,P<0.01);TEAD1-wtUTR+NC mimic 组、TEAD1-mutUTR+NC mimic 组、TEAD1-wtUTR+miR-142 -3p mimic 组和TEAD1-mutUTR+miR-142-3p mimic 组相对荧光素酶活性分别为1.00±0.11、0.95±0.14、0.55±0.06 和0.99±0.10,与TEAD1-wtUTR+NC mimic 组 细 胞 相比,TEAD1-wtUTR+miR-142-3p mimic 组细胞相对荧光素酶活性显著下降(n=3,F=12.070,P<0.01)。

Fig.2 The expressions of TEAD1,Cyclin D1,Bcl-2 and Bax in three groups of HCT116 cells图2 各组HCT116细胞TEAD1、Cyclin D1、Bcl-2与Bax表达
Tab.3 The expression levels of TEAD1,Cyclin D1,Bcl-2 and Bax in three groups of HCT116 cells表3 各组HCT116细胞TEAD1、Cyclin D1、Bcl-2与Bax表达水平(n=3,±s)

Tab.3 The expression levels of TEAD1,Cyclin D1,Bcl-2 and Bax in three groups of HCT116 cells表3 各组HCT116细胞TEAD1、Cyclin D1、Bcl-2与Bax表达水平(n=3,±s)
**P<0.01;a与si-NC组比较,P<0.05
组别Control组si-NC组si-MALAT1组F TEAD1 1.00±0.08 1.01±0.04 0.40±0.05a 116.400**Cyclin D1 1.00±0.00 0.98±0.03 0.56±0.00a 871.000**Bcl-2 1.00±0.02 0.99±0.02 0.39±0.01a 1 506.000**Bax 1.00±0.04 0.94±0.05 3.38±0.08a 1 805.000**

Fig.3 The expressions of TEAD1,Cyclin D1,Bcl-2 and Bax in four groups of HCT116 cells图3 各组HCT116细胞TEAD1、Cyclin D1、Bcl-2与Bax表达
3 讨论
LncRNA 是长度大于200 个核苷酸(nt)且不具有编码蛋白质功能的RNA分子[6]。作为LncRNA家族成员,LncRNA-MALAT1 首先被发现于早期非小细胞肺癌,与肿瘤转移显著相关[6]。研究发现,LncRNA-MALAT1 在多种肿瘤中高表达,能够作为肿瘤标志物,促进肿瘤的发生与发展。相关研究报道,在口腔鳞状细胞癌中,LncRNA-MALAT1能够通过竞争性结合miR-143-3p,促进miR-143-3p 靶基因黑色素瘤抗原家族成员A9(melanoma antigen family member A9,MAGEA9)的表达,促进口腔鳞状细胞癌细胞的增殖与迁移[7]。在卵巢癌中,LncRNA-MALAT1 能够通过活化Wnt/β-catenin 信号通路,提升卵巢癌细胞的生存与转移能力,促进卵巢癌的发生与发展[8]。有研究报道,LncRNAMALAT1 在CRC 组织中呈高表达,且对CRC 细胞具有重要的调控作用,促进CRC 的病理进程[9]。本研究显示,LncRNA-MALAT1能够促进CRC细胞增殖,并抑制CRC细胞凋亡,起到提升CRC细胞生存能力的调控作用,促进CRC 的发生与发展,这与LncRNA-MALAT1在肿瘤中调控作用的相关研究结果一致。
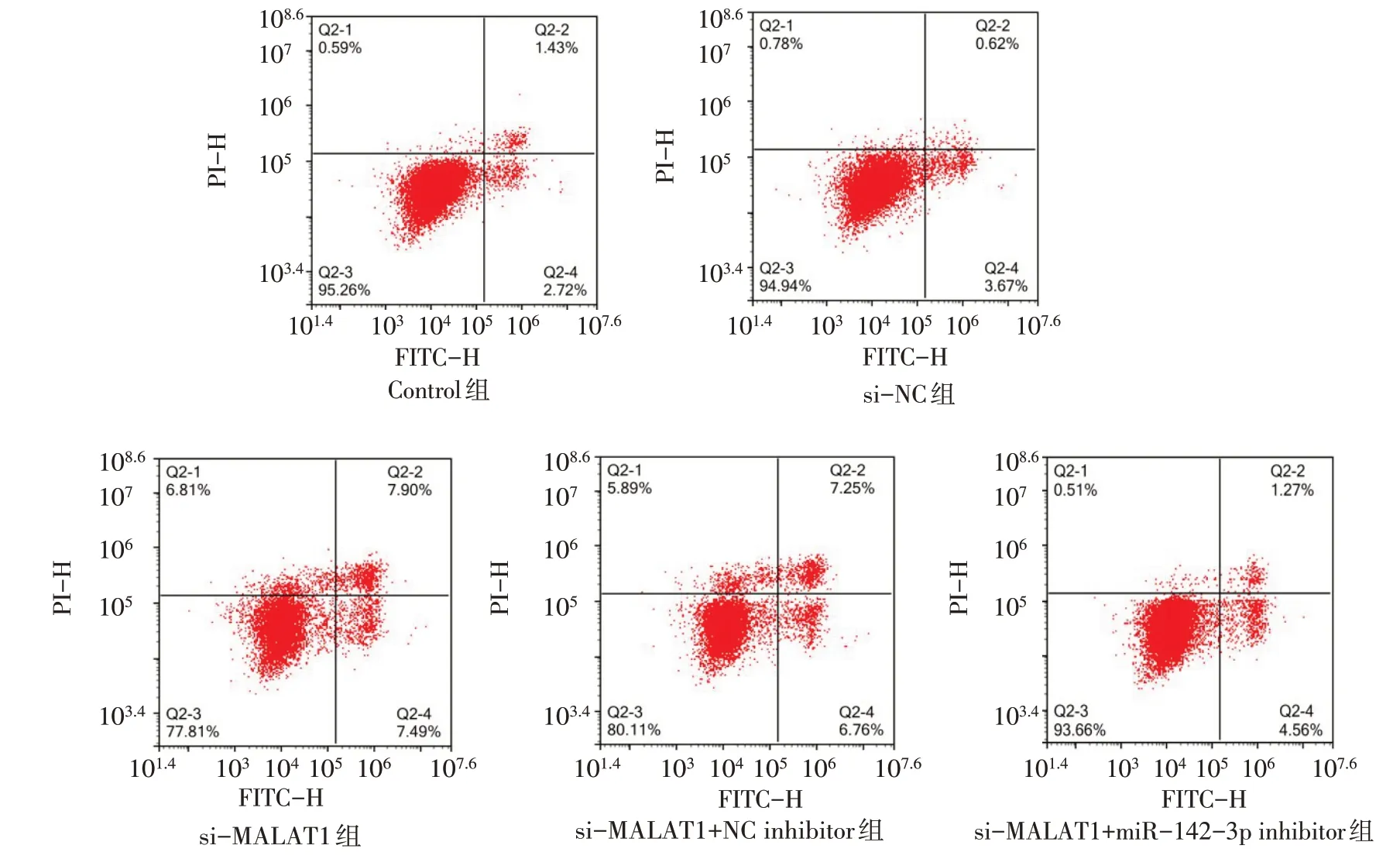
Fig.4 Comparison of apoptosis rates between four groups of HCT116 cells图4 各组HCT116细胞凋亡率比较
Tab.4 The expression levels of LncRNA-MALAT1 and miR-142-3p in four groups of HCT116 cells表4 各组HCT116 细胞LncRNA-MALAT1、miR-142-3p、TEAD1、Cyclin D1、Bcl-2与Bax表达水平(n=3,±s)

Tab.4 The expression levels of LncRNA-MALAT1 and miR-142-3p in four groups of HCT116 cells表4 各组HCT116 细胞LncRNA-MALAT1、miR-142-3p、TEAD1、Cyclin D1、Bcl-2与Bax表达水平(n=3,±s)
**P<0.01;a与si-NC 组比较,b与si-MALAT1+NC inhibitor 组比较,P<0.05
组别si-NC组si-MALAT1组si-MALAT1+NC inhibitor组si-MALAT1+miR-142-3p inhibitor组F LncRNAMALAT1 1.08±0.03 0.21±0.02a 0.20±0.02 0.82±0.07b miR-142-3p 1.01±0.08 4.35±0.14a 4.24±0.13a 1.18±0.04b TEAD1蛋白1.00±0.07 0.52±0.04a 0.51±0.06 0.74±0.06b 399.500**1 034.000**47.560**组别si-NC组si-MALAT1组si-MALAT1+NC inhibitor组si-MALAT1+miR-142-3p inhibitor组F Cyclin D1蛋白1.00±0.01 0.50±0.01a 0.52±0.01 0.79±0.03b Bcl-2蛋白1.00±0.02 0.39±0.01a 0.38±0.06 0.73±0.05b Bax蛋白1.00±0.05 3.57±0.12a 3.56±0.05 1.94±0.06b 801.700**161.800**908.800**
Tab.5 Comparison of proliferation ability between four groups of HCT116 cells表5 各组HCT116细胞增殖能力比较(n=3,OD值,±s)
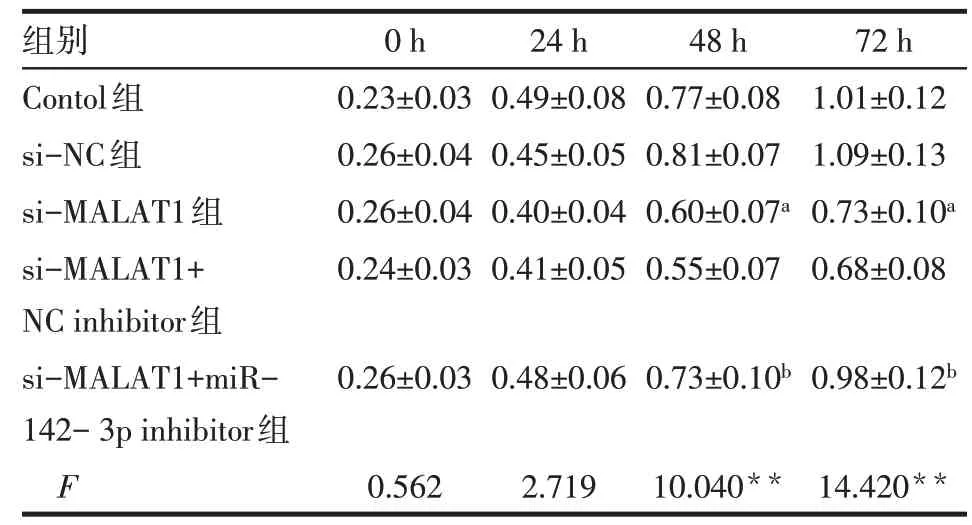
Tab.5 Comparison of proliferation ability between four groups of HCT116 cells表5 各组HCT116细胞增殖能力比较(n=3,OD值,±s)
**P<0.01;a与si-NC 组比较,b与si-MALAT1+NC inhibitor 组比较,P<0.05
组别Contol组si-NC组si-MALAT1组si-MALAT1+NC inhibitor组si-MALAT1+miR-142-3p inhibitor组F 0 h 0.23±0.03 0.26±0.04 0.26±0.04 0.24±0.03 24 h 0.49±0.08 0.45±0.05 0.40±0.04 0.41±0.05 48 h 0.77±0.08 0.81±0.07 0.60±0.07a 0.55±0.07 72 h 1.01±0.12 1.09±0.13 0.73±0.10a 0.68±0.08 0.26±0.03 0.48±0.06 0.73±0.10b 0.98±0.12b 0.562 2.719 10.040**14.420**
LncRNA 可作为miRNA 的分子海绵,通过吸附miRNA,削弱miRNA 对mRNA 的靶向调控作用[10]。miRNA是一类小的单链非编码RNA,能够在转录后水平调节多种原癌基因与抑癌基因的表达[11]。研究显示,作为miRNA 家族中的一员,miR-142-3p 在肿瘤疾病中能够发挥重要的调控作用。在胃癌中,miR-142-3p 能够靶向抑制细胞周期蛋白T2(CCNT2)的表达,抑制胃癌细胞的增殖、迁移与侵袭,抑制胃癌的病理进程[12];在乳腺癌中,miR-142-3p 能够被LncRNA-NNTAS1 吸附,导致E 盒结合锌指蛋白1(ZEB1)表达升高,进而提升乳腺癌细胞的生存与转移能力,促进乳腺癌的发生与发展[13];而在CRC 中,miR-142-3p 的下调提示CRC 的发生,且miR-142-3p可以作为肿瘤抑制因子,对抑制CRC发生与发展起到重要调控作用[14-15]。本研究显示,LncRNA-MALAT1 能够结合miR-142-3p,可以作为miR-142-3p 的分子海绵,通过吸附miR-142-3p,促进CRC 细胞增殖,并抑制CRC 细胞凋亡,调控CRC的病理进程,与既往研究结果相吻合。
miRNA 能够通过与靶mRNA 的3′非编码区(3′UTR)互补结合,在不影响靶mRNA 稳定性的情况下,阻遏靶mRNA的翻译进程,进而参与调控肿瘤的病理进程[11]。本研究结果显示,miR-142-3p 与TEAD1 存在靶向关系。TEAD1 是一种重要的转录增强因子,隶属于TEF 蛋白家族,可以与yes 相关蛋白(YAP)形成蛋白质复合物,并通过参与到Hippo信号通路,对细胞的生存能力具有重要的调控作用[16]。研究发现,在多种肿瘤中,TEAD1 均能够发挥重要的调控作用;在胶质母细胞瘤中,TEAD1呈高表达,能够作为原癌基因,促进胶质母细胞瘤的发生与发展[17]。在骨肉瘤中,抑制TEAD1表达能够抑制骨肉瘤细胞的生存能力与转移能力[18]。而在CRC 中,TEAD1 表达的升高能够引起CRC 细胞增殖水平的升高[19]。本研究显示,作为miR-142-3p的靶基因,当LncRNA-MALAT1吸附miR-142-3p后,TEAD1 表达水平显著升高,能够促进CRC 细胞增殖,抑制CRC细胞凋亡。
Cyclin D1 是一种细胞周期蛋白,能够与细胞周期蛋白依赖性激酶(CDK)4或CDK6在G1期结合形成复合物,再通过N末端LECXF 基序与成视网膜母细胞瘤蛋白(pRb)结合,使pRb的丝氨酸和酪氨酸残基磷酸化,释放出转录因子E2F,驱动细胞由G1 期进入S 期,促进细胞增殖,而当Cyclin D1 表达失控时,将引起细胞增殖周期失调,导致肿瘤发生[20]。Bcl-2 原癌基因与细胞凋亡密切相关。有研究显示Bcl-2可能通过抗氧化作用阻断Ca2+从内质网释放,影响线粒体释放细胞色素C 发挥抗凋亡的作用[21]。Bax 基因是Bcl-2 基因族内的同源基因,其编码的Bax 蛋白与Bcl-2 蛋白具有21%的同源性,然而Bax对细胞凋亡的调控作用与Bcl-2 截然相反。Bax 可能通过破坏线粒体渗透性转换、氧化磷酸化和腺苷三磷酸合成功能改变细胞氧化还原作用,激活凋亡信号caspase 信号转导途径,促进细胞凋亡进程[21]。Cyclin D1 与Bcl-2 蛋白表达的升高以及Bax 蛋白表达的降低能够促进CRC 的发生与发展,而抑制Cyclin D1 与Bcl-2 蛋白表达或促进Bax 蛋白的表达能够促进CRC 细胞凋亡,抑制CRC 细胞增殖,对CRC的病理进程起到一定的缓解作用[22]。本实验结果显示,抑制LncRNA-MALAT1基因表达能够抑制Cyclin D1 与Bcl-2 蛋白表达,促进Bax 蛋白的表达;而在此基础上进一步抑制miR-142-3p的表达,能够部分逆转抑制LncRNA-MALAT1基因表达所引起的Cyclin D1、Bcl-2 与Bax 蛋 白 表 达 的 变 化,表 明LncRNA-MALAT1能够通过miR-142-3p调控Cyclin D1、Bcl-2 与Bax 蛋白的表达,进而影响CRC 细胞的增殖与凋亡,对CRC起到一定的调节作用。
综上所述,LncRNA-MALAT1能够通过与miR-142-3p结合,促进miR-142-3p靶基因TEAD1 的表达,促进CRC 细胞增殖,抑制凋亡。本研究阐明了LncRNA-MALAT1/ miR-142-3p/TEAD1 分子轴在CRC 中的作用与调控机制,为LncRNA-MALT1 在CRC等肿瘤疾病中的作用与机制研究提供了理论基础。LncRNA-MALAT1/miR-142-3p/TEAD1 分子轴有望成为CRC 早期诊断和预后评估的分子标志物,针对LncRNA-MALAT1/miR-142-3p/TEAD1 分子轴的靶向治疗亦可能成为缓解CRC 等肿瘤的新手段。
