血清HMGB1水平对创伤性凝血病早期危重患者病情及预后的影响
2020-12-17唐丽群张兴钦童华生马明远
唐丽群,张兴钦,童华生,马明远*
1佛山市中医院重症医学科,广东佛山 528000;2解放军南部战区总医院重症医学科,广州 510010
创伤致严重颅脑损伤和大出血是创伤早期患者死亡的主要原因[1-3],约1/3的创伤患者会并发创伤性凝血病(trauma-induced coagulopathy,TIC)[4]。TIC是指严重创伤致组织损伤引起机体出现以凝血功能障碍为主要表现的临床多元性疾病[4],不仅增加输血需求,还会因炎症-凝血通路互相影响,增加免疫功能紊乱以及器官功能障碍和死亡的风险[5-7]。 损伤控制性手术及复苏、替代治疗、院前早期救治等的发展,在一定程度上改善了创伤大出血患者的临床管理质量,但病死率仍高达50%[8-9]。有研究发现,若创伤大出血患者出血控制或凝血功能紊乱纠正时间缩短15 min,则器官功能障碍和死亡风险会明显降低[10]。目前TIC的发病机制尚不明确,研究者倾向于蛋白C激活假说[4,11-13]。该假说强调组织低灌注/休克损伤内皮细胞,内皮细胞蛋白C受体(endothelial protein C receptor,EPCR)激活,形成EPCR-血栓调节蛋白(thrombomudulin,TM)-凝血酶抗凝血酶复合物(thrombin-antithrombin complex,TAT),激活蛋白C,形成活化的蛋白C,导致全身低凝状态大出血,可能与TIC的发病和疾病进展有关。高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)作为损伤相关分子模式(damage associated molecular patterns,DAMP),可与免疫细胞和内皮细胞Toll样受体(Toll-like receptor,TLR)结合,诱导先天性免疫反应[14-16],可促进凝血激 活[13,17],可通过TM-TAT介导抑制蛋白C抗凝通路[18-19], 还可诱导血小板聚集,直接干扰凝血块的稳定性,促进微血栓形成[18],在TIC无菌炎症和凝血紊乱中可能起关键作用。为此,本研究分析创伤TIC患者血清HMGB1水平与病情及预后的相关性,探讨血清HMGB1作为新的定量指标在创伤早期TIC病情分析及预后判断中的作用,为TIC的临床管理提供新的方向和治疗靶点。
1 资料与方法
1.1 研究对象 2017年1月1日-2018年12月31日佛山市中医院重症医学科共诊治207例创伤患者,根据纳入标准选取43例。纳入标准:年龄≥18岁;ISS评分≥16分,伤后至转入ICU时间<24 h。排除其他医院转入及长期服用干扰凝血功能药物者。根据TIC诊断标准(INR>1.2)[19]将43例患者分为TIC组(n=23)与对照组(n=20)。本研究经佛山市中医院伦理委员会批准(批准文号:[2016]005号)。所有患者和(或)家属均知情并签署知情同意书。
1.2 一般资料收集 转入ICU时,记录患者年龄、性别、致伤原因、受伤至入ICU的时间(救治时间)、受伤至凝血功能紊乱纠正的时间(纠正时间),以及APACHE Ⅱ评分和ISS评分。住院期间,记录患者的输血量(红细胞、血浆量)、呼吸机使用时间、ICU住院时间和28 d死亡发生率。
1.3 凝血指标、炎性指标及血清HMGB1水平检测 转入ICU时,采集患者外周静脉血,送医院检验科检测凝血指标[活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)、国际标准化比值(international normalized ratio,INR)、纤维蛋白原(fibrinogen,Fib)、血小板计数(platelet,PLT)]及炎性指标[降钙素原(procalcitonin,PCT)、C反应蛋白(C-reactive protein,CRP)]水平。取5 ml静脉血,室温静置1 h,3000 r/min 离心15 min,分离血清,采用ELISA法检测血清HMGB1水平,HMGB1试剂盒由深圳市科润达生物工程有限公司提供,检测采用450 nm波长。
1.4 统计学处理 采用SPSS 25.0软件进行统计分析。正态分布的计量资料以±s表示,两组间比较采用独立样本t检验;计数资料以例(%)表示,两组间比较采用χ2检验。采用logistic回归法分析创伤TIC患者预后的影响因素,Pearson和Spearman相关法分析严重创伤危重患者血清HMGB1水平与病情指标的相关性,ROC曲线分析创伤TIC患者血清HMGB1水平与预后的关系。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 纳入研究的43例中,车祸为最主要的致伤原因(46.5%,20/43),其次为高处坠落伤(27.9%,12/43)和挤压伤(20.9%,9/43)。43例患者TIC的发生率为53.5%(23/43)。
两组患者年龄、性别、致伤原因、救治时间、APACHE Ⅱ评分、ISS评分、PCT及CRP水平差异无统计学意义(P>0.05)。但在ISS评分>25分的严重创伤患者中,TIC组的ISS评分明显高于对照组(P=0.010,表1)。与对照组相比,TIC组APTT和PT差异无统计学意义(P>0.05),但Fib和PLT降低,呼吸机使用时间、输注红细胞和血浆量、感染发生率及多器官功能障碍发生率均明显增高(P<0.05),28 d死亡发生率呈增高趋势,但差异无统计学意义(P=0.091,表1)。
2.2 创伤患者入ICU时血清HMGB1水平比较 ELISA法检测结果显示,TIC组患者入ICU时血清HMGB1水平明显高于对照组[(45.83±30.35) ng/ml vs. (14.05±17.93) ng/ml,P=0.000,图1A]。对存活者和死亡者进行亚组分析显示,所有创伤死亡患者入ICU时血清HMGB1水平均高于存活者[(54.44±20.61) ng/ml vs. (8.72±17.22) ng/ml,P=0.000],且创伤TIC死亡患者血清HMGB1水平高于TIC存活者[(63.58±17.89) ng/ml vs. (18.23±24.60) ng/ml,P=0.000,图1B]。
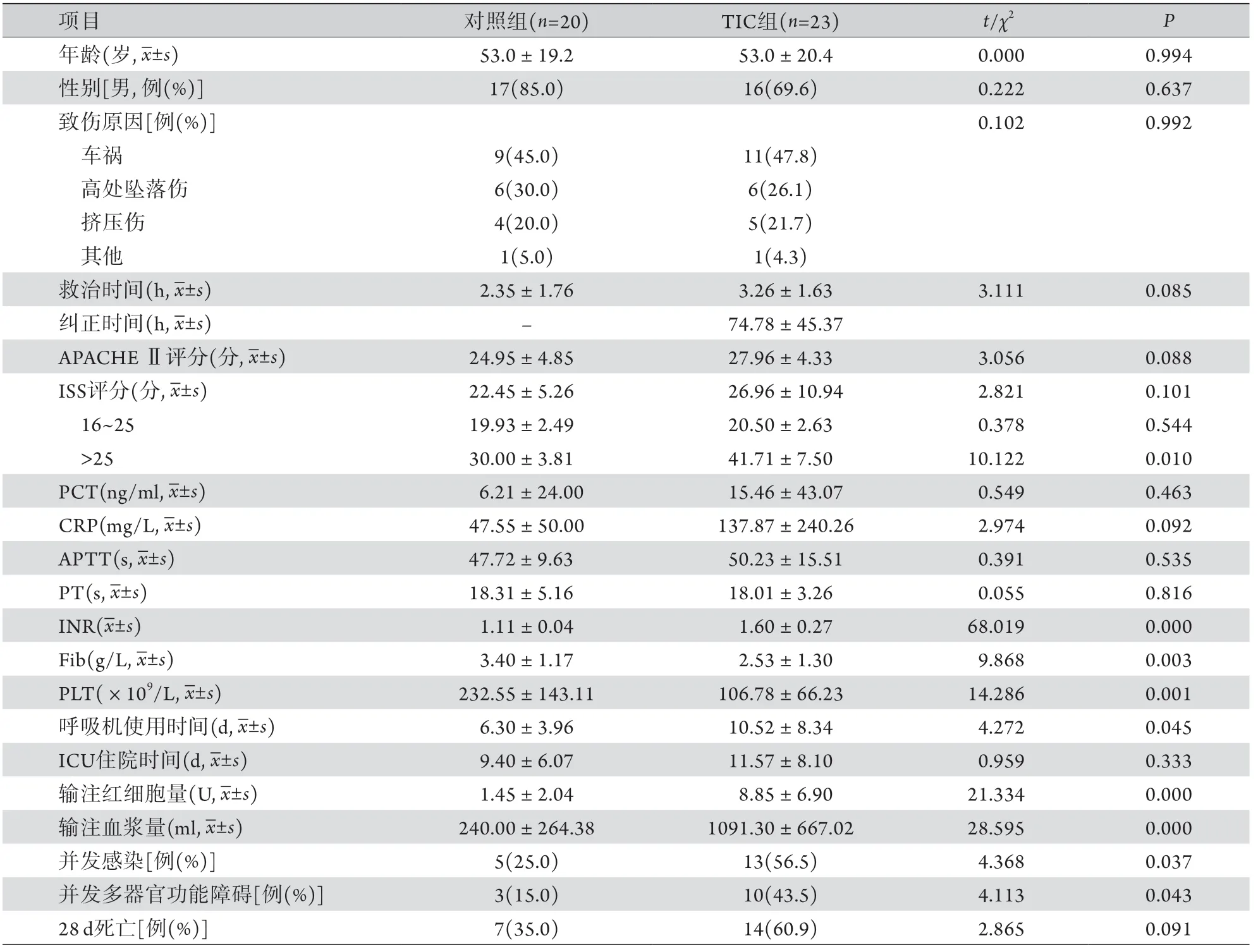
表1 两组患者一般资料比较Tab.1 Comparison of clinical characteristics between the two groups
2.3 严重创伤TIC危重患者的预后危险因素分析
创伤TIC患者预后影响因素的单因素logistic分析显示,与TIC存活者相比,TIC死亡患者的救治时间、纠正时间、ISS评分、输注红细胞和血浆量、血清HMGB1水平、PLT、APTT和CRP水平比较,差异有统计学意义(P<0.05,表2)。将上述指标纳入二元logistic回归分析,结果显示,血清HMGB1、PLT是创伤TIC患者预后的独立危险因素(P=0.004、0.011,表3)。
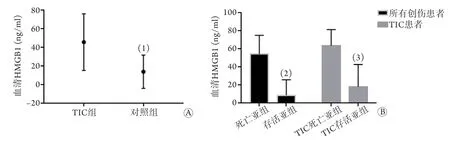
图1 创伤患者入ICU时血清HMGB1水平比较Fig.1 Comparison of the serum HMGB1 level in patients with trauma when admission to ICU
表2 严重创伤TIC危重患者预后影响因素的单因素logistic分析(±s)Tab.2 Univariate logistic regression analysis of influencing prognostic factors in critically ill TIC patients (±s)
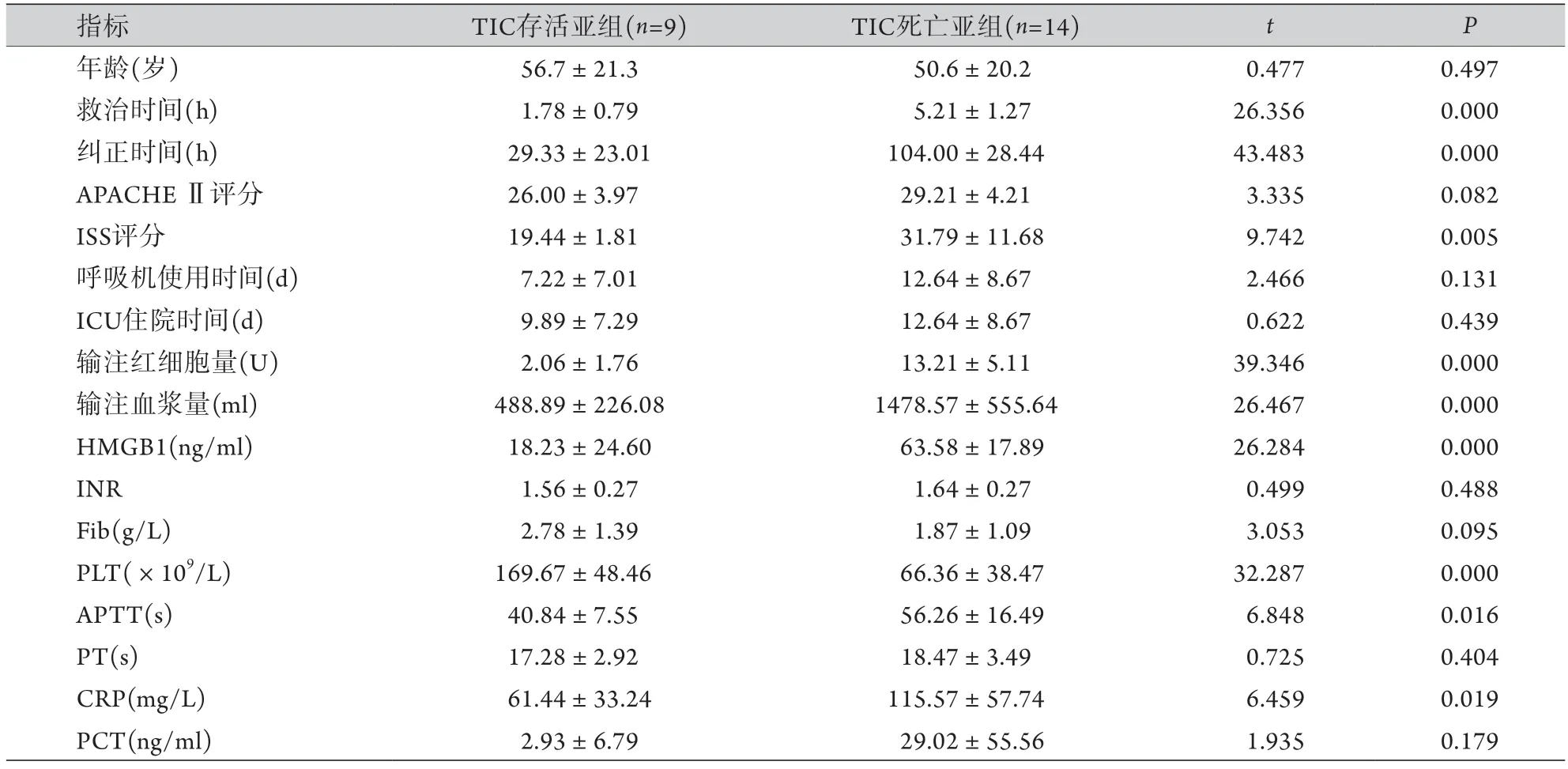
表2 严重创伤TIC危重患者预后影响因素的单因素logistic分析(±s)Tab.2 Univariate logistic regression analysis of influencing prognostic factors in critically ill TIC patients (±s)
HMGB1. 高迁移率族蛋白B1;INR. 国际标准化比值;Fib. 纤维蛋白原;PLT. 血小板计数;APTT. 活化部分凝血活酶时间:PT. 凝血酶原时间;CRP. C反应蛋白;PCT. 降钙素原
指标TIC存活亚组(n=9)TIC死亡亚组(n=14)tP年龄(岁)56.7±21.350.6±20.20.4770.497救治时间(h)1.78±0.795.21±1.2726.3560.000纠正时间(h)29.33±23.01104.00±28.4443.4830.000 APACHE Ⅱ评分26.00±3.9729.21±4.213.3350.082 ISS评分19.44±1.8131.79±11.689.7420.005呼吸机使用时间(d)7.22±7.0112.64±8.672.4660.131 ICU住院时间(d)9.89±7.2912.64±8.670.6220.439输注红细胞量(U)2.06±1.7613.21±5.1139.3460.000输注血浆量(ml)488.89±226.081478.57±555.6426.4670.000 HMGB1(ng/ml)18.23±24.6063.58±17.8926.2840.000 INR1.56±0.271.64±0.270.4990.488 Fib(g/L)2.78±1.391.87±1.093.0530.095 PLT(×109/L)169.67±48.4666.36±38.4732.2870.000 APTT(s)40.84±7.5556.26±16.496.8480.016 PT(s)17.28±2.9218.47±3.490.7250.404 CRP(mg/L)61.44±33.24115.57±57.746.4590.019 PCT(ng/ml)2.93±6.7929.02±55.561.9350.179

表3 严重创伤TIC危重患者预后影响因素的多因素logistic回归分析Tab.3 Multivariate logistic regression analysis of influencing prognostic factors in critical ill TIC patients
2.4 严重创伤危重患者血清HMGB1水平与病情指标的相关性分析 将ICU严重创伤危重患者血清HMGB1水平与病情指标进行相关性分析,结果显示,血清HMGB1水平与伤后救治时间(r=0.648,P=0.0 0 0)、凝血功能紊乱纠正时间(r=0 7 5 4,P=0.000)、APACHE Ⅱ评分(r=0.526,P=0.000)、ISS评分(r=0.516,P=0.000)、呼吸机使用时间(r=0.521,P=0.000)、INR(r=0.509,P=0.000)、A P TT(r=0.4 3 2,P=0.0 0 4)、CR P(r=0.5 9 2,P=0.000)和PCT(r=0.375,P=0.013)呈正相关,与Fib(r=-0.424,P=0.005)、PLT(r=-0.571,P=0.000)、感染发生率(r=-0.505,P=0.001)、多器官功能障碍发生率(r=-0.396,P=0.009)及死亡率(r=-0.765,P=0.000)呈负相关。
2.5 严重创伤TIC危重患者血清H MGB1水平与预后关系的ROC曲线分析 ROC曲线分析显示,血清HMGB1水平预测创伤TIC患者28 d死亡发生率的ROC曲线下面积(AUC)为0.897(95%CI 0.748~1.000,P=0.002);血清HMGB1水平越高,创伤TIC患者28 d死亡的可能性越大;选择54.60 ng/ml为截断值时,尤登指数为0.808,灵敏度为92.9%,特异度为88.9%(图2)。
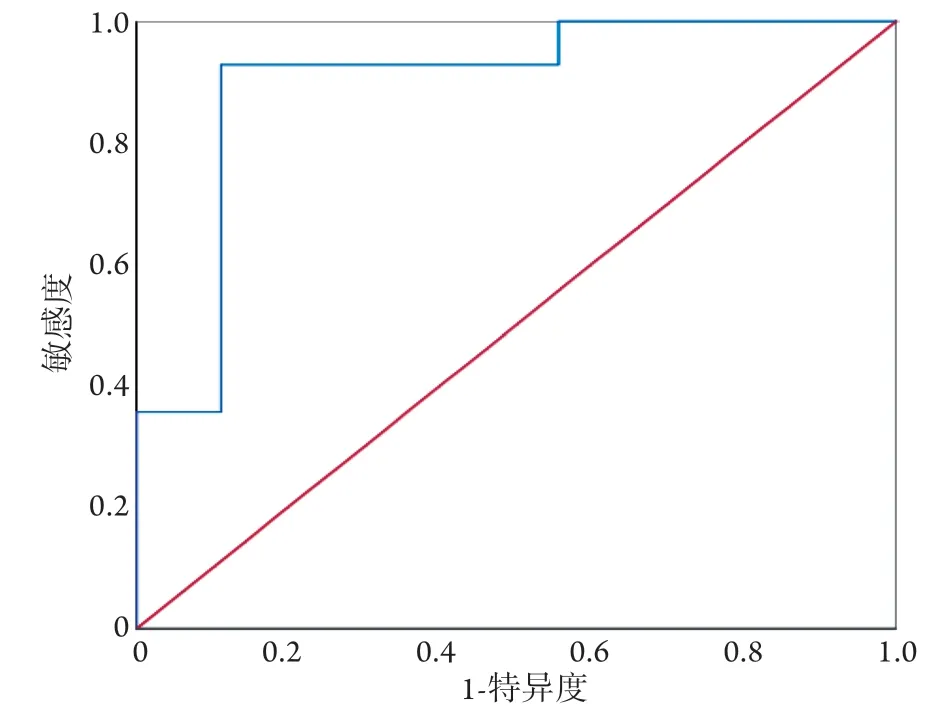
图2 严重创伤TIC危重患者血清HMGB1水平与预后关系的ROC曲线分析Fig.2 ROC curve of serum HMGB1 level and prognosis in critical ill TIC patients
3 讨 论
TIC是严重创伤患者可以预防的早期严重并发症之一[20-21],早期纠正可以显著降低患者多器官功能障碍和死亡的风险[10,22-23]。本研究发现,53.5%的创伤危重患者并发TIC,TIC患者的呼吸机使用时间、输注红细胞和血浆量、感染发生率,以及多器官功能障碍发生率均明显增高,28 d死亡发生率也呈增高趋势。Perkins等[6]的研究发现,TIC患者病死率更高(54.5% vs. 5.1%,P<0.001),大量输血比例(43.5% vs. 1.1%,P<0.001)及损伤控制手术的需求率(55.8% vs. 3.4%,P<0.001)也显著增高,证实创伤并发TIC患者预后不良。本研究发现,TIC存活患者的救治时间和凝血功能紊乱纠正时间明显短于死亡患者,且ISS评分、输血量以及血清HMGB1、CRP水平明显降低,PLT、APTT明显延长。Chang等[10]研究发现,TIC患者的凝血功能紊乱纠正时间与病情及预后直接相关。因此,早期甄别创伤TIC患者并及时纠正凝血功能紊乱,可改善临床管理质量,提高医疗安全性。
关于T I C 的诊断,目前国际上尚无统一标准,文献报道的诊断指标包括APTT[5]、PT[22-24]、INR[19,25-27]和PLT[24,28],其中INR诊断阳性率最高,达41.6%[27],但暂无统一的诊断阈值推荐[29]。本研究采用INR>1.2[19,25-27]作为TIC的诊断标准,结果显示,与对照组比较,创伤TIC患者转入ICU时的一般资料,包括年龄、性别、致伤原因、救治时间、ISS评分和APACHE Ⅱ评分无明显差异(P>0.05),传统凝血指标(APTT和PT)及炎性指标(PCT和CRP)也无明显差异(P>0.05),间接证实了APTT和PT作为创伤早期TIC的诊断指标准确性不佳。INR不是患者死亡的独立危险因素,与TIC的发病机制无明显相关性,替代生化指标不仅诊断敏感度及特异度高,还与TIC的发病机制相关,更能反映病情严重程度及预后,可能更有益于临床TIC患者的管理。
TIC的具体病理生理机制尚未明确,目前倾向于蛋白C激活假说,该假说强调内皮细胞损伤和蛋白C的激活[4,13]。HMGB1可通过特异性受体糖基化终末产物受体(receptor for advanced glycation end products,RAGE)及p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路减轻电阻抗,诱导内皮细胞的完整性丢失[30];通过TM-TAT介导抑制蛋白C抗凝通路[31];刺激单核细胞组织因子的表达,促进凝血激活[14-17];诱导血小板聚集,直接干扰凝血块的稳定性,促进微血栓的形成[18]。本研究发现,创伤TIC患者血清HMGB1水平显著增高,且死亡患者血清HMGB1水平更高;严重创伤危重患者血清HMGB1水平与伤后救治时间、凝血功能紊乱纠正时间、病情严重程度(APACHE Ⅱ评分、ISS评分)、呼吸机使用时间、INR、APTT、CRP及PCT呈正相关,与Fib、PLT、感染发生率、多器官功能障碍发生率及死亡率呈负相关。Nilsson等[32]的研究表明,危重患者APTT和INR可独立预测蛋白C水平,而HMGB1可通过TM-TAT介导抑制蛋白C抗凝通路[31],可能可解释HMGB1与凝血指标的相关性。本研究多因素logistic回归分析进一步证实血清HMGB1是创伤TIC患者预后的独立危险因素,选择54.60 ng/ml为截断值时,尤登指数为0.808。Cohen等[33]的研究也发现,创伤患者伤后30 min血清HMGB1水平显著增高,与损伤严重程度、组织低灌注程度、创伤早期纤维亢进以及补体激活相关,间接证实了血清HMGB1水平与创伤TIC的发病密切相关。
值得注意的是,Xu等[34]发现,阻断HGMB1时,可能通过R AGE/NF-κB通路而抑制IL-6和TNF-α的生成,降低P-选择素水平,抑制纤溶亢进,从而改善TIC小鼠的炎症反应和凝血功能紊乱。同时,HMGB1/RAGE可通过PI3K/Akt/eNOS信号通路诱导细胞形态学改变和细胞骨架重组,促进内皮细胞的迁移、增殖和存活[28,35],诱导间充质干细胞分化形成内皮细胞[28,36],此外,还可作为引诱剂在细胞坏死时诱导炎性细胞、干细胞和内皮细胞祖细胞的黏附,可能在创伤修复中起重要作用。因此,血清HMGB1可能与TIC的发病机制有关,可作为早期诊断指标,且与患者的病情严重程度及预后相关,可能是未来的治疗靶点。
本研究存在一定局限性:第一,本组患者为急性创伤转入ICU的危重患者,研究结果与国内外院前和急诊研究以及轻中度创伤研究的结果可能不一致;第二,纳入病例数偏少,结果可能存在一定局限性;第三,本研究未进行血清HMGB1与TIC发病机制的相关性研究以及TIC患者病程发展的持续性研究。
综上所述,超过50%的急性创伤危重患者并发TIC,并发TIC患者的呼吸机使用时间、输血量、感染发生率及多器官功能障碍发生率均显著增高,28 d死亡发生率也呈增高趋势。创伤并发TIC患者入ICU时血清HMGB1水平较高,与病情及预后密切相关。血清HMGB1是创伤TIC患者预后的独立危险因素之一,可作为TIC的诊断、病情评估和预后判断指标,更可能是未来的治疗靶点,有积极的临床意义和应用前景。
