鹅不食草介导Nrf2/HO-1信号通路在脑缺血再灌注中抗氧化抗炎作用机制研究*
2020-12-16马善波杨双武高海锋
黄 钢,马善波,杨双武,高海锋
1.空军军医大学西京医院神经外科(西安 710032);2.空军军医大学西京医院药剂科(西安 710032);3.西北大学附属医院(西安市第三医院)(西安 710018)
脑卒中是由于血管阻塞或供血血管突然破裂导致血液无法流入脑组织造成的中枢神经系统损伤疾病[1]。2018年,《中国脑卒中防治报告》显示脑卒中已成为我国成人第一死亡原因,也是成人残疾的首要原因[2]。中医中药对卒中治疗具有悠久的历史,积淀了深厚的理论基础。中医认为脑卒中病变核心是气血逆行上乱,主要病机是痰瘀阻滞脑络,痰瘀郁久化热产生各种毒性物质。病因多为饮食不节、情志失调、正气不足及劳倦过度等。病性为本虚标实、上盛下虚,其中肝肾阴虚、气血衰少为本,肝阳上亢、风火相煽、瘀血阻滞、痰湿雍盛为标。鹅不食草是一种双子叶菊科植物石胡荽的全草,中医记载具有祛风通络、解毒消肿之功效。《本草纲目》评论鹅不食草上达头脑而治顶痛目病,内达肺经而治痰疟、散疮肿[3]。现代药理研究表明鹅不食草不仅具有抑菌、抗炎、抗氧化作用,而且具有一定的神经保护作用[4],是一个极具研究价值和开发潜力的植物药。但鹅不食草在脑缺血再灌注后抗炎抗氧化作用的研究较少。因此,本研究旨于建立脑缺血再灌注模型,探究鹅不食草对大鼠脑组织中氧化应激反应和炎症反应的影响。
材料与方法
1 实验材料
1.1 实验动物:72只7周龄雄性SD大鼠,SPF级,体重190~210 g,购自于并饲养于空军军医大学动物实验中心,饲养条件为温度(23±2)℃、湿度50 %~60%、自由饮水摄食、12 h/12h昼夜节律、4只/笼饲养。
1.2 药物与试剂:中动脉阻塞线栓(广州佳灵生物科技公司);鹅不食草醇提物(西安锐禾生物公司);2,3,5-三苯基氯化铵(2,3,5-triphenyte-trazoliumchloride,TTC)染料(武汉塞维尔生物公司);RIPA裂解液、BCA试剂盒(上海碧云天生物科技公司);丙二醛(Malondialdehyde,MDA)试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD)试剂盒、谷胱甘肽(Glutathione r-glutamyl cysteingl glycine,GSH)试剂盒、活性氧(Reactive oxygen species,ROS)试剂盒、肿瘤坏死因子(Tumor necrosis factor -α,TNF-α)试剂盒、白介素1β(Interleukin 1β,IL-1β)试剂盒、白介素6(Interleukin,IL-6)试剂盒(南京建成生物功能研究所);核因子E2相关因子2(Nuclear factor E2-related factors 2,Nrf2)抗体、血红素加氧酶-1(Heme oxygenase-1,HO-1)抗体、核因子κB(Nuclear factor kappa-B,NF-κB)抗体、β-actin抗体(美国Proteintech公司);RT-PCR试剂盒(赛默飞世尔科技有限公司)。
2 实验方法
2.1 模型的建立与分组:将72只SD大鼠按随机原则分为假手术组、脑缺血组、依达拉奉组(5 mg/kg)、鹅不食草100、200、400 mg/kg剂量组,每组12只。除假手术组外,各组按参考文献[5]中方法制备脑缺血/再灌注模型。大鼠应用400 mg/kg剂量水合氯醛完全麻醉后,仰卧位固定于手术台上,颈部剪毛消毒。打开颈部皮肤,钝性分离出颈总动脉并结扎颈外动脉、暂时阻断颈总动脉、颈内动脉。自颈外动脉开口,插入线栓,前进至颈内动脉,以端点距离分叉处15 mm为终点。假手术组仅打开颈动脉不做插线处理。
2.2 给药方法:术前稀释鹅不食草提取物,浓度分别为40 mg/ml、20 mg/ml、10 mg/ml。各组术前2 h,鹅不食草灌胃给药,按大鼠体重,每100 mg给药1 ml。依达拉奉腹腔给药,剂量5 mg/kg。术后持续给药,1次/d,给药3 d后检测各指标。
3 检测指标
3.1 神经功能评分:参考文献[6]采用18分量表法评估大鼠神经功能,评分标准如下:观察5 min内大鼠在笼中自发运动(0~3分);身体悬空,观察四肢伸展情况(0~3分);后肢悬空,前肢在鼠笼上爬行,仅靠前肢行走,观察前爪伸展运动(0~3分);观察大鼠攀爬能力(1~3分);观察大鼠身体触觉反射(1~3分);观察大鼠触须触觉反射(1~3分)。得分3~18分范围内。
3.2 模型大鼠脑梗死面积:水合氯醛深度麻醉大鼠,迅速断头取出脑组织,-80 ℃冷冻2 min后,连续切成6个冠状切片,在2 %的TTC溶液中避光孵育15 min,将脑组织转移到4 %多聚甲醛中固定,按顺序展开并拍照。TTC染色后梗死区域呈白色,未梗死区域呈红色。梗死面积占比=(梗死面积/该切片面积)×100%。
3.3 RT-PCR检测大鼠脑组织Nrf2/HO-1和NF-κB的mRNA表达:应用实时定量PCR(qRT-PCR)法检测Nrf2、HO-1、NF-κB p65表达。取大鼠缺血侧皮质组织,液氮研磨,试剂盒提取总RNA。加入RT液、AWM逆转录酶反应,反应产物加入PCR液及上下游蛋白引物。反应液置于荧光定量PCR上进行扩增反应,条件:95 ℃、15 s;92 ℃、10 s;72 ℃、75 s;60 ℃、15 s;35 个循环;54 ℃、10 min。校正每个待检测样本的Ct值,计算△Ct,2-△△Ct即为目的基因的表达。目的基因引物序列:Nrf2:上游引物5’-ACGTAGATCGATATAGCTATGGGATCAGT-3’,下游引物5’-CTGATAGCTAGATATTCAGTATAGCTA-3’;HO-1:上游引物5’-ACGCTAGATATTTAGATAGATCGAT-3’,下游引物5’-ACGCTA-GATATGTTAGACTAGATCGAT-3’;NF-κB:上游引物5’-CAUGCCAGUGAGAAUGUAUGCCAU-3’,下游引物5’-ACGCAGGAGACGGAAGAAUAAAU-3’;β-actin:上游引物5’-GAGACCTTCAACACCCCAGC-3’,下游引物5’-CCACAGGATTCCATACCCAA-3’。
3.4 Western blot 检测大鼠脑组织Nrf2/HO-1和NF-κB p65蛋白的表达:取大鼠缺血侧皮质组织,加入RIPA裂解液后静置10 min,4 ℃条件下研磨呈浆状,离心后使用BCA试剂盒测试蛋白浓度,加入Loading buff,煮沸后等量上样。电泳90 min后湿法转膜,脱脂牛奶封闭1 h,加入一抗稀释液4 ℃过夜。PBS洗膜3次,加入二抗稀释液,室温孵育2 h,洗膜并加入超敏发光液,以GAPDH作为内参,检测Nrf2、HO-1和NF-κB p65蛋白表达。
3.5 检测大鼠脑组织中氧化因子、炎症因子含量:取大鼠缺血侧皮层组织,加入PBS溶液研磨,离心取上清液,严格按照试剂盒说明书添加样品、试剂,孵育抗体后酶标仪扫描波长。利用标准曲线计算出各组大鼠脑组织中氧化因子、炎症因子含量。
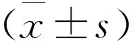
结 果
1 鹅不食草对脑缺血模型大鼠神经功能评分的影响 假手术组未进行造模处理,所有大鼠评分均为满分18分;与假手术组相比,脑缺血组大鼠神经功能评分降低,差异有统计学意义(P<0.05),提示脑缺血模型造模成功;与脑缺血组相比,依达拉奉治疗介导大鼠神经功能评分升高,差异有统计学意义(P<0.05);与脑缺血组相比,鹅不食草200 mg/kg剂量组和400 mg/kg剂量组升高了大鼠的神经功能评分(图1)。

a:与假手术组比较,P<0.05;b:与脑缺血组比较,P<0.05
2 鹅不食草对脑缺血模型大鼠脑梗死面积的影响 假手术组因为没有进行插线栓处理,所以没有出现梗死区域。与假手术组相比,脑缺血组大鼠脑组织中出现显著增加的梗死区域,量化统计达到了40%,组间比较差异有统计学意义(P<0.05)。与脑缺血组相比,依达拉奉组与鹅不食草200 mg/kg与400 mg/kg组大鼠脑梗死面积均减少,差异有统计学意义(P<0.05)。见表1(图2)。

表1 各组大鼠脑组织中梗死面积占比比较(%)

图2 各组大鼠脑组织中梗死面积
3 鹅不食草对脑缺血模型大鼠脑组织中氧化应激反应的影响 脑缺血组大鼠脑中抗氧化因子SOD、GSH水平变化差异无统计学意义(P>0.05);脑缺血组氧化因子MDA、ROS表达均升高,与假手术组相比,差异有统计学意义(P<0.05)。与脑缺血组相比,依达拉奉组、鹅不食草200 mg/kg剂量组、鹅不食草400 mg/kg剂量组均显著增加了大鼠脑中抗氧化因子SOD、GSH表达,组间比较差异有统计学意义(P<0.05),而氧化因子MDA、ROS的含量显著降低,组间比较差异有统计学意义(P<0.05)。见表2。

表2 各组大鼠脑组织中抗氧化因子和氧化因子水平比较
4 鹅不食草对脑缺血模型大鼠脑组织中炎症反应的影响 与假手术组相比,脑缺血组大鼠脑中炎症因子IL-1β、TNF-α、IL-6表达均升高,差异有统计学意义(P<0.05)。与脑缺血组相比,依达拉奉组与鹅不食草200 mg/kg剂量组、鹅不食草400 mg/kg剂量组都显著降低了脑缺血大鼠缺血半侧脑组织中炎症因子IL-1β、TNF-α、IL-6表达,差异有统计学意义(P<0.05)。见表3。
5 鹅不食草对脑缺血模型大鼠脑组织中Nrf2 mRNA、HO-1 mRNA及NF-κB mRNA表达的影响 与假手术组相比,脑缺血组大鼠脑中Nrf2 mRNA和HO-1 mRNA表达差异无统计学意义(P>0.05)。与脑缺血组相比,依达拉奉组和鹅不食草200 mg/kg剂量组、鹅不食草400 mg/kg剂量组显著升高了Nrf2 mRNA和HO-1 mRNA表达,差异有统计学意义(P<0.05)。与假手术组相比,脑缺血造成大鼠脑组织中NF-κB mRNA表达显著升高,与脑缺血相比,依达拉奉组和鹅不食草200 mg/kg剂量组、鹅不食草400 mg/kg剂量组降低了NF-κB mRNA表达,差异均有统计学意义(P<0.05)。见表4。

表3 各组大鼠脑组织中炎症因子水平比较(pg/mg)

表4 各组大鼠脑组织中Nrf2 mRNA、HO-1mRNA及NF-κB mRNA表达比较
6 鹅不食草对脑缺血模型大鼠脑组织中Nrf2、HO-1及p-NF-κB p65蛋白表达的影响 与假手术组相比,脑缺血组大鼠脑中Nrf2和HO-1 蛋白表达差异无统计学意义(P>0.05)。与脑缺血组相比,依达拉奉组和鹅不食草200 mg/kg剂量组、鹅不食草400 mg/kg剂量组均升高了Nrf2和HO-1 蛋白表达,差异均有统计学意义(P<0.05)。与假手术组相比,脑缺血造成大鼠脑组织中p-NF-κB p65蛋白表达显著升高,差异有统计学意义(P<0.05)。与模型组相比,依达拉奉组和鹅不食草200 mg/kg剂量组、鹅不食草400 mg/kg剂量组均降低了p-NF-κB p65蛋白表达,差异有统计学意义(P<0.05)。见表5(图3)。

表5 各组大鼠脑组织中Nrf2、HO-1及p-NF-κB p65 蛋白表达
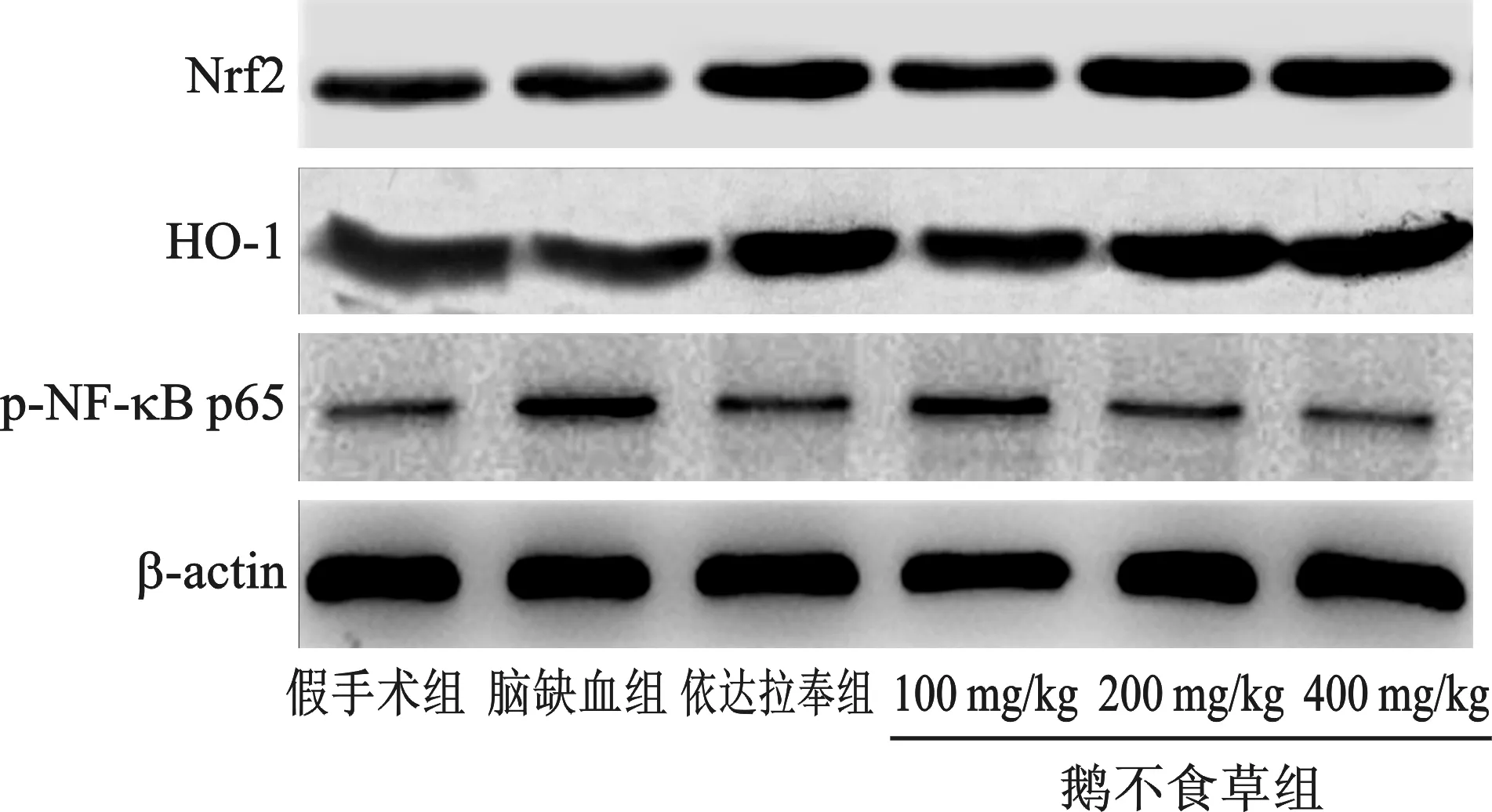
图3 各组大鼠脑组织Nrf2、HO-1及p-NF-κB p65 蛋白表达
讨 论
脑卒中是一种临床常见性疾病,具有较高的致残和致死率。中医将脑卒中归于“中风”的范畴,总病机属于阴阳失调,气血逆乱[7]。易水学派认为:“凡人年逾四旬,气衰之际,因忧喜愤怒伤其气者,多有此疾”,即正气不足是中风的重要病因[8]。至清代王清任总结中医中风理论首创“气虚血瘀”之理论,即气血逆行,痰瘀郁滞所致瘀痰热毒是造成中风的关键[9]。因此,清热解毒,化瘀通络是中风治疗的重要方向。鹅不食草在中医药中应用广泛,《本草汇言》中记载,其味辛烈,其气辛熏,其性升散,能通肺经,上达头脑,故有祛痰通气、散寒祛邪之功效。其去目翳障,并头中寒邪、头风脑痛疾,皆取辛温升散之功也。故本研究采用鹅不食草作为缺血性脑卒中治疗药物。
现代研究认为脑卒中往往与脑组织中氧化/还原因子调节失衡相关。Nrf2/HO-1信号通路是调节机体氧化应激反应的重要机制。Cen等[10]研究显示脑梗死缺血区皮质中Nrf2和HO-1等蛋白表达量在24 h明显上升。Nrf2在机体中扮演着氧化应激反应感受器的角色。HO-1是Nrf2下游蛋白,是一种抗氧化酶,在抗氧化应激发生时清除氧自由基片段方面发挥作用。生理条件下,细胞中Nrf2主要存在于细胞质中,通过与Kelch 样环氧氮氯丙烷相关蛋白(Kelch-like ech associating protein,Keap1)连接形成Nrf2-Keap1复合物,保持着无活性状态且极易发生降解。当机体氧化应激反应增加时,Keap1-Nrf2复合物通过Keap1巯基修饰和Nrf2磷酸化方式,使其各自构象发生变化,从而使Nrf2与Keap1发生解离,且Nrf2移位进入细胞核,与核内抗氧化应激原件结合[11],激活抗氧化酶HO-1的基因转录,发挥抗氧化作用,减少神经元损伤或死亡,从而起到神经保护作用[12]。马行凯等[13]研究显示小鼠脑缺血模型中Nrf2的表达是一个动态变化过程,缺血区Nrf2在再灌注2 h后表达增加,且在8 h时达到顶峰,而在24 h和72 h后开始减少,最终与假手术组无异。然而,也有与此不同的研究结果,肖宇等[14]研究发现在脑缺血再灌注24 h时,Nrf2与HO-1表达量显著上升。本研究发现,再灌注72 h后,脑缺血组Nrf2 mRNA与蛋白表达与假手术组没有统计学差异,与马行凯等的研究一致。此外,与脑缺血组相比,依达拉奉组和鹅不食草200 mg/kg剂量组、鹅不食草400 mg/kg剂量组则显著增加了大鼠脑组织中Nrf2与HO-1 mRNA和蛋白含量表达。氧化应激试剂盒检测显示,依达拉奉组和鹅不食草200 mg/kg剂量组、鹅不食草400 mg/kg剂量组显著增加了大鼠脑组织中抗氧化因子水平,减少了脑组织中氧化因子水平,说明依达拉奉与鹅不食草通过Nrf2/HO-1信号通路改善大鼠脑组织中氧化应激反应。
脑缺血引起的氧化损伤还可以继续激活脑组织中炎症反应,导致大量细胞因子和炎症介质释放。与Nrf2相似,NF-κB是一种多功能核转录因子,受Keap1介导的IκB激酶β(IκB kinases β,IKKβ)调控。生理条件下,Keap1与NF-κB形成复合物,维持无活性状态且易降解。当Nrf2信号缺失会导致NF-κB p65与抑制因子IKKβ快速磷酸化,复合物被水解分离[15]。胞浆内NF-κB p65移位进入细胞核,发挥基因调控作用,促进下游TNF-α、IL-1β和IL-6等大量炎性细胞因子分泌。有研究应用siRNA敲除血管内皮细胞keap1基因,诱导Nrf2依赖的抗氧化酶表达增加,减少ROS在细胞内的积累,而ROS则是NF-κB活化必不可少的[16]。本研究中,与假手术组相比,脑缺血组大鼠脑中p-NF-κB p65 mRNA和蛋白表达显著增加,介导脑中炎性细胞因子TNF-α、IL-1β、IL-6的分泌增加,而依达拉奉组和鹅不食草200 mg/kg剂量组、鹅不食草400 mg/kg剂量组显著减少了大鼠脑中p-NF-κB p65 mRNA和蛋白表达,显著减少炎性细胞因子TNF-α、IL-1β、IL-6的分泌。
