清热润燥方对哮喘小鼠气道反应及炎性反应影响的实验研究*
2020-12-16吴佳丽余文丽魏丹霞
赵 茜,吴佳丽,余文丽,魏丹霞
1.云南中医药大学第三附属医院(昆明 650011);2.昆明市中医医院(昆明 650011)
支气管哮喘在中医属“哮病”范畴[1],近年来哮喘患病率在全球范围内有逐年增长的趋势,2019年一项调查显示,目前我国成人哮喘患者总数已达到4570万[2]。中医认为哮病的发生是由于宿痰伏肺,若诱因或感邪引触致痰阻气道,肺失肃降、痰气搏结便产生发作性痰鸣气喘疾患。既然引起哮病的根本原因是宿痰,那么运用培土生金以“润养”、通调津气以“通利”[3]不失为治疗哮病的方法,“清热润燥口服液”[4]是名中医陆家龙老师的经验方,通过现代工艺制备而成,其作用机理是通过增加肺组织或者气道的水液生成,以“润”养气道,通过减少气道病理性黏液分泌,以“通利”气道、促痰液排出来治疗哮喘。本实验基于以上理论,通过观察该药对哮喘模型小鼠的气道炎症以及慢性气道炎症中最主要的黏蛋白5AC(Mucin 5AC,MUC5AC),以及肺组织中影响气道水液代谢的水通道蛋白5(Aquaporin 5,AQP5)的影响,并根据结果探讨基于“润养与通利”理论,治疗哮喘的实验基础。
材料与方法
1 实验材料
1.1 实验动物:72只6~8周龄BALB/c小鼠,平均体重(20±2)g,由昆明医科大学实验动物学部提供[许可证号:SCXK(滇)k2015-0002]。
1.2 实验药物:清热润燥口服液由桑叶、浙贝母、麦冬、茯苓、半夏各200 g,苦杏仁120 g,炒谷芽、炒麦芽、芦根、薏苡仁、冬瓜仁各300 g,陈皮60 g,南沙参240 g组成。委托云南中医药大学第三附属医院制剂室制备提供,4.1 g原生药/ml。药物保存于4~8 ℃冰箱中备用,使用前复温至20~25 ℃使用。
2 实验方法
2.1 动物模型建立:每组12只小鼠,除对照组外,各组小鼠于第1、8、15 天腹腔注射OVA致敏液0.2 ml(含0.2 mg OVA和1 mg氢氧化铝)。于第21 天起,将小鼠置于透明容器内,给予2% OVA的生理盐水雾化激发,1次/d,30 min/次,连续7 d;正常组采用生理盐水代替OVA进行处理。模型组造模后死亡2只,清热润燥低剂量组死亡1只。
2.2 动物分组及给药:72只6~8周龄BALB/c小鼠随机分为正常组、模型组、阳性药物对照组(地塞米松)及清热润燥高、中、低剂量组,每组12只小鼠雌、雄各半。每组给药剂量的依据:根据相关标准[5]并结合前期实验结果,正常组与模型组于每日OVA雾化攻击前1天,按照给药剂量同体积的生理盐水进行灌胃,清热润燥高剂量组在造模成功后以8.64 g/(kg·d)剂量进行灌胃,清热润燥中剂量组在造模成功后以4.32 g/(kg·d)剂量进行灌胃,清热润燥低剂量组在造模成功后以2.16 g/(kg·d)剂量进行灌胃,阳性药物对照组在造模成功后以给药剂量同体积的地塞米松进行灌胃。
2.3 实验检测指标:气道反应性的测定:灌胃结束后第2天,小动物生理仪记录小鼠的呼吸频率和潮气量。肺组织病理学检测:HE染色,普通光学显微镜下观察显色结果并拍照。气道杯状细胞的检测:PAS染色观察各组间小鼠肺气道杯状细胞的分布及数量变化。小鼠肺泡灌洗液中MUC5AC、AQP5、IL-13的检测:小鼠饲养第30 天,禁食12 h后予10 %水合氯醛(0.3 ml/100 g)腹腔内注射麻醉,腹主动脉取血后放血处死小鼠,开胸,暴露气管及肺。用套管针插入左主支气管并结扎、固定,拔出针芯后用2 ml冰生理盐水灌洗左肺,再缓慢回抽,每次回抽液体约1.5 ml,如此反复灌洗3次,回收率约75%。将回收的灌洗液混匀,先取0.5 ml用细胞计数板行BALF细胞计数,余下的液体4 ℃,1000 r/min,离心10 min,取上清液-20 ℃保存。使用ELISA法检测肺泡灌洗液中MUC5AC含量。
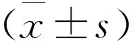
结 果
1 各组小鼠吸气峰流速比较 灌胃结束后第2天,小动物生理仪记录小鼠吸气峰流速(Peak value inspiratory velocity of flow,PIF)值。与正常组比较,模型组、清热润燥各剂量组及阳性药物组的吸气峰流速比较,差异无统计学意义(P>0.05)。与模型组比较,清热润燥各剂量组及阳性药物组的吸气峰流速比较,差异无统计学意义(P>0.05)。见表1。
2 各组小鼠呼气峰流速比较 灌胃结束后第2天,小动物生理仪记录小鼠吸气峰流速(Peak value expiration velocity of flow,PEF)值。与正常组比较,模型组呼气峰流速明显减少,差异有统计学意义(P<0.01)。与正常组比较,清热润燥低剂量组呼气峰流速减少,差异有统计学意义(P<0.05)。清热润燥中、高剂量组及阳性药物组的呼气峰流速相比正常组差异无统计学意义(P>0.05)。与模型组比较,清热润燥低剂量组呼气峰流速升高,组间比较无统计学意义(P>0.05),清热润燥中、高剂量组及阳性药物组的呼气峰流速与模型组比较,均明显增加,差异有统计学意义(P<0.01)。见表1。
3 各组小鼠呼吸频率比较 与正常组比较,模型组及清热润燥低剂量组呼吸频率(Respiratory rate,R)明显增加,差异有统计学意义(P<0.01)。清热润燥中、高剂量组及阳性药物组与正常组比较,差异无统计学意义(P>0.05)。清热润燥低剂量组呼吸频率与模型组比较,差异无统计学意义(P>0.05)。清热润燥中剂量组的呼吸频率低于模型组,清热润燥高剂量组及阳性药物组的呼吸频率与模型组比较,均减少,差异均有统计学意义(P<0.01)。见表1。
1993年,美国国会通过的《政府绩效与结果法案》,首次从立法上对美国联邦机构绩效评价做出了制度性规定。该法案将资源和管理决策与绩效挂钩,建立以绩效为目的的预算制度,将美国政府的绩效管理重点由“过程问责”转向“结果问责”,由“投入—产出”模式转为“目标—结果”模式[3],促使联邦部门和机构在预算中加强“战略—目标—预算—绩效”的闭环管理,提高政府管理绩效和服务效率。
4 各组小鼠肺组织病理学比较 根据HE染色结果可知,正常组小鼠气管内可见少量黏液,气管黏膜上皮完整、管腔内无黏液渗出及炎症细胞浸润;模型组小鼠气管内有黏液,可见嗜酸性粒细胞,黏液细胞不规则增生,上皮细胞坏死脱落;血管和气管周围,肺泡间隔可见大量炎细胞浸润;清热润燥低剂量组小鼠支气管管腔可见黏液栓,管壁各层可见炎细胞浸润,平滑肌增生,血管和气管周围,肺泡间隔可见大量炎性细胞浸润;清热润燥中剂量组小鼠血管及气管周围可见炎性细胞浸润,气管壁增厚,细胞增生;清热润燥高剂量组小鼠气管扩张,气管和血管周围可见少量炎性细胞浸润,血管内可见中性粒细胞;阳性药物组小鼠血管及气管周围可见炎细胞浸润,气管壁增厚,细胞增生(图1)。
表1 各组小鼠吸气峰流速、呼气峰流速及呼吸频率比较
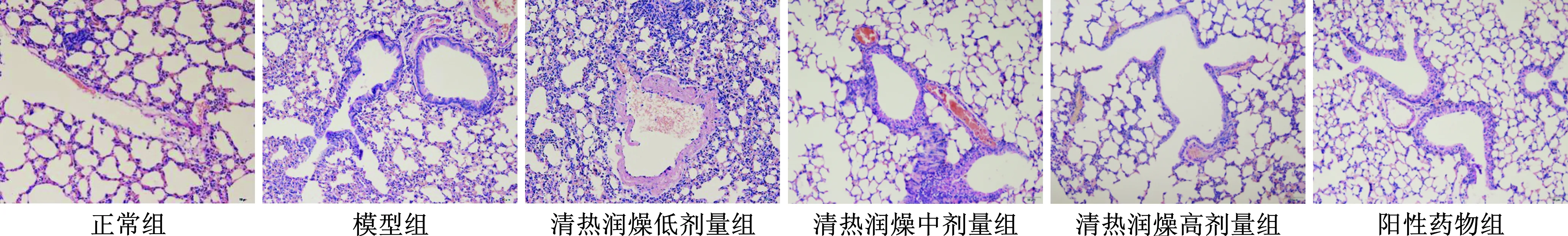
图1 各组哮喘小鼠肺组织病理学表现(HE染色,×20)
5 各组小鼠气道杯状细胞比较 根据PAS染色结果(图2),正常组小鼠支气管壁可见零星几个杯状细胞,呈紫红色,管腔内无黏液分泌;模型组小鼠气管壁可见有大量的深染杯状细胞增生,呈紫红色,个别管腔内黏液分泌明显;清热润燥低剂量组小鼠与模型组比较,气管壁中杯状细胞减少,呈紫红色,腔内无黏液分泌;清热润燥中剂量组小鼠与模型组比较,管壁中的杯状细胞较模型组明显减少,呈紫红色,个别支气管未见杯状细胞;清热润燥高剂量组小鼠与模型组比较,支气管壁见少量杯状细胞,呈紫红色,腔内无黏液分泌;阳性药物组小鼠支气管壁有零星几个杯状细胞,呈紫红色,管腔内无黏液分泌。
6 各组小鼠BALF中MUC5AC蛋白表达比较 与正常组比较,模型组、清热润燥低剂量组BALF中MUC5AC蛋白表达明显增加,差异有统计学意义(P<0.01)。清热润燥中、高剂量组和阳性药物组MUC5AC表达与正常组比较,差异无统计学意义(P>0.01)。与模型组比较,清热润燥低剂量组MUC5AC表达有所下降,但无统计学意义(P>0.05);阳性药物组及清热润燥中、高剂量组MUC5AC表达下降更多,组间比较差异均有统计学意义(P<0.01)。
7 各组小鼠BALF中AQP5表达比较 与正常组比较,模型组BALF中AQP5表达明显减少,清热润燥各剂量组和阳性药物组AQP5表达明显减少,差异有统计学意义(P<0.01)。与模型组比较,清热润燥低剂量组AQP5增加无统计学意义(P>0.05);阳性药物组及清热润燥中、高剂量组的AQP5,与模型组比较均具有统计学差异(P<0.01)。见表2。
8 各组小鼠BALF中IL-13表达比较 与正常组比较,模型组BALF中IL-13含量明显增加;清热润燥低剂量组、中剂量组中IL-13均高于正常组,差异有统计学意义(P<0.05)。清热润燥高剂量组、阳性药物组中IL-13与正常组比较,差异无统计学意义(P>0.05);与模型组比较,清热润燥低剂量组中的IL-13差异无统计学意义(P>0.05);阳性药物组,清热润燥中、高剂量组中的IL-13含量与模型组比较,差异有统计学意义(P<0.01)。见表2。

表2 各组小鼠BALF中MUC5AC、AQP5、IL-13表达比较
讨 论
哮喘是多种炎症因子参与的气道慢性炎症性疾病[6],炎性因子IL-13是哮喘发作的重要原因,其在黏液分泌中作用较为明显,MUC5AC作为气道黏液中最为重要的黏蛋白,是呈IL-13诱导性表达,健康人气道中MUC5AC含量很少[7],MUC5AC与哮喘慢性炎症引起的气道黏液高分泌有密切关系[8];水分是气道黏液的重要组成部分,气道黏液95%以上都是水分,而水通道蛋白通过调节生理和细胞对液体体积和渗透压变化的反应,来进行整个生物体内水分平衡的基本系统调节[9],在肺组织中,水通道蛋白5是主要的水转运通道之一,其减少将导致气道水分分泌的减少[10],进而引起气道黏液的黏稠度增加,使其更加难以排出气道。AQP5的异常表达与支气管哮喘水液代谢失衡及气道黏液高分泌有着密切联系,是近年来研究支气管哮喘发病机制的新方向[11-13]。
在本次实验中,哮喘模型小鼠气道病理染色表现出炎细胞浸润、MUC5AC明显增多,提示构建的模型符合气道黏液高分泌模型。与模型组比较,地塞米松组及清热润燥中、高剂量组炎细胞浸润较模型组好转,且能明显减少IL-13、降低MUC5AC的表达同时增强了AQP5蛋白的表达。黏蛋白分子原本参与组成呼吸道黏液,有保护和润滑上皮的作用,但在感染、过敏原等多种因素的影响下,气道上皮分泌MUC5AC便显著增加,引起了气道黏液的高分泌[13];AQP5主要分布在哺乳动物的唾液腺、肺泡Ⅰ型细胞、上呼吸道分泌上皮细胞等[14-15],作为肺组织中主要水通道蛋白,可帮助水分子快速通过质膜移动,帮助气道及肺内液体的吸收及转运,并参与气道黏液的分泌与调节[16]。哮喘患者,尤其是慢性哮喘或者咳嗽变异性哮喘的患者,常常感觉咽干、痰难以咯出,这是腺体结构或功能受损、唾液分泌减少所致,而腺体,尤其是涎腺的分泌调控作用与AQP5的异常分布密切相关[17]。根据本次实验结果,清热润燥口服液可增加BALF中AQP5的表达。本次实验中与正常组比较,模型组BALF中IL-13含量明显增加,证明气道黏液高分泌的小鼠IL-13值是升高的,低剂量组小鼠BALF中的IL-13含量比模型组低,地塞米松药物组及清热润燥中、高剂量组中的IL-13明显降低,结合本次实验MUC5AC及AQP5的结果,提出IL-13与MUC5AC值呈正相关,与AQP5值呈负相关的设想,但其具体的作用机制及通路有待研究。
哮喘属于中医“哮病”的范畴,《症因脉治·喘促》:“哮病之因,痰饮留伏,结成窠臼,潜伏于内,偶有七情之犯,饮食之伤,或外有时令之风寒束其肌表,则哮喘之症作矣”。“痰”常由咳吐、咳咯而出,中医有“肺为娇脏,喜润恶燥”之说,或因环境等“外燥”原因、或因饮食、遗传等“内燥”原因或内外原因共同致病导致“内外合燥”伤及肺脏,灼伤肺津,肺失宣肃,上焦水津不能通降与布散,便停聚于肺化为痰饮,痰伏于肺,成为发病的潜在“夙根”,此类“伏痰”色黄或白而黏稠,坚而成块[18],遇各类诱因即发,但因其坚硬难排,故可见干咳、痰难咯等症状。所以从减少痰液生成、促进痰液排出,通过“润养”与“通利”[3]治疗本病。
润养,一取其润养脾胃之效,其中沙参、麦冬合用,益气且养胃阴,脾胃为人体气机升降的枢纽,脾胃功能正常则中气盛,津液上可输布于肺,配合白扁豆、山药等补脾、实脾之品起“培土生金”之效,下能滋肾,以达“金水相生”之功[19]。肺肾互资,阴津充盛,达“润养”以化燥。二取其润养肺脏之效,肺为娇脏,喜湿恶燥,方中桑叶为君药,苦能润燥、甘能生津,其性清轻上扬,其形同肺叶,故最能入肺经润肺燥,津液滋润肺部,使伏痰、燥痰得以润化,而得以排出。通利,其一通利气道得伏痰能排出,其二通利水道,使津液能润布各个脏腑。除了健脾胃、滋润肺肾使津液得以布输之外,甘寒之芦根为佐药,清热生津,利湿通利,宣肺气于上而通达水湿于下,芦根及薏苡仁、冬瓜仁三药合用通利三焦,浙贝母配以陈皮行气利痰,使痰得以“通利”随气化外达,气道通畅,肺之宣降功能正常,气可载津,津液输布有则;水道通畅,津液充足以助气化,既可正常布散津液又可使邪外排,是以本方以辛凉甘润之法润养脾胃、资肺津肾阴,通利气道水道使运化有则,气道顺畅,津液得以输布、痰浊得以排出。
本实验发现本药对于慢性哮喘或者哮喘合并慢性阻塞性肺疾病,尤其是以干咳、痰液难以咯出为主要症状的患者效果更佳,由此提出,清热润燥口服液润养与通利的理论,是通过其激活上皮细胞中AQP5的表达,改善了气道的水液代谢,提高了肺组织湿的比重,从而稀释痰液使其稀薄而易于排出,是以显示了“润养”气道,稀释痰液的作用,同时本药可以拮抗哮喘气道炎症反应、减少MUC5AC的生成,通过减少气道黏液的分泌起到“通利”气道的作用,从而有效缓解哮喘发作时的咳嗽、喘息等症。
综上,本次实验初步探讨“清热润燥口服液”对哮喘小鼠BALF中MUC5AC以及AQP5的影响,证明本方可以通过抑制MUC5AC表达以及增强AQP5的表达来抑制气道黏液高分泌、改善气道炎症以及调节气道的水液代谢失衡,本次实验的结果也部分符合“润养”与“通利”的治疗理论,但本次测试的因子较少,故其具体作用机制及通路有待进一步研究。
