合并红细胞增多症对高原高血压患者脑出血风险的影响
2020-12-15小平措
炜 桑,小平措
脑出血是高血压患者严重的并发症,是造成高血压患者死亡的主要原因[1]。尤其是高原高血压患者,因患者处于高原生存环境,伴发红细胞增多症(polycythemia,PV)概率显著增加,其血液粘度增加为高原高血压伴发脑出血的重要诱因[2]。但有关PV与高原高血压脑出血的具体机制及定量分析,临床却鲜有报道。本研究回顾性分析了西藏军区总医院150例高原高血压患者临床资料,分析PV与高原高血压患者伴发脑出血的关系,为临床诊疗提供参考。现报道如下。
1 资料与方法
1.1 临床资料 回顾性分析西藏军区总医院2018年4月至2019年4月间收治的150例高原高血压患者临床资料,将其分为观察组(54例,高原高血压合并PV)和对照组(96例,高原高血压未合并PV者)。观察组患者中男性34例,女性20例;年龄(40.29±9.72)岁;体质量指数(20.34±1.79)kg/m2;高血压分级:1级25例,2级14例,3级15例。对照组患者中男性52例,女性44例;年龄(39.48±11.06)岁;体质量指数(20.12±2.01)kg/m2;高血压分级:1级43例,2级25例,3级28例。2组患者基本资料差异无统计学意义(P>0.05)。
纳入标准[3]:(1)患者收缩压(systolic pressure,SBP)>140 mmHg(1 mmHg=0.133 kPa),舒张压(diastolic pressure,DBP)>90 mmHg;(2)患者年龄>18岁,均世居于高原地区;(3)患者病历资料完整。排除合并有严重心肺疾病、入院前已接受PV相关治疗及继发性高血压者。
1.2 方法 根据中华医学会血液学分会白血病淋巴瘤学组推荐标准对PV进行诊断[4],主要标准如下:(1)血红蛋白(hemoglobin,Hb):男性>165 g/L,女性>160 g/L;(2)活检可见三系高度增生伴多形性巨核细胞;(3)Janus激酶2突变。次要标准:血清内源性促红细胞生成素(erythropoietin,EPO)低于正常值。满足3项主要标准或2项主要标准+次要标准即可诊断为PV。
患者入院后采用美国迪姆DMS300-4A型24 h动态心电图仪监测患者24 h内平均心率,计算24 h内正常RR间期标准差(standard deviation of 24-hour normal RR interval,SDNN)、24 h内夜间相邻RR间期之差均方根(24-hour mean heart rate and the adjacent RR interval at night,rMSSD)及24 h内每5 min节段平均正常RR间期标准差(standard deviation of average RR interval in 5-min segments of 24 hours,SDANN)。同时采用日本尼士DS-250动态血压监测仪计算24 h平均SBP(24 h SBP)和24 h平均DBP(24h DBP)。根据夜间血压均值下降程度记录杓型血压节律发生率,即夜间血压均值较日间血压下降10%~20%即可判定为杓型血压节律[5]。
在患者入院后24 h内收集肘静脉血5 ml,采用iChem-320型全自动生化分析仪检测2组患者活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)、凝血酶时间(thrombin time,TT)及纤维蛋白原(fibrinogen,Fib)水平。检测患者Hb水平。脑出血以颅内计算机断层扫描(computed tomography,CT)和核磁共振成像(magnetic resonance imaging,MRI)检查发现出血灶为准[6]。
1.3 统计学处理 选用SPSS 22.0软件对数据进行处理,计量资料以均数±标准差(x±s)表示,组间比较行t检验,计数资料以百分比表示,组间比较行χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 2组患者24 h心率相关指标情况比较 观察组24 h平均心率和24 h rMSSD均低于对照组,24 h SDNN和24 h SDANN均高于对照组(P<0.05)。见表1。
2.2 2组患者24 h动态血压情况比较 观察组24 h SBP和24 h DBP均高于对照组,ΔSBP、ΔDBP及杓型血压率均低于对照组(P<0.05)。见表2。

表1 观察组与对照组高原高血压患者24 h心率相关指标情况比较(x±s)

表2 观察组与对照组高原高血压患者24 h动态血压比较(x±s)
2.3 2组患者凝血四项情况比较 观察组患者APTT、PT及TT均低于对照组,Fib高于对照组(P<0.05)。见表3。

表3 观察组与对照组高原高血压患者凝血四项情况比较(x±s)
2.4 Hb判断高原高血压发生脑出血的价值分析 观察组脑出血28例,脑出血率51.85%;对照组26例,脑出血率27.08%。2组患者脑出血发生率对比,差异具有统计学意义(χ2=9.202,P=0.002)。以是否发生脑出血为状态变量,以患者Hb水平为检验变量,绘制ROC曲线(图1),结果显示Hb预测高原高血压患者发生脑出血的AUC为0.790(S.E.=0.036,P<0.01,95%CI=0.719~0.860),灵敏度0.907,特异度0.594,最佳截断值175.50 g/L。
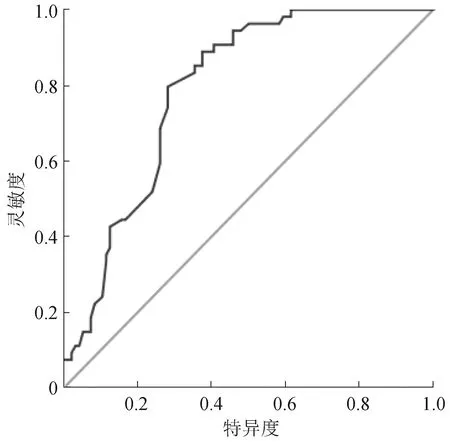
注:Hb预测高原高血压伴发脑出血风险的ROC分析,灵敏度为0.907,特异度为0.594图1 Hb预测高原高血压伴发脑出血的ROC分析
3 讨论
高血压脑出血是因脑实质微动脉长期处于高血压状态,使微血管逐渐硬化,导致最终血管破裂形成的出血性疾病。部分患者还可能诱发脑梗死和脑疝,引发不良预后[7]。高原地区高血压患者因长期处于寒冷生存环境,红细胞代偿性增加,使PV概率显著升高,进而导致患者血液粘度和红细胞压积增加[8]。对于合并PV的高原高血压患者,更易发生脑出血。本研究显示观察组24 h SBP和24 h DBP均高于对照组,可能为PV的发生使组织微循环障碍所致[9]。格桑顿珠等[10]认为合并PV的患者血液粘稠度更高,随着PV进展,导致炎症因子分泌增加,并与高血压发挥协同作用,破坏血管内皮细胞,增加出血概率。
本研究通过对比脑出血与未出血的高原高血压患者24 h心率特点,发现观察组24 h平均心率和rMSSD均低于单纯高血压患者,可能因PV的发生增强了高原高血压患者交感神经功能,使夜间副交感神经活性被抑制,进而造成交感神经功能紊乱[11],导致心脏节律失调和氧化应激异常[12],进而加快血管硬化,增加脑出血等心脑血管事件发生的风险。
本研究结果显示2组患者凝血四项差异明显,与周阳等[13]报道一致,提示PV的发生可能改变患者凝血机制。PV发生后,机体出现纤溶系统亢进和血小板黏附率降低的特点[14],即成为凝血障碍和血管内皮损伤的重要诱因,使脑出血几率成倍增加。钟欣等[15]认为高原高血压患者Hb分子结构和类型异化,随着Hb水平升高,血小板数量逐渐减少,使红细胞聚集性能显著降低[16],增加脑出血风险,而Hb水平异常升高是诊断PV的重要依据。因而,本研究采用ROC分析Hb与脑出血风险的定量关系,结果显示Hb预测高原高血压的AUC为0.790,灵敏度达0.907,提示当Hb超过175.50 g/L时应高度警惕脑出血风险,及时采取措施控制Hb水平。
综上所述,PV将增加高原高血压患者脑出血风险,可能与PV造成交感神经兴奋性紊乱和血压节律失调有关,监测Hb水平有助于预测脑出血风险。
