热加工肉制品中杂环胺的分析检测技术研究进展
2020-12-14岑明桦许莹盈叶培辉赵燕胡均鹏冼燕萍曾晓房白卫东董浩
岑明桦 许莹盈 叶培辉 赵燕 胡均鹏 冼燕萍 曾晓房 白卫东 董浩
摘 要:杂环胺是一类杂环芳香族化合物,是富含蛋白质的食物(如肉类和鱼类等)在高温和长时间烹饪时产生的。杂环胺具有强致癌性和致突变性,能在动物乳腺、结肠和肝脏等多个器官中引发肿瘤。长期食用含有杂环胺的食物将对人体健康产生极大危害,增加患癌风险。因此,热加工肉制品中杂环胺的监控和检测尤为必要。本文简述杂环胺的种类、理化性质、毒性、形成和影响因素,重点综述热加工肉制品中杂环胺的分析检测方法,包括溶剂萃取、固相萃取、固相微萃取等样品前处理方法以及气相色谱、气相色谱-质谱、高效液相色谱、液相色谱-质谱等仪器检测方法,最后对热加工肉制品中杂环胺检测分析的发展趋势作出展望。
关键词:肉制品;杂环胺;检测技术;形成;影响因素
Abstract: Heterocyclic aromatic amines (HAAs) are a class of heterocyclic aromatic compounds that are produced when protein-rich foods (such as meat and fish) are cooked at high temperatures for long periods of time. HAAs are highly carcinogenic and mutagenic and can cause tumors in multiple organs such as the mammary gland, colon and liver of animals. Long-term consumption of foods containing HAAs will cause great harm to human health and increase the risk of cancer. Therefore, it is strongly necessary to monitor and analyze the HAAs contents in heat-processed meat products. This article briefly describes the types, physicochemical properties and toxicity of HAAs, as well as the mechanism for and the factors affecting their formation, with a focus on reviewing the currently available analytical methods for HAAs in heat-processed meat products including the sample pretreatment methods of solvent extraction, solid-phase extraction and solid-phase micro-extraction, as well as the instrumental methods of gas chromatography (GC), gas chromatography-mass spectrometry (GC-MS), high performance liquid chromatography (HPLC) and liquid chromatography-mass spectrometry (LC-MS). Finally, an outlook on future trends in the analysis of HAAs in heat-processed meat products is presented.
Keywords: meat products; heterocyclic aromatic amines; analytical techniques; formation; factors
DOI:10.7506/rlyj1001-8123-20200608-146
中圖分类号:TS201.2 文献标志码:A 文章编号:1001-8123(2020)09-0096-09
引文格式:
岑明桦, 许莹盈, 叶培辉, 等. 热加工肉制品中杂环胺的分析检测技术研究进展[J]. 肉类研究, 2020, 34(9): 96-104. DOI:10.7506/rlyj1001-8123-20200608-146. http://www.rlyj.net.cn
CEN Minghua, XU Yingying, YE Peihui, et al. Progress in analytical techniques for heterocyclic aromatic amines in heat-processed meat products[J]. Meat Research, 2020, 34(9): 96-104. DOI:10.7506/rlyj1001-8123-20200608-146. http://www.rlyj.net.cn
杂环胺是高温和长时间烹饪富含蛋白质的食物时产生的一类杂环芳香族化合物[1-2]。1977年,Minako等[3]在烤鱼和烤牛肉被炭化的表层物质中检测出杂环胺类化合物,并发现其具有强烈的致癌和致诱变性。大量动物实验表明,杂环胺的强烈致癌性可能会对人体健康造成严重的危害。因此,热加工肉制品中杂环胺的检测和监控尤为必要[1,4-7]。
热加工肉制品中的杂环胺含量低、种类多,且肉制品中通常含有大量的油脂、蛋白质、色素等不同类型杂质,因此,高效、准确检测肉制品中的杂环胺类化合物仍面临诸多挑战。虽然在进行仪器检测之前通常会对样品进行适当的预处理,但由于肉制品中的杂环胺以痕量水平存在,检测过程中又极易受到其他无法去除的杂质干扰,因此,探索高效、快速、高灵敏性和高选择性的提取、净化和检测方法对杂环胺的分析和研究尤为重要。
基于此,本文系统综述近年来不同热加工肉制品基质中杂环胺的提取、净化和检测方法,对其性能进行比较,并展望了杂环胺分析方法的发展趋势,旨在为后续肉制品及其他食品中杂环胺的分析检测提供较为系统的借鉴和参考。
1 杂环胺简介
1.1 杂环胺的种类
目前,国内外学者已从各类食品中检测和鉴别出30多种杂环胺。根据化学结构的不同,杂环胺可分为氨基咪唑氮杂环芳烃(aminoimidazo azaarents,AIAs)和氨基咔啉两大类[8-9]。AIAs一般是在100~300 ℃的温度下形成的,故又称为“热致型杂环胺”;而氨基咔啉类杂环胺则是蛋白质或氨基酸在300 ℃以上的高温条件下发生热解反应后形成的,故又称为“热解型杂环胺”[10]。
1.2 杂环胺的危害
杂环胺具有较强的致癌性和致突变性[1,4-7],国际癌症研究机构已将2-氨基-3-甲基咪唑并[4,5-f]喹啉(2-amino-3-methyl-imidazo[4,5-f]-quinoline,IQ)列为人体很可能致癌物(2A级),将2-氨基-1-甲基-6-苯基-咪唑[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP)、2-氨基-9H-吡啶并[2,3-b]吲哚(2-amino-9H-pyrido[2,3-b]indole,AαC)、2-氨基-3-甲基-9H-吡啶并[2,3-b]吲哚(2-amino-3-methyl-9H-pyrido[2,3-b]indole,MeAαC)、2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉(2-amino-3,4-dimethylimidazo[4,5-f]quinoline,MeIQ)、2-氨基-3,8-二甲基咪唑并[4,5-f]喹喔啉(2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline,MeIQx)、3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole,Trp-P-1)和3-氨基-1-甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1-methyl-5H-pyrido[4,3-b]indole,Trp-P-2)等列为人体可能致癌物(2B级)[6]。
1.3 杂环胺的形成
1.3.1 喹啉和喹喔啉类杂环胺的形成
美拉德反应是形成喹啉和喹喔啉类杂环胺的重要途径,肉中的肌酸、肌酸酐、氨基酸和糖等是其形成的主要前体物质[11]。喹啉类、喹喔啉类杂环胺主要是利用美拉德反应将还原糖和氨基酸裂解成吡啶和吡嗪,吡啶和吡嗪与肌酸酐在加热条件下发生反应,经环化、脱水、去饱和作用后,生成咪唑喹啉和咪唑喹喔啉,这类杂环胺的形成机制已通过使用14C标记的葡萄糖得以确认和验证[12-13]。Pearson等[14]进行了一系列实验后提出,烷基吡啶自由基与肌酸酐反应后可生成IQ和MeIQx等杂环胺,而二烷基吡嗪自由基与肌酸酐发生反应后则可生成MeIQx和2-氨基-3,4,8-三甲基咪唑并[4,5-f]喹喔啉(2-amino-3,4,8-trimethyl-imidazo[4,5-f]-quinoxaline,DiMeIQx)等杂环胺。
1.3.2 氨基咔啉类杂环胺的形成
目前研究发现主要有2 种形成氨基咔啉类杂环胺的方式[11],其中一种是通过酪蛋白和大豆球蛋白发生热解反应后形成,另一种则是由游离氨基酸,如色氨酸、鸟氨酸、苯丙氨酸等经热解反应形成。Yaylayan等[15]通過模拟高温加热过程中色氨酸的裂解过程发现色氨酸发生Amadori分子重排,反应所得的产物经脱水、消去反应后生成带正电、共轭的氧离子中间体,随后该中间体发生分子间的取代反应,最后生成β-咔啉。与其他氨基咔啉类杂环胺不同,9H-吡啶并[3,4-b]吲哚(9H-pyrido[3,4-b]indole,Norharman)和1-甲基-9H-吡啶并[3,4-b]吲哚(1-methyl-9H-pyrido[3,4-b]indole,Harman)的形成反应可以在较低温度下进行,主要发生在加工肉制品中,特别是熟火腿和香肠[16]。
1.3.3 PhIP的形成
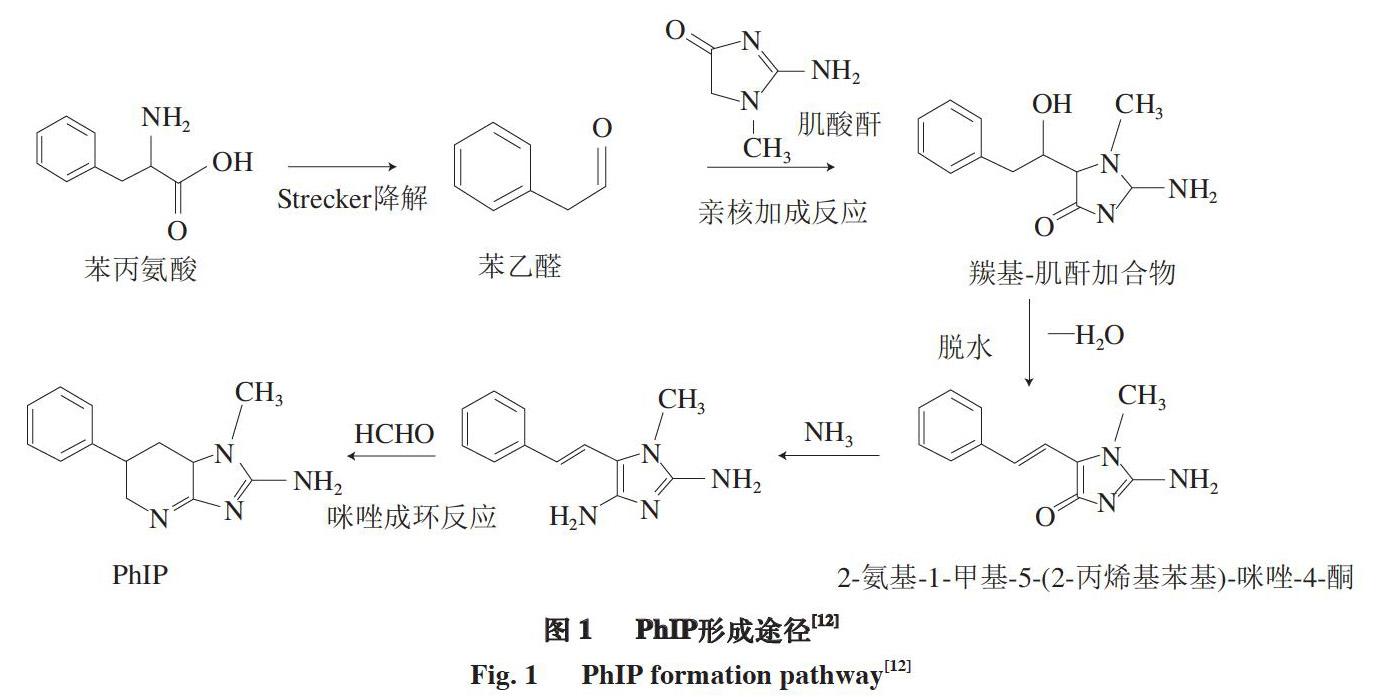
Shioya等[17]通过加热含有肌酸酐、苯丙氨酸和葡萄糖的混合物,发现生成了杂环胺PhIP,该研究表明,形成PhIP的前体物质主要有肌酸酐和苯丙氨酸。苯丙氨酸发生热解反应后生成的苯乙醛可与肌酸酐发生一系列反应,最后生成PhIP(图1)[12]。苯丙氨酸首先通过Strecker降解得到苯乙醛,接着发生醇醛缩合反应,苯乙醛与肌酸酐结合生成羰基-肌酐加合物,生成的羟醛缩合产物最后与氨和甲醛通过席夫碱反应形成PhIP咪唑环[18-20]。
1.4 杂环胺形成的影响因素
1.4.1 温度和时间
影响热加工肉制品中杂环胺形成的2 个重要因素是温度和时间。在杂环胺形成过程中,其含量和种类随着温度的升高和时间的延长而增多,且相比温度,时间对杂环胺形成的影响更大[21]。Balogh等[22]将牛肉饼置于175、200、225 ℃等温度条件下,每面油炸6~10 min,研究不同加工温度和加工时间是否会对油炸牛肉饼中杂环胺的含量造成影响,结果发现,不同的加工时间和加热温度对杂环胺形成的影响不同,杂环胺含量随着温度的升高、时间的延长而不断增多,而且在形成的杂环胺中,PhIP含量随时间和温度的变化最为明显。Nor Hasyimah等[23]也有类似的研究,他们研究不同加工温度条件下烤牛肉中的杂环胺发现,随着温度的升高,杂环胺的总含量也有明显升高的趋势,且在150 ℃时形成量最低。
1.4.2 前体物
杂环胺由肉制品中的氨基酸、肌酸、肌酸酐和碳水化合物等前体物在高温条件下经过复杂的反应生成[24-25],且最近研究发现,游离氨基酸与杂环胺形成的相关性比还原糖或肌酸酐与杂环胺形成的相关性更强[26]。Lee等[27]将3 种单糖、肌酐和20 种氨基酸添加到猪肉汁中,研究这些前体物是否会影响杂环胺的形成,结果表明,甘氨酸、酪氨酸、丙氨酸、苏氨酸和谷氨酰胺5 种氨基酸以及核糖和葡萄糖2 种单糖均能增加杂环胺的生成量。
廖国周等[28]也通过对鸡肉、鸭肉、鹅肉、羊肉等不同肉制品中的前体物含量进行研究,探索其是否会对杂环胺的形成产生影响,发现PhIP的生成量随葡萄糖含量的升高而不断减少,而前体物对不同种类杂环胺生成的影响也不尽相同。
1.4.3 脂肪含量和原料肉形态
脂肪对杂环胺形成的作用方式有两方面,一个是化学层面,主要是通过脂肪氧化后所生成的自由基影响极性杂环胺的形成[29];另一个是物理层面,即脂肪通过加快传热速率来提高反应效率,从而影响杂环胺的形成[30]。原料肉的形态和大小也会对杂环胺的形成产生一定影响,郭海涛等[31]研究不同质量和形态的原料肉对杂环胺形成的影响,结果表明,随着羊肉饼质量的不断增大,极性杂环胺和非极性杂环胺的含量均有不同程度下降,相对来说,极性杂环胺含量下降幅度较为明显,而当羊肉饼处于被绞碎的形态时所形成的极性杂环胺含量明显增多。
1.4.4 其他
不同的热加工处理方式也会影响杂环胺的形成。Wang等[32]研究发现,杂环胺的种类与油炸次数有关,鱼肉饼经过5 次油炸后可从其中检测到6 种杂环胺,而油炸1 次后仅能检测到3 种杂环胺。王震等[33]研究发现,老汤经过反复卤煮后也会增加其中的杂环胺含量。糖同样也会影响杂环胺的形成,这是由于糖是进行美拉德反应的必需底物,在高糖条件下更容易发生美拉德反应,生成的产物会与肌酸酐發生反应,从而抑制杂环胺的形成。韩中惠等[34]研究烤肉中的糖对杂环胺形成的影响,结果表明,不同种类的糖均可抑制PhIP、IQ、MeIQ和MeIQx等杂环胺的形成。
2 热加工肉制品中杂环胺的检测分析
2.1 样品前处理方法
由于热加工肉制品的基质复杂性,且其中的杂环胺以痕量水平存在,导致热加工肉制品中杂环胺的分析检测十分困难。采用适当、高效、高选择性的样品前处理方法是准确检测热加工肉制品中杂环胺的前提和保障。
2.1.1 样品提取方法
2.1.1.1 溶剂萃取法
溶剂萃取法又称液-液萃取法,是一种利用待测物在2 种互不相溶的溶剂之间溶解度不同的原理,将待测物质从已溶解待测物的溶剂中用另一种溶剂分离出来的方法[35]。溶剂萃取法是分析检测热加工肉制品中杂环胺最常用的样品预处理方法。一般来说,热加工肉制品中的杂环胺通常采用氢氧化钠、盐酸、水等无机溶剂或丙酮、甲醇、乙酸乙酯、二氯甲烷等有机溶剂进行萃取[36]。样品经不同的溶液均质处理后,所用的萃取液也各不相同。例如,样品若是在甲醇、丙酮或乙酸乙酯等有机溶液中均质处理,则用盐酸作为提取液进行萃取[37]。Manful等[38]采用甲醇处理反刍动物肉样品,再利用加压加速溶剂萃取器成功萃取样品中的杂环胺,最后通过超高效液相色谱-质谱法对杂环胺进行检测分析。潘晗[39]将酱肉样品用氢氧化钠溶液处理后,用二氯甲烷萃取分离其中的Norharman、Harman、MeIQx、PhIP、4,8-DiMeIQx和AαC 6 种杂环胺。溶剂直接萃取法则可用于分析水和酒等基质较简单的样品。例如,王敏等[40]将葡萄酒直接用氢氧化钠溶液和乙酸乙酯进行萃取,分离出其中的14 种杂环胺。
2.1.1.2 固相微萃取(solid-phase microextraction,SPME)
SPME技术是在熔融石英纤维表面涂上一层固定相,利用其对样品中待测组分进行富集纯化的一种方法[41-42]。SPME方法最大的优点是在对待测物进行分析的过程中能同时进行萃取和浓缩。SPME技术是一个高效率的前处理方法,使用该方法对杂环胺进行检测时所用的样品量很少,且能极大加快检测、分析速率。Cárdenes等[43]建立烤肉中9 种杂环胺的SPME和高效液相色谱(high performance liquid chromatography,HPLC)分析方法,通过研究对比SPME中的解吸时间、解吸模式、解吸溶剂组成、pH值、离子强度和样品中甲醇含量等参数,评估碳蜡模板树脂(carbowax-templated resin,CW-TPR)、碳蜡二乙烯苯(carbowax-divinylbenzen,CW-DVB)、聚(二甲基硅氧烷)-二乙烯基苯(poly(dimethylsiloxane)-divinylbenzene,PDMS-DVB)和聚丙烯酸酯(polyacrylate,PA)4 种纤维涂层对杂环胺的萃取净化能力,研究表明,CW-TPR对除Norharman外的杂环胺具有很好的萃取效果,PDMS-DVB和PA的萃取能力较弱,而CW-DVB对所有杂环胺均具有很强的萃取能力,但是,如果样品中存在甲醇,CW-DVB将不适用于SPME-HPLC法分析杂环胺,因此认为CW-TPR更适合于杂环胺的分析检测。
2.1.1.3 其他前处理方法
超临界流体萃取(supercritical fluid extraction,SFE)和微波辅助萃取(microwave-assisted extraction,MAE)等前处理方法也常被用于热加工肉制品中杂环胺的分析检测[37,41]。SFE是一种形式新颖的萃取技术,采用超临界流体作为萃取剂,将待测组分从液体或固体样品中萃取出来,从而完成样品的分离纯化。一般来说,SFE技术仅适用于对油烟物质中的杂环胺进行萃取,而对具有固体基质的其他样品而言,通过超临界CO2萃取其中的杂环胺效率较低。但是也有例外,在温度55 ℃、压力41.37 MPa条件下,采用超临界CO2和体积分数10%乙醇溶液处理样品,样品中的喹啉类和喹喔啉类杂环胺具有较高的回收率[44]。MAE是一种利用微波加热来加速萃取的方法。MAE技术的提取速率、效率和质量均优于其他常规技术。Aeenehvand等[45]开发了一种基于MAE和分散液-液微萃取并采用HPLC法测定汉堡肉饼中3 种极性杂环胺的分析方法,该方法优化了控制微萃取过程性能的有效参数,且简单、快速,选择性和灵敏度高,在测定汉堡肉饼中的杂环胺时具有良好的富集因子和检测限。
2.1.2 样品净化方法
2.1.2.1 固相萃取(solid phase extraction,SPE)
SPE技术是一种分离效果很好的样品预处理方法。与传统的溶剂萃取方法相比,SPE的优势是可以提高待测物质的回收率,从而更加有效分离出待测物和干扰成分,其选择性也优于溶剂萃取法,一般来说不需要像溶剂萃取一样需与其他样品预处理方法结合使用才能发挥较好效果[46]。SPE是杂环胺分析检测中最常用的一种样品前处理方法,使用该方法时,选用合适的吸附剂非常重要,应当根据被分析物的性质和结构进行选择,硅藻土、蓝棉、阳离子交换树脂、人造丝、C18填料、树脂型吸附剂、混合型阳离子交换固相萃取吸附剂等吸附材料已被广泛应用于杂环胺检测[47-50]。李可等[51]采用SPE技术对酱卤鸡腿老汤样品进行提取,通过超声提取、离心、固相萃取小柱富集等,最后成功萃取出其中的10 种杂环胺。魏晋梅等[52]采用氢氧化钠-甲醇溶液结合超声提取处理样品,成功萃取了卤肉制品中的PhIP、MeIQ、MeIQx、4,8-DiMeIQx和7,8-DiMeIQx 5 种杂环胺。Zhang Yuan等[53]则用SPE结合超临界流体色谱-三重四极杆质谱,开发了一种新颖、简单且灵敏的肉制品中14 种杂环胺的分析方法。赵磊等[54]采用SPE法提取烤鸡肉中的5 种杂环胺,并结合超高效液相色谱-串联质谱法对杂环胺进行定量分析。当使用单一固相萃取柱净化样品的效果不佳时,可采用多级净化的方式,结合多种不同的吸附剂分步进行,就能达到较好的净化效果。例如,肖维等[55]用NaOH溶液处理鱼制品并经超声提取后,将提取液用硅藻土和MCX固相萃取柱进行多级净化富集,最后分离出其中的8 种杂环胺。
2.1.2.2 凝胶渗透色谱(gel permeation chromatography,GPC)
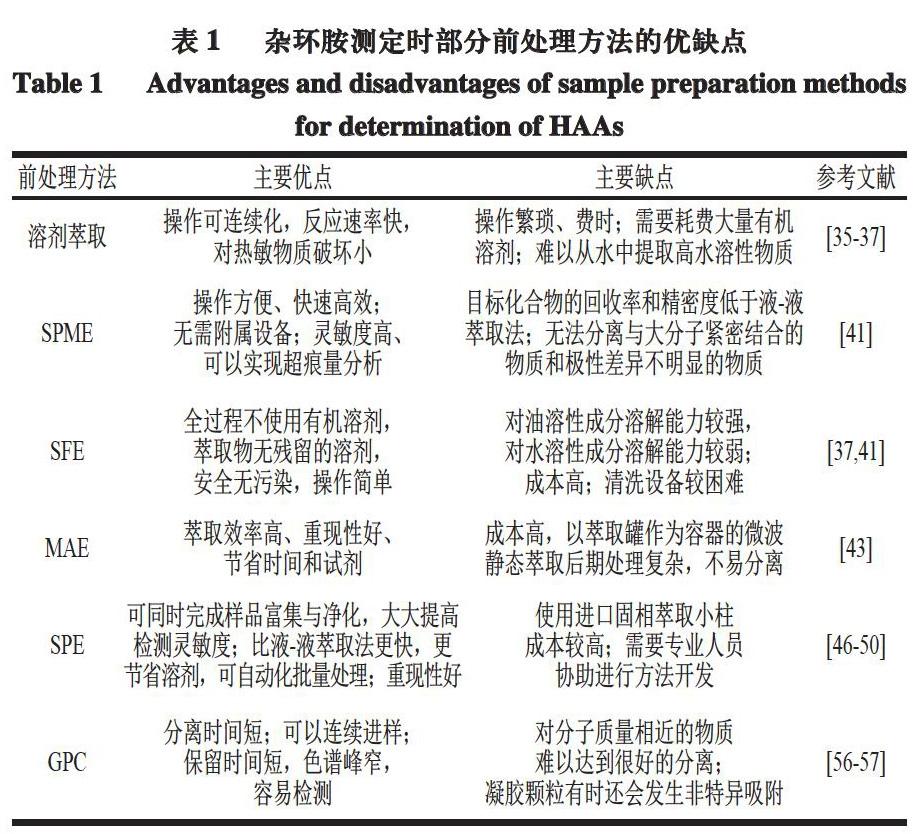
GPC是以多孔凝胶为固定相,利用凝胶孔的空间尺寸效应,使大小不同的分子按照分子质量从大到小的顺序洗脱下来,以实现样品组分分离的一种方法。GPC可以达到净化的目的,且具有色谱柱污染小、脱盐等优点[56]。目前GPC在农药残留检测方面的应用较多,而在杂环胺检测领域则研究较少。使用该方法处理基质复杂或含有较多杂质的样品时,虽然可以除去大部分大分子杂质,但是与杂环胺分子大小相近的杂质却无法去除,因此需要对剩余的杂质进行进一步净化,以防止杂质污染进样口或柱头以及产生基质增强效应等问题[57]。GPC与吸附色谱法或其他净化技术联用时,可以达到彻底净化样本杂质的目的[58]。上述样品前处理方法的优缺点如表1所示。
2.2 杂环胺的仪器检测方法
随着科学技术的不断发展进步,杂环胺的仪器检测手段越来越多[59]。目前,热加工肉制品中杂环胺的分析检测最常用的方法有气相色谱(gas chromatography,GC)、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)、HPLC、液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)及其他检测方法。
2.2.1 GC
GC是一种分离效率高且流动相为气体的色谱分离方法。由于不同的物质具有不同的沸点、吸附能力和极性,所以不同的物质流经色谱柱的时间也不同,GC就是利用这个特点实现对混合物的分离。使用GC检测肉制品中的杂环胺具有一定局限性,因为绝大多数的杂环胺都呈极性且不易挥发,它们很容易就会被吸附在色谱柱和进样器上,从而导致峰宽、拖尾等许多峰型问题,最后很难检测出样品中低含量的杂环胺[60]。因此,通常需要先将样品衍生化然后再进行色谱检测,因为经衍生化处理后的杂环胺不仅能极大提高挥发性和分离度,还能降低其极性。常用的衍生化方法有酰化衍生化和硅烷化衍生化等。
2.2.2 GC-MS
GC-MS具有GC的优良分离性和MS的高选择性优势,又克服了它们各自的缺点。由于检测所需的样品量很少,检出限可达到纳克级别,而且结果准确可靠,因此,GC-MS可用于检测较低含量的杂环胺,或用于检测分析复杂基质样品中的杂环胺。采用GC-MS检测加工肉制品中的杂环胺同样需要对样品进行衍生化处理,而且该方法不能检测热不稳定的化合物,这就在一定程度上限制了需要检测的杂环胺种类。Casal等[49]建立了GC-电子冲击质谱法分析食品中12 种杂环胺的衍生方法,这种简单、快速、准确的衍生化方法适用于常规分析。Warzecha等[61]通过GC-MS法对猪肉、鸡肉和牛肉等10 个肉类样品中的杂环胺进行分析,确定了这些样品中含有IQ、MeIQx、MeIQ、4,8-DiMeIQx和PhIP 5 种杂环胺,且它们的总含量为1.9~77.4 ng/g。
2.2.3 HPLC
HPLC是最常见的杂环胺分析方法之一[62-68]。杂环胺普遍具有较强的紫外吸收能力,因此在热加工肉制品中杂环胺的检测分析中最常用的检测器是紫外检测器。但也有部分杂环胺具有荧光特性,这时可采用HPLC-荧光检测器(fluorescence detector,FLD)法进行检测,可提高其在分析检测过程中的灵敏度[62]。李进等[63]建立了一种检测卤肉中β-咔啉类杂环胺含量的SPE-HPLC方法,样品经二氯甲烷萃取后,采用FLD进行测定,结果表明,该方法的检出限为0.17~0.30 ng/g,加标回收率为81.92%~93.37%。部分杂环胺还具有电化学氧化性,由于这类杂环胺的化学结构较稳定,相比于其他化合物氧化性较低,所以对其进行检测分析时通常采用HPLC-电化学检测法[59]。Zhang Qianchun等[64]建立了一种新型在线SPME-HPLC方法来测定烤牛肉和羔羊肉中的5 种痕量杂环胺,方法的回收率为74.3%~119.0%,检出限极低,为0.10~0.15 ng/kg。郑多多等[65]利用HPLC与紫外-荧光检测器串联的方法测定羊肉和排骨烧烤制品中的杂环胺含量,结果表明,该方法的回收率为74.06%~93.77%,测得PhIP、Norharman、Harman、AαC和IQ等多種杂环胺在其相应的质量浓度范围内线性关系良好,相关系数均大于0.993。Mohammadi等[66]使用高效微萃取技术与反相HPLC结合的方法对烤肉中的4 种杂环胺进行定量分析,结果表明,该方法的检出限为4.8~5.3 ng/g,回收率为89%~97%,相对标准偏差为6.5%~8.3%。
2.2.4 LC-MS
LC-MS具有很高的灵敏度和选择性,也是目前用于检测杂环胺最常见的方法之一。相比于GC-MS技术,LC-MS不需要衍生化就能对复杂基质样品中的杂环胺进行定性和定量分析。目前,结合高灵敏性质谱检测器的LC-MS在食品中杂环胺的分析检测方面得到越来越多的应用[69-75]。张晨霞等[72]建立了一种检测油脂和油炸食品中7 种杂环胺的超高效液相色谱-串联质谱方法,结果表明,杂环胺在油脂和油炸食品中的回收率为64.31%~113.80%,检出限为0.01~0.14 μg/kg,定量限为0.09~0.38 μg/kg。徐琦等[73]对鱼肉制品中的12 种杂环胺进行同时检测,建立了超高效液相色谱-电喷雾串联质谱法,结果表明,12 种杂环胺在检测时均能快速分离,方法检出限为0.3~1.0 μg/kg,回收率为42.98%~125.00%,该方法操作方便,是同时快速检测鱼肉制品中多种杂环胺的有效手段。Lee等[74]建立HPLC-MS方法测定猪肉、扁平鱼等7 种食品基质中多种杂环胺的残留量,该方法的检出限为0.009~2.350 ng/g,回收率也较高,为67.5%~119.6%。戴明[75]采用超高效液相色谱-串联质谱法检测多种热加工食品中14 种杂环胺的含量,结果表明,这些热加工食品中2-氨基-1,6-二甲基咪唑并吡啶(2-amino-1,6-dimethylimidazo[4,5-b]-pyridine,DMIP)、IQ、Norharman、Harman等杂环胺的含量较高,方法检出限为0.08~1.10 μg/kg,回收率为51.1%~118.5%,相对标准偏差为0.9%~9.6%,该方法操作简便快捷,适用于大规模食品中杂环胺的在线分析。
2.2.5 酶联免疫吸附测定法(enzyme-linked immunesorbent assay,ELISA)
ELISA是一种在免疫酶技术的基础上发展起来的新型免疫测定技术,现已成为分析化学领域中的研究重点。ELISA主要是利用抗原抗体特异性结合的原理,让抗体与酶复合物结合,然后通过颜色反应来进行定性或定量分析[76-77]。早在1988年,Vanderlaan等[78]就采用ELISA法分析了牛肉样品中的IQ、MeIQx和PhIP 3 种杂环胺。Sheng Wei等[79]开发了一种简单且具有较高选择性和灵敏性的直接竞争ELISA法,该方法可用于测定炸牛肉、炸猪肉和鱼肉松样品中的IQ,方法检出限为2.7~3.3 μg/kg,回收率为84.96%~116.23%,相对标准偏差为4.96%~17.26%,该免疫分析方法可对实际加工食品中的IQ进行经济、有效、特异性强、准确、可靠的定量检测分析。赵秋霞等[80]建立一种间接竞争ELISA法对油炸牛肉和肉松中的8 种杂环胺进行检测分析,方法检出限为12.07 μg/kg,回收率为91.18%~98.64%,可实现多种杂环胺的同时快速检测和杂环胺总量的检测,为热加工肉制品中杂环胺的检测提供了一种简单、准确、快速的检测方法。
2.2.6 荧光检测法
荧光检测是一种自然发光反应,通过荧光素酶与ATP进行反应,利用物质的荧光特性来对其进行定性和定量分析的方法,该方法具有较低检出限,干扰较少、线性范围宽、灵敏度高,且仪器结构简单、价格便宜,目前已广泛用于食品分析检测领域[81-82]。在杂环胺的分析中,荧光检测法也是一种重要的检测手段,de Andrés等[83]通过荧光检测法检测出尿液中的微量非极性杂环胺,除此之外,他们还将荧光检测与SFE-毛细管电泳结合,同时测定肉类样品中的6 种非极性杂环胺,该方法基于SFE程序,然后通过毛细管电泳和荧光检测对萃取的杂环胺进行分析,比一般的检测方法更快,且荧光检测可提高灵敏度,并避免样品提取物基质中存在的非荧光化合物带来的干扰[84]。
2.2.7 毛细管区带电泳(capillary zone electrophoresis,CZE)
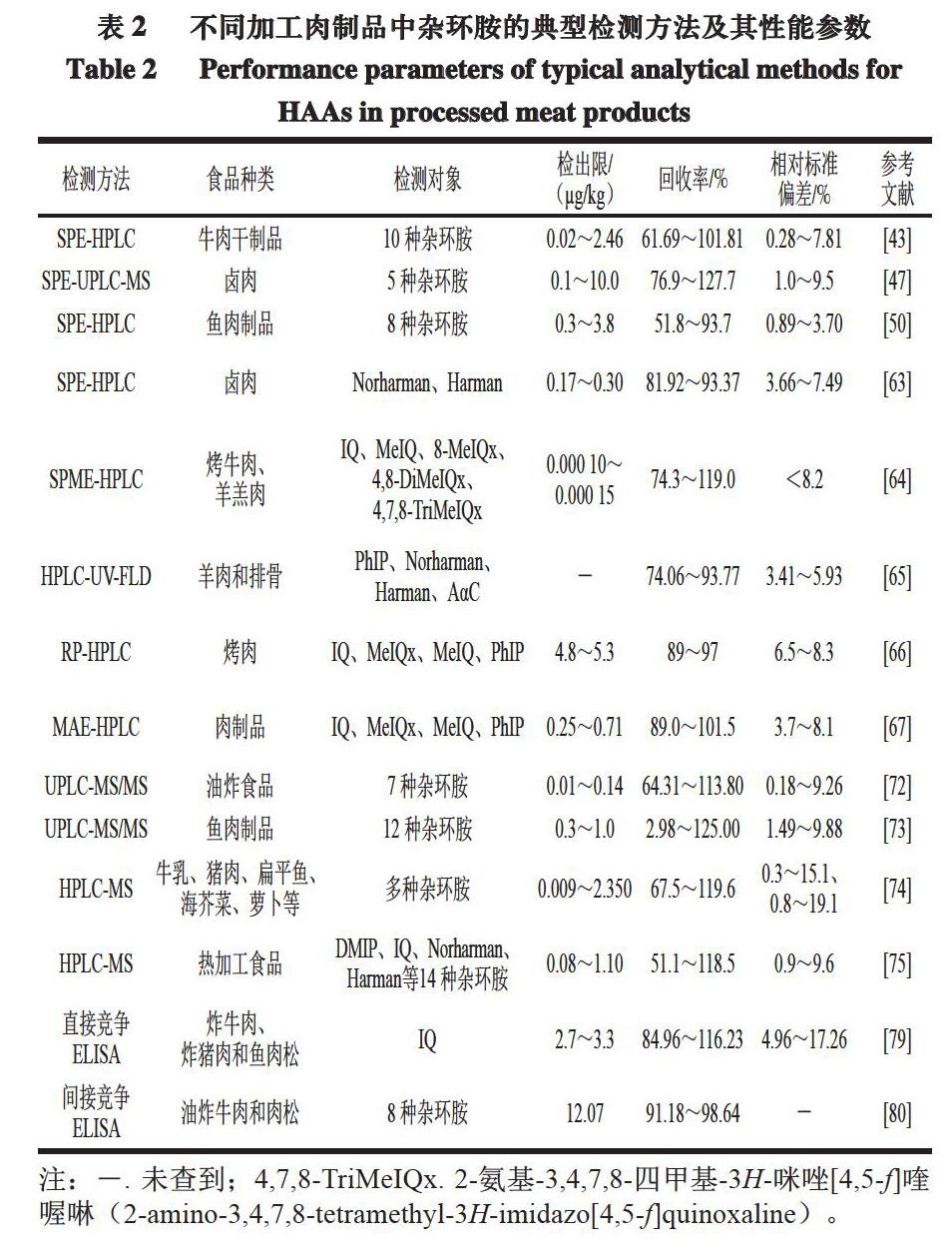
CZE是一种以弹性石英毛细管为分离通道,以高压直流电场作为驱动力,依据样品中各组分之间的不同分配行为,从而实现样品分离的电泳分离分析方法[85]。相比于其他检测方法,CZE法具有较高的分离效率,且需要的有机溶剂较少,样品用量也较少[76]。Mardones等[86]采用CZE法检测煎牛排、牛肉提取物和烤鲑鱼中的IQ、MeIQx、4,8-DiMeIQx和PhIP等杂环胺,在流体动力注射下该方法的检出限为0.05~0.22 μg/mL,在电动力注射下为0.08~0.16 μg/mL。Fei Xiaoqing等[87]使用在线预浓缩的紫外-二极管阵列检测器(ultraviolet-diode array detector,UV-DAD)检测,通过CZE测定商品肉中的8 种杂环胺,同时研究缓冲液组成、pH值、组分浓度及施加电压对检测结果的影响。不同热加工肉制品中杂环胺的检测方法及其性能比较如表2所示。
3 结 语
杂环胺是在高温烹煮富含蛋白质的食品中产生的一类具有强致癌、致突变性化合物。自从20世纪70年代科学家们从烤鱼中检测到杂环胺开始,人们对杂环胺的研究从未间断。在食品安全领域,关于热加工肉制品中杂环胺的致癌性、致突变性、形成机制、影响因素和检测方法等一直是研究重点。近年来,国内外关于热加工肉制品中杂环胺的提取、净化和检测分析研究越来越多,研究人员通过采用溶剂萃取、SPE等样品预处理方法,再结合GC-MS、LC-MS等现代分析技术,对不同热加工肉制品中的杂环胺进行检测分析。但是由于热加工肉制品中含有较多杂质以及杂环胺的痕量水平,杂环胺的高效、准确分析仍具有很大的挑战性,在未来的一段时间里,想要对热加工肉制品中的杂环胺进行精确的分析和检测仍然具有较大难度。但随着科学技术的不断发展進步、实验方法的不断改进和实验仪器的不断更新完善,这一难题可以通过精细化提取、高效纯化和预浓缩步骤(如采用QuEChERS、分散固相萃取技术)相结合,然后采用MS/MS等高灵敏的检测手段定量其痕量水平来解决。除此之外,还需加强酒精饮料、焙烤食品等热加工肉制品以外的其他热加工食品中杂环胺的分析检测和暴露评估研究。
参考文献:
[1] BELLAMRI M, HEGARAT L L, VERNHET L, et al. Human T lymphocytes bioactivate heterocyclic aromatic amines by forming DNA adducts[J]. Environmental and Molecular Mutagenesis, 2016, 57(9): 656-667. DOI:10.1002/em.22059.
[2] PATHAK K V, CHIU T L, AMBROSE A E, et al. Methemoglobin formation and characterization of hemoglobin adducts of carcinogenic aromatic amines and heterocyclic aromatic amines[J]. Chemical Research in Toxicology, 2016, 29(3): 255-269. DOI:10.1021/acs.chemrestox.5b00418.
[3] MINAKO N, MASAKO H, YUKO S, et al. Mutagenicities of smoke condensates and the charred surface of fish and meat[J]. Cancer Letters, 1977, 2(4/5): 221-226. DOI:10.1016/s0304-3835(77)80025-6.
[4] KIM H S, HER S J. Changes in the mutagenicity of heterocyclic amines, nitrite, and N-nitroso compound in pork patties during in vitro, human digestion[J]. LWT-Food Science and Technology, 2018, 92(3): 47-53. DOI:10.1016/j.lwt.2018.01.079.
[5] 郝麒麟, 黃先智, 丁晓雯. 食品中杂环胺的危害与控制措施研究进展[J]. 食品与发酵工业, 2019, 45(13): 275-280. DOI:10.13995/j.cnki.11-1802/ts.019856.
[6] 李旭东, 么鸿雁, 阚坚力, 等. IARC公布的化学物质和混合物及暴露环境对人类致癌性的综合评价[J]. 环境与健康杂志, 2008, 25(12): 1107-1110. DOI:10.16241/j.cnki.1001-5914.2008.12.039.
[7] 谢洋洋, 王小溪, 闫文杰, 等. 肉制品中杂环胺的研究进展[J]. 食品研究与开发, 2017, 38(15): 199-205. DOI:10.3969/j.issn.1005-6521.2017.15.041.
[8] 薛超轶, 何志勇, 高大明, 等. 加工肉制品中杂环胺的研究进展[J]. 食品安全质量检测学报, 2018, 9(14): 3590-3597. DOI:10.3969/j.issn.2095-0381.2018.14.006.
[9] DONG Hao, XIAN Yanping, LI Haixia, et al. Potential carcinogenic heterocyclic aromatic amines (HAAs) in foodstuffs: formation, extraction, analytical methods, and mitigation strategies[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2): 365-404. DOI:10.1111/1541-4337.12527.
[10] GIBIS M. Heterocyclic aromatic amines in cooked meat products: causes, formation, occurrence, and risk assessment[J]. Comprehensive Reviews in Food Science and Food Safety, 2016, 15(2): 269-302. DOI:10.1111/1541-4337.12186.
[11] MURKOVIC M. Formation of heterocyclic aromatic amines in model systems[J]. Journal of Chromatography B, 2004, 802(1): 3-10. DOI:10.1016/j.jchromb.2003.09.026.
[12] 李永, 何志勇, 高大明, 等. 热加工食品中杂环胺形成及抑制机制[J]. 食品安全质量检测学报, 2019, 10(2): 312-319. DOI:10.3969/j.issn.2095-0381.2019.02.006.
[13] KERSTIN S, MARGARETHA J. Incorporation of carbon atoms from glucose into the food mutagens MeIQx and 4,8-DiMeIQx using 14C-labelled glucose in a model system[J]. Carcinogenesis, 1993, 14(10): 2027-2031. DOI:10.1093/carcin/14.10.2027.
[24] TETSUTA K, TAKEHIRO H, NATSUMI M, et al. Formation of the mutagenic/carcinogenic imidazoquinoxaline-type heterocyclic amines through the unstable free radical Maillard intermediates and its inhibition by phenolic antioxidants[J]. Carcinogenesis, 1996, 17(11): 2469-2476. DOI:10.1093/carcin/17.11.2469.
[25] PAIS P, SALMON C P, KNIZE M G, et al. Formation of mutagenic/carcinogenic heterocyclic amines in dry-heated model systems, meats, and meat drippings[J]. Journal of Agricultural and Food Chemistry, 1999, 47(3): 1098-1108. DOI:10.1021/jf980644e.
[26] SYIFAA A S, JINAP S, AKANDA M J H, et al. Effects of different types of soy sauce on the formation of heterocyclic amines in roasted chicken[J]. Food Additives and Contaminants: Part A, 2018, 35(5): 870-881. DOI:10.1080/19440049.2018.1440639.
[27] LEE H, LIN M Y, CHAN S C. Formation and identification of carcinogenic heterocyclic aromatic amines in boiled pork juice[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1994, 308(1): 77-88. DOI:10.1016/0027-5107(94)90200-3.
[28] 廖国周, 王桂瑛, 徐幸莲, 等. 前体物含量对杂环胺形成的影响[J]. 食品与发酵工业, 2011, 37(4): 215-220. DOI:10.13995/j.cnki.11-1802/ts.2011.04.007.
[29] MONNIER V M, SELL D, MIYATA S, et al. The Maillard reaction in food processing, human nutrition and physiology[J]. Advances in Life Science, 1990(1): 393-414. DOI:10.1007/978-3-0348-9127-1_46.
[30] HOLTZ E, SKJOLDEBRAND C, JAGERSTAD M, et al. Effect of recipes on crust formation and mutagenicity in meat products during baking[J]. Journal of Food Technology, 1985, 20: 57-66. DOI:10.1111/j.1365-2621.1985.tb01903.x.
[31] 郭海涛, 王振宇, 潘晗, 等. 脂肪含量及原料肉形态对烤羊肉饼中杂环胺形成的影响[J]. 核农学报, 2014, 28(1): 91-96. DOI:10.11869/j.issn.100-8551.2014.01.0091.
[32] WANG Y, HUI T, ZHANG Y W, et al. Effects of frying conditions on the formation of heterocyclic amines and trans fatty acids in grass carp (Ctenopharyngodon idellus)[J]. Food Chemistry, 2015, 167: 251-257. DOI:10.1016/j.foodchem.2014.06.109.
[33] 王震, 張雅玮, 钱烨, 等. 反复卤煮对鸭胸肉和卤汤中杂环胺及其前体物的影响[J]. 食品工业科技, 2019, 40(12): 58-64. DOI:10.13386/j.issn1002-0306.2019.12.010.
[34] 韩中惠, 王晓敏, 吴士莹, 等. 烤肉中糖对杂环胺形成的影响及其作用机制研究[J]. 食品研究与开发, 2018, 39(23): 1-7. DOI:10.3969/j.issn.1005-6521.2018.23.001.
[35] 廖倩, 杨文侠, 李开雄. 烹调食品中杂环胺检测的样品前处理方法研究[J]. 肉类研究, 2008, 22(4): 60-64.
[36] TORIBIO F, GALCERAN M T, PUIGNOU L. Separation of heteroaromatic amines in food products[J]. Journal of Chromatography B, 2000, 747(1/2): 171-202. DOI:10.1016/S0378-4347(00)00154-7.
[37] 王敏, 郭德华, 丁卓平. 食品中杂环胺检测的分析方法[J]. 现代科学仪器, 2010(6): 145-148; 153.
[38] MANFUL C F, VIDAL N P, PHAM T H, et al. Rapid determination of heterocyclic amines in ruminant meats using accelerated solvent extraction and ultra-high performance liquid chromatography-mass spectrometry[J]. MethodsX, 2019, 6: 2686-2697. DOI:10.1016/j.mex.2019.11.014.
[39] 潘晗. 酱肉中norharman和harman形成机理的研究[D]. 北京: 中国农业科学院, 2014: 21-38.
[40] 王敏, 郭德华, 丁卓平, 等. 液相色谱-离子阱-飞行时间串联质谱同时检测葡萄酒中14 种杂环胺[J]. 色谱, 2012, 30(7): 738-742. DOI:10.3724/SP.J.1123.2012.02041.
[41] 杨彩玲. 样品前处理技术在色谱分析中的应用[D]. 兰州: 兰州大学, 2008: 7-30. DOI:10.7666/d.Y1332796.
[42] 徐晨, 范云场. 微波辅助萃取在色谱分析样品前处理中的应用[J]. 应用化工, 2018, 47(2): 343-346. DOI:10.16581/j.cnki.issn1671-3206.20171204.015.
[43] C?RDENES L, AYALA J H, AFONSO A M, et al. Solid-phase microextraction coupled with high-performance liquid chromatography for the analysis of heterocyclic aromatic amines[J]. Journal of Chromatography A, 2004, 1030(1/2): 87-93. DOI:10.1016/j.chroma.2003.10.040.
[44] ALAEJOS M S, AYALA J H, GONZALEZ V, et al. Analytical methods applied to the determination of heterocyclic aromatic amines in foods[J]. Journal of Chromatography B, 2008, 862(1/2): 15-42. DOI:10.1016/j.jchromb.2007.11.040.
[45] AEENEHVAND S, TOUDEHROUSTA Z, KAMANKESH M, et al. Evaluation and application of microwave-assisted extraction and dispersive liquid-liquid microextraction followed by high-performance liquid chromatography for the determination of polar heterocyclic aromatic amines in hamburger patties[J]. Food Chemistry, 2016, 190: 429-435. DOI:10.1016/j.foodchem.2015.05.103.
[46] 郝新焕, 杨欢, 崔轲龙. 样品前处理技术在离子色谱分析中的应用[J]. 全面腐蚀控制, 2017, 31(3): 17-20; 42. DOI:10.13726/j.cnki.11-2706/tq.2017.03.017.04.
[47] MURKOVIC M. Analysis of heterocyclic aromatic amines[J]. Analytical and Bioanalytical Chemistry, 2007, 389(1): 139-146. DOI:10.1007/s00216-007-1306-z.
[48] 万可慧, 彭增起, 邵斌, 等. 高效液相色谱法测定牛肉干制品中10 种杂环胺[J]. 色谱, 2012, 30(3): 285-291. DOI:10.3724/SP.J.1123.2011.11039.
[49] CASAL S, MENDES E, FERNANDES J O, et al. Analysis of heterocyclic aromatic amines in foods by gas chromatography-mass spectrometry as their tertbutyldimethylsilyl derivatives[J]. Journal of Chromatography A, 2004, 1040(1): 105-114. DOI:10.1016/j.chroma.2004.03.054.
[50] 曾茂茂, 李洋, 何志勇, 等. 液相色譜-质谱联用法结合主成分分析考察食品中前体物质对杂环胺生成的影响[J]. 分析化学, 2014, 42(1): 71-76. DOI:10.3724/SP.J.1096.2014.30628.
[51] 李可, 韩雪, 谢美娟, 等. SPE-UPLC-MS/MS法测定酱卤鸡腿老汤中10 种杂环胺[J]. 食品工业, 2017, 38(8): 306-310.
[52] 魏晉梅, 张丹, 李雪, 等. 固相萃取-液相色谱-串联质谱法测定市售卤肉制品中5 种杂环胺含量[J]. 食品工业科技, 2020, 41(3): 259-263; 269. DOI:10.13386/j.issn1002-0306.2020.03.043.
[53] ZHANG Yuan, WU Wenjie, ZHOU Weie, et al. Determination of 14 heterocyclic aromatic amines in meat products using solid-phase extraction and supercritical fluid chromatography coupled to triple quadrupole mass spectrometry[J]. Journal of Separation Science, 2020, 43(7): 1372-1381. DOI:10.1002/jssc.201900816.
[54] 赵磊, 张会敏, 李煜彬, 等. 15 种黄酮类化合物对烤鸡胸肉中杂环胺含量的影响[J]. 食品科学, 2019, 40(23): 19-25. DOI:10.7506/spkx1002-6630-20181105-045.
[55] 肖维, 张雁, 万译文, 等. 固相萃取-高效液相色谱法测定鱼制品中8 种杂环胺类化合物[J]. 理化检验(化学分册), 2014, 50(7): 879-883.
[56] 段建发, 林隆强, 林文华, 等. 凝胶色谱净化/气相色谱法测定鳗鱼中多种有机磷农药残留量[J]. 现代食品科技, 2012, 28(10): 1400-1403. DOI:10.13982/j.mfst.1673-9078.2012.10.011.
[57] 李晓娟. 凝胶色谱法在农药残留分析中的应用[D]. 北京: 中国农业大学, 2005: 23-46. DOI:10.7666/d.y774699.
[58] 丁文波. 固相萃取-在线凝胶渗透色谱净化-气相色谱-质谱法测定辣椒粉中38 种农药残留[J]. 中国卫生检验杂志, 2018, 28(11): 1293-1298.
[59] 罗舟. 化学模型中黄酮对杂环胺的抑制作用研究[D]. 天津: 天津科技大学, 2014: 12-42.
[60] 王盼, 洪燕婷, 朱雨辰, 等. 烹调食品中杂环胺检测的分析方法[J]. 食品工业科技, 2013, 34(22): 343-347; 354. DOI:10.13386/j.issn1002-0306.2013.22.034.
[61] WARZECHA L, JANOSZKA B, BLASZCZYK U, et al. Determination of heterocyclic aromatic amines (HAs) content in samples of household-prepared meat dishes[J]. Journal of Chromatography B, 2004, 802(1): 95-106. DOI:10.1016/j.jchromb.2003.09.027.
[62] PUANGSOMBAT K, GADGIL P, HOUSER T A, et al. Occurrence of heterocyclic amines in cooked meat products[J]. Meat Science, 2012, 90(3): 739-746. DOI:10.1016/j.meatsci.2011.11.005.
[63] 李进, 李凯凯, 高悦, 等. 固相萃取-高效液相色谱法分析香辛料对酱卤肉中β-咔啉类杂环胺形成的影响[J]. 现代食品科技, 2019, 35(3): 234-240. DOI:10.13982/j.mfst.1673-9078.2019.3.035.
[64] ZHANG Qianchun, CHENG Yingyi, LI Gongke, et al. Porous boronate affinity monolith for on-line extraction coupled to high-performance liquid chromatography for sensitive analysis of heterocyclic aromatic amines in food samples[J]. Chinese Chemical Letters, 2015, 26(12): 1470-1477. DOI:10.1016/j.cclet.2015.10.023.
[65] 郑多多, 张雪娇, 王南, 等. 高效液相色谱法测定烧烤制品中5 种杂环胺的含量[J]. 食品安全质量检测学报, 2018, 9(20): 5301-5307. DOI:10.3969/j.issn.2095-0381.2018.20.005.
[66] MOHAMMADI A, BARZEGAR F, KAMANKESH M, et al. Heterocyclic aromatic amines in doner kebab: quantitation using an efficient microextraction technique coupled with reversed-phase high-performance liquid chromatography[J]. Food Science and Nutrition, 2020, 8(1): 88-96. DOI:10.1002/fsn3.1262.
[67] BARZEGAR F, KAMANKESH M, MOHAMMADI A. Development and application of microwave-assisted extraction and advanced low density microextraction technique coupled with high-performance liquid chromatography for the successful determination of heterocyclic aromatic amines in barbecued meat sample and method optimization using response surface methodology[J]. Journal of Food Measurement and Characterization, 2019, 13(3): 1755-1764. DOI:10.1007/s11694-019-00093-9.
[68] 李可, 韩雪, 谢美娟, 等. HPLC法检测市售传统肉制品中的杂环胺含量[J]. 现代食品科技, 2017, 33(10): 294-301. DOI:10.13982/j.mfst.1673-9078.2017.10.041.
[69] LI Yong, HE Jialiang, QUAN Wei, et al. Effects of polyphosphates and sodium chloride on heterocyclic amines in roasted beef patties as revealed by UPLC-MS/MS[J]. Food Chemistry, 2020, 326(1): 127016. DOI:10.1016/j.foodchem.2020.127016.
[70] JINAP S, JAAFAR S N, HASNOL N D S, et al. Effect of a different mobile phase on LC-ESI-MS/MS performance for the identification and quantitation of polar and nonpolar heterocyclic amines in cooked chicken[J]. Journal of Food Measurement and Characterization, 2020, 14(1): 262-271. DOI:10.1007/s11694-019-00288-0.
[71] 白艳红, 韩雪, 李可, 等. 市售酱卤鸡腿老汤中杂环胺含量的检测与分析[J]. 轻工学报, 2017, 32(3): 8-13. DOI:10.3969/j.issn.2096-1553.2017.3.002.
[72] 张晨霞, 马宇翔, 赵天培, 等. 超高效液相色谱-三重四极杆质谱法检测油脂和油炸食品中7 种杂环胺类物质[J]. 色谱, 2020, 38(2): 224-231.
[73] 徐琦, 杨洪生, 吴光红, 等. 超高效液相色谱-电喷雾串联质谱法同时测定鱼类加工品中12 种杂环胺类化合物[J]. 南方水产科学, 2012, 8(4): 7-15. DOI:10.3969/j.issn.2095-0780.2012.04.002.
[74] LEE Y S, HWANG I J, KIM H, et al. Validation of analytical methods for heterocyclic amines in seven food matrices using high-performance liquid chromatography-tandem mass spectrometry[J]. Food Additives and Contaminants: Part A, 2020, 37(3): 408-420. DOI:10.1080/19440049.2019.1697829.
[75] 戴明. 液相色譜串联质谱法测定热加工食品中杂环胺[J]. 食品研究与开发, 2016, 37(22): 123-127. DOI:10.3969/j.issn.1005-6521.2016.22.029.
[76] 冉旭芹. 杂环胺酶联免疫检测方法的研究[D]. 天津: 天津科技大学, 2014: 21-43.
[77] 王静, 马宁宁, 宋洋. 杂环胺人工抗原的合成以及多克隆抗体的制备[J]. 食品科学, 2017, 38(4): 45-50. DOI:10.7506/spkx1002-6630-201704008.
[78] VANDERLAAN M, WATKINS B E, HWANG M, et al. Monoclonal antibodies for the immunoassay of mutagenic compounds produced by cooking beef[J]. Carcinogenesis, 1988, 9(1): 153-160. DOI:10.1093/carcin/9.1.153.
[79] SHENG Wei, RAN Xuqin, HU Gaoshuang, et al. Development of an enzyme-linked immunosorbent assay for the detection of 2-amino-3-methylimidazo[4,5-f]quinoline (IQ) in processed foods[J]. Food Analytical Methods, 2016, 9(4): 1036-1045. DOI:10.1007/s12161-015-0282-8.
[80] 赵秋霞, 生威, 王璐璐, 等. 一种检测杂环胺类化合物的酶联免疫检测方法的建立[J]. 食品工业科技, 2019, 40(21): 58-64. DOI:10.13386/j.issn1002-0306.2019.21.010.
[81] 陈逸诗. 荧光分析及其应用[J]. 生物化学与生物物理进展, 1977(2): 26-30.
[82] 王奕璇. 荧光分析法在药物分析中的应用新进展[J]. 广东化工, 2019, 46(7): 116-117. DOI:10.3969/j.issn.1007-1865.2019.07.051.
[83] DE ANDR?S F, ZOUGAGH M, CASTA?EDA G, et al. Screening of non-polar heterocyclic amines in urine by microextraction in packed sorbent-fluorimetric detection and confirmation by capillary liquid chromatography[J]. Talanta, 2011, 83(5): 1562-1567. DOI:10.1016/j.talanta.2010.11.060.
[84] FEMANDO D A, MOHAMMED Z, GREGORIO C, et al. Simultaneous determination of six non-polar heterocyclic amines in meat samples by supercritical fluid extraction-capillary electrophoresis under fluorimetric detection[J]. Electrophoresis, 2010, 31(13): 2165-2173. DOI:10.1002/elps.201000080.
[85] 王德先, 趙敬湘, 杨更亮, 等. 毛细管区带电泳法测定中药金银花中绿原酸的含量[J]. 中草药, 2000, 31(6): 432. DOI:10.7501/j.issn.0253-2670.2000.6.261.
[86] MARDONES C, ARCE L, RIOS A, et al. Determination of heterocyclic aromatic amines in fried beefsteak, meat extract, and fish by capillary zone electrophoresis[J]. Chromatographia, 1998, 48(9): 700-706. DOI:10.1007/BF02467602.
[87] FEI Xiaoqing, LI Chen, YU Xiaodong, et al. Determination of heterocyclic amines by capillary electrophoresis with UV-DAD detection using on-line preconcentration[J]. Journal of Chromatography B, 2007, 854(1/2): 224-229. DOI:10.1016/j.jchromb.2007.04.031.
