鉴别犬瘟热病毒强弱毒株中和单克隆抗体的制备
2020-12-14毕振威徐立波夏兴霞
毕振威 徐立波 夏兴霞

摘要:为了制备鉴别犬瘟热病毒(CDV)流行强毒株和疫苗弱毒株的单克隆抗体,将CDV 851弱毒株浓缩后经蔗糖密度梯度离心纯化,免疫BALB/c小鼠,取免疫小鼠脾细胞与SP2/0瘤细胞进行细胞融合,经3~5次克隆,间接ELISA筛选,获得稳定分泌抗CDV的杂交瘤细胞2D12株。该细胞株分泌的单克隆抗体亚类为IgG1κ,与常见犬病毒不发生交叉反应。间接免疫荧光显示,单克隆抗体与CDV 851毒株发生特异性反应,与杆状病毒表达的CDV 851毒株H蛋白发生特异性反应。Western blot检测发现,单克隆抗体与2株CDV强毒株H蛋白不发生反应,而与2株CDV弱毒株H蛋白有特异性反应。双抗体夹心ELISA显示,单克隆抗体能检测CDV疫苗弱毒株而不能检测CDV强毒株。病毒中和试验证实,单克隆抗体对CDV 851弱毒株具有中和能力。制备了区分CDV强毒株和疫苗弱毒的单克隆抗体,为CDV的鉴别诊断技术研究奠定了基础。
关键词:犬瘟热病毒;单克隆抗体;流行毒株;疫苗毒株;鉴别检测
中图分类号: S852.65 文献标志码: A 文章编号:1002-1302(2020)20-0178-05
犬瘟热(canine distemper,简称CD)是由犬瘟热病毒(canine distemper virus,简称CDV)引起的急性、高度接触性传染病。CDV自然感染宿主范围广泛,除了食肉目所有8个科外,还扩展到偶蹄目猪科、灵长目的猕猴属和鳍足目海豹科等多种动物,给养犬行业、经济动物行业和野生动物保护业等造成了巨大的经济损失[1]。CD是由流行的CDV野毒株感染引起的,而CD的免疫预防普遍使用活疫苗,如CDV疫苗弱毒株Onderstepoort、CDV3等。CDV疫苗弱毒株的毒力减弱而不引起免疫犬CD发病,但能提供有效的免疫保护。在临床中,CD疑似犬中检测和分离的CDV毒株并不一定是致病毒株,很多临床分离株与疫苗株具有很高的同源性和亲缘关系[2-3],表明犬感染CDV弱毒株的情况可能比较普遍,也可能分离的毒株就是免疫接种的疫苗弱毒株。目前,鉴别和区分CDV野毒株和疫苗弱毒株的检测方法很少。通过对CDV的基因测序能确定毒株的基因型[4],但费时、费力,无法实现快速准确诊断,对CD的诊断和治疗造成一定的困难。在检测CDV血清抗体时,也无法判断是CDV疫苗弱毒株还是CDV野毒株产生的抗体。因此,有效区分CDV强弱毒株是目前亟待解决的重要问题。本研究选用与CDV野毒株存在抗原性差异的 CDV 851 弱毒株免疫小鼠,制备能与CDV弱毒株发生特异性反应而与CDV野毒株没有反应的单克隆抗体,为区分CDV强弱毒株提供必要的工具。
1 材料与方法
1.1 病毒及主要试剂
Vero细胞长期传代致弱的CDV851毒株由笔者所在实验室保存;6~8周龄BALB/c小鼠购自扬州大学比较医学中心;小鼠骨髓瘤细胞SP2/0由笔者所在实验室保存;抗CDV N蛋白单克隆抗体由笔者所在实验室制备[5];HRP标记羊抗鼠抗体为KPL产品;弗氏完全与不完全佐剂、PEG4000、RPMI-1640培养基、HAT和HT均购自Sigma公司;TMB显色液购自南京碧云天生物技术有限公司;单抗亚型鉴定试剂盒为Thermo公司产品;鼠源抗Flag标签抗体购自Sigma公司;FITC标记的羊抗鼠抗体购自武汉博士德生物技术有限公司;同源重组克隆试剂盒(One Step Cloning Kit-C112)、高保真DNA聚合酶(Phanta Max supper-fidelity DNA polymerase)购自南京诺唯赞生物科技股份有限公司;表达CDV 851毒株H蛋白的杆状病毒按参考文献[6]构建和鉴定;7份CDV阳性临床样品来自山东烟台和江苏南京的宠物医院。
1.2 抗原纯化和动物免疫
将CDV 851毒株接种于Vero细胞大量培养。根据文献[7]的方法,采用醋酸锌沉淀浓缩病毒,经蔗糖密度梯度離心,纯化和制备CDV抗原。将纯化的CDV抗原用等体积弗氏完全佐剂乳化,腹腔注射免疫6~8周龄雌性BALB/c小鼠,剂量为50 μg/只。以后每隔14 d用等体积弗氏不完全佐剂进行乳化,再免疫2次。3免后间隔7 d断尾采血,测定血清抗体效价。取免疫小鼠血清和正常BALB/c小鼠血清作为阳性血清和阴性血清。于2011年5月10日至2011年6月21日在江苏省农业科学院兽医研究所进行。
1.3 细胞融合、筛选与克隆
取CDV免疫的BALB/c小鼠的脾脏,制备脾细胞。根据文献[7]方法,采用PEG4000将脾细胞与SP2/0细胞进行细胞融合。用纯化的CDV 851株抗原作为包被抗原,间接ELISA方法检测杂交瘤细胞培养上清,选择2次检测结果均为阳性的杂交瘤细胞株。采用有限稀释法对阳性孔进行3~5次亚克隆,至克隆后所有细胞孔上清阳性率100%。将克隆化的CDV单克隆抗体杂交瘤细胞株进行扩大培养,腹腔注射到石蜡致敏的8~10周龄的BALB/c小鼠,7~10 d后收集小鼠腹水,离心后收集上清,分装后于-20 ℃保存备用。于2011年6月21日至2011年8月25日在江苏省农业科学院兽医研究所进行。
1.4 单克隆抗体的效价和亚类测定
用间接ELISA测定杂交瘤细胞培养上清和单克隆抗体腹水的效价。按照单克隆抗体亚类鉴定试剂盒操作说明书,测定杂交瘤细胞2D12株分泌单克隆抗体的亚类。于2011年9月1日至2011年9月7日在江苏省农业科学院兽医研究所进行。
1.5 单克隆抗体的间接免疫荧光试验
将Vero细胞铺在24孔细胞培养板中,同步接种CDV 851株,培养48 h,病变后吸弃细胞培养液,用预冷的无水乙醇于4 ℃下固定30 min,用PBS洗3次;加入杂交瘤细胞培养上清液,37 ℃孵育1 h,PBS洗涤3次;加入200倍稀释的FITC标记的羊抗鼠IgG抗体,37 ℃孵育1 h,PBS洗涤5次,置于荧光显微镜下观察。将Sf9昆虫细胞铺到24孔板中,接种表达CDV 851毒株H蛋白的杆状病毒,按以上相同的方法进行间接免疫荧光试验。于2011年8月26日至2011年9月1日在江苏省农业科学院兽医研究所进行。
1.6 单克隆抗体的Western blot检测
分别用RT-PCR方法扩增CDV 851、疫苗株Onderstepoort以及Asia-4型野毒株NJ(11)2和Asia-1型野毒株NJ(12)3的H基因,采用同源重组的方法克隆到真核表达载体pCAGGS载体上,构建pCAGGS-Flag-H真核表达质粒。将293T细胞铺到细胞板中,次日细胞长至60%,分别转染以上4个毒株H蛋白的真核表达质粒,48 h后裂解细胞,加蛋白上样缓冲液煮10 min,进行Western blot检测。一抗为杂交瘤细胞培养上清液,二抗为HRP标记的羊抗鼠IgG,用ECL显色试剂盒进行显影。于2019年4月7日至2019年5月13日在江苏省农业科学院兽医研究所进行。
1.7 单克隆抗体的ELISA方法
用HisTrapTM Protein G亲和层析柱纯化单克隆抗体,按5 μg/mL的浓度包被ELISA板,用10%小牛血清的PBST在37 ℃封闭2 h,PBST洗3次,加入CDV阳性样品,37 ℃作用1 h,PBST洗3次,然后加入HRP标记的抗CDV N蛋白单克隆抗体G3N[7],37 ℃作用1 h,PBST洗3次,进行ELISA显色。同时,用双抗体夹心ELISA试验检测犬细小病毒(CPV)、犬流感病毒(CIV)、犬腺病毒1型(CAV-1)和犬冠状病毒(CCV),检验单克隆与犬常见病毒的交叉反应性。于2019年6月9日至2019年6月30日在江苏省农业科学院兽医研究所进行。
1.8 病毒中和试验
测定CDV 851株的TCID50,确定其病毒滴度。采用固定病毒稀释抗体的方法检测单克隆抗体的中和活性。将Vero细胞消化后,接种于96 孔细胞板中。杂交瘤细胞培养上清按2倍倍比稀释,单克隆抗体腹水按10倍倍比稀释。将不同稀释度的杂交瘤细胞培养上清和单克隆抗体腹水分别与等体积含200 TCID50的CDV 851株悬液混合均匀,37 ℃作用1 h,取该病毒-抗体混悬液按0.1 mL/孔接种于上述96孔细胞板中,并设立CDV及正常Vero细胞对照,置37 ℃、5% CO2温箱中培养,5~7 d后观察结果。于2011年9月15日至2011年9月30日在江苏省农业科学院兽医研究所进行。
2 结果与分析
2.1 单克隆抗体的筛选、效价和亚类
融合的杂交瘤细胞经过3~5次克隆筛选,获得分泌抗CDV单克隆抗体的杂交瘤细胞2D12株。用间接ELISA测定杂交瘤细胞培养上清的效价是 1 ∶ 103,单克隆抗体腹水的效价是1 ∶ 107。亚类试剂盒鉴定单克隆抗体的重链亚类为IgG1,轻链亚类为κ型。将杂交瘤细胞传代20代以上,用间接ELISA抗体检测细胞培养上清液,结果分泌的抗体效价没有明显变化,表明该杂交瘤细胞株具有稳定分泌单克隆抗体的能力。
2.2 单克隆抗体的特异性
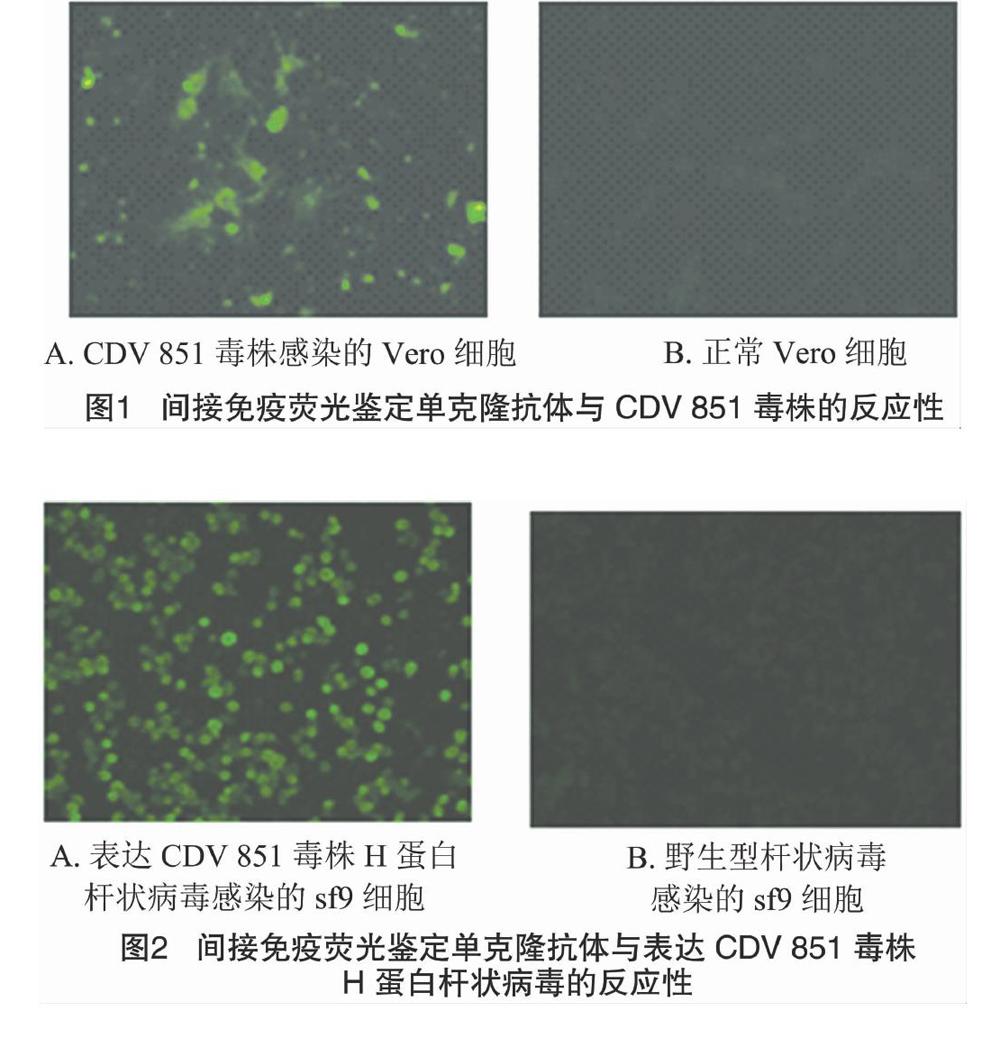
采用间接免疫荧光试验(IFA),检测单克隆抗体的特异性。杂交瘤细胞2D12株培养的细胞培养上清与CDV 851毒株感染的Vero细胞进行间接免疫荧光试验,结果表明,单克隆抗体2D12与 CDV 851 毒株感染的Vero细胞发出绿色荧光,而与正常Vero细胞没有绿色荧光(图1),表明单克隆抗体与CDV 851毒株发生特异性反应。将表达 CDV 851 毒株H蛋白的重组杆状病毒感染sf9细胞,间接免疫荧光试验显示,杂交瘤细胞2D12株培养的细胞上清与之发出绿色荧光,而与正常的sf9细胞无绿色荧光,表明单克隆抗体与CDV 851毒株H蛋白发生特异性反应(图2)。用双抗体夹心ELISA检测犬细小病毒(CPV)、犬流感病毒(CIV)、犬腺病毒1型(CAV-1)和犬冠状病毒(CCV),结果均为阴性,表明该单克隆抗体与犬常见病毒不发生交叉反应。
2.3 单克隆抗体与不同CDV毒株的反应性
将表达CDV 851毒株、疫苗株Onderstepoort以及Asia-4型野毒株NJ(11)2和Asia-1型野毒株NJ(12)3的H蛋白的真核表达质粒转染293T细胞,24 h后收获细胞样品,进行Western blot试验。结果表明,单克隆抗体与CDV 851毒株、Onderstepoort毒株H蛋白在70 ku左右出现特异性条带,与H蛋白预期大小相符,而与CDV NJ(11)2毒株、CDV NJ(12)3毒株没有出现条带(图3-A、图3-B)。用Flag抗体检测CDV NJ(11)2毒株、CDV NJ(12)3毒株H蛋白,在70 ku左右出现特异性条带,表明这2个毒株的H蛋白得到表达(图3-C)。以上结果表明,单克隆抗体特异性地识别弱毒株CDV 851和疫苗株Onderstepoort的H蛋白,但是与CDV野毒株NJ(11)2和NJ(12)3毒株不发生特异性反应。为了进一步检测单克隆抗体与CDV野毒株的反应性,用该单克隆抗体建立双抗体夹心ELISA方法,检测9份犬临床CD样品,检测结果均为阴性,空白对照也为阴性;而检测CDV弱毒株CDV 851和Onderstepoort株时,则为CDV阳性(图4-A)。用之前建立的双抗体夹心ELISA[7]检测,则均为CDV阳性(图4-B)。以上结果进一步确定单克隆抗体能够识别CDV疫苗弱毒株,而不能识别临床CDV野毒株。
2.4 单克隆抗体的中和活性试验
用CDV 851毒株在Vero细胞上进行病毒中和试验,检测单克隆抗体的病毒中和活性。杂交瘤细胞2D12株培养上清液按2倍倍比稀释,测得的中和效价是1 ∶ 256;单克隆抗体腹水按10倍倍比稀释,单克隆抗体腹水的中和效价为1 ∶ 106。
3 讨论与结论
CDV引起犬和其他陸生食肉动物产生呼吸系统、消化系统、神经系统等多系统临床症状,危害严重。CDV H蛋白是刺激机体产生中和抗体的主要蛋白[8-9]。但是,H基因的变异率很高,不同CDV毒株之间H基因的变异性高达11%。因此,H基因已经被广泛的用于研究CDV的分子流行病学和遗传进化[1]。CDV是副黏病毒科麻疹病毒属的RNA病毒,容易发生变异。近年来,新的CDV基因型不断地出现。到目前为止,基于H基因的进化显示CDV至少有17个不同的基因型,即America-1型(包括几乎所有的商业现有疫苗株)、America-2~5型、Arctic-like型、Rockborn-like型、Asia-1~4型、Africa-1和2型、Europe wild型、Europe/South America-1型、South America-2和3[1,4-5]。目前,中国流行的CDV毒株主要是Asia-1型CDV[4]。H基因的多样性也影响到了抗原性,单克隆抗体鉴定不同CDV毒株H蛋白存在抗原差异性[10-12]。本研究用CDV 851弱毒株制备的单克隆抗体2D12能区分CDV疫苗弱毒株和CDV野毒株,且对该毒株具有中和活性。考虑到H蛋白的免疫保护性和较高的抗原变异性,用杆状病毒表达的CDV 851株H蛋白检测与单克隆抗体2D12的反应性,结果为阳性,说明该单克隆抗体结合的是H蛋白。
CD疫苗的使用很好地控制了該病。最近在全世界包括我国,频繁地出现CD病例,之后较大规模爆发,包括家养动物和野生动物,甚至是在接种疫苗的动物上。Li等分离的9株CDV野毒株,其中3个毒株是来自免疫犬[13]。交叉中和试验结果表明,CDV野生型分离株之间以及CDV野生型分离株与美国目前使用的疫苗株之间存在抗原差异[14]。本研究制备的单克隆抗体与疫苗弱毒株反应而与野毒株不反应,表明单克隆抗体识别的中和抗原表位在野毒株上已经发生变异。目前CDV疫苗仍然有效,但是中和抗原表位的改变可能会降低或者减弱疫苗的免疫效率。
Chen等从15只犬中扩增到15个CDV毒株的H基因,其中9个CDV毒株属于Asia-1型,而4个毒株与Onderstepoort毒株有着最近的关系[2]。事实上,在对NCBI中注册的CDV毒株进行遗传进化分析,发现很多毒株都与疫苗弱毒株有着非常近的关系[3]。临床CDV强弱毒株无法有效鉴别,严重影响CDV诊断的准确性。曲丛华等建立了鉴别CDV强弱毒株的荧光定量PCR方法[15]。本研究制备的单克隆抗体能用来鉴别CDV疫苗弱毒株和流行野毒株。鉴定该单克隆抗体识别的CDV中和表位,用该表位建立间接ELISA方法可区分CDV强弱毒株感染产生的抗体,也可用该单克隆抗体建立竞争ELISA方法区分CDV强弱毒株产生的抗体,具体研究正在进行中。
H蛋白主要影响CDV的抗原性、宿主范围和组织嗜性,其高变异率使CDV种间传播现象加剧[16]。单克隆抗体通过不同的机制对病毒起到中和作用,如阻断H蛋白与受体的结合,干扰H蛋白与F蛋白的结合而抑制病毒与细胞的融合以及改变病毒蛋白构象等[17]。本研究制备的单克隆抗体2D12也具有中和活性,但其具体的机制须要通过受体结合试验、细胞融合试验、表位鉴定等试验来进一步研究阐明。
参考文献:
[1]Rendon-Marin S,da Fontoura B R,Canal C W,et al. Tropism and molecular pathogenesis of canine distemper virus[J]. Virology Journal,2019,16(1):30.
[2]Chen M,Xin T,Hou S,et al. Genotyping and pathogenic characterization of canine distemper virus based on mutations in the hemagglutinin gene in Chinese domestic dogs[J]. Polish Journal of Veterinary Sciences,2018,21(3):623-629.
[3]周 莉,刘志杰,曾智勇,等. 犬瘟热病毒贵州分离株H基因的克隆及其序列分析[J].动物医学进展,2011,32(7):19-24.
[4]Zhao J J,Yan X J,Chai X L,et al. Phylogenetic analysis of the haemagglutinin gene of canine distemper virus strains detected from breeding foxes,raccoon dogs and minks in China[J]. Veterinary Microbiology,2010,140(1/2):34-42.
[5]Bi Z,Wang Y,Pan Q,et al. Development of CDV-specific monoclonal antibodies for differentiation of variable epitopes of nucleocapsid protein[J]. Veterinary Microbiology,2017,211:84-91.
[6]毕振威,王永山,范红结. 犬瘟热病毒核衣壳蛋白基因在昆虫细胞中的表达及其抗原性分析[J].中国动物传染病学报,2011,19(5):21-26.
[7]毕振威. 犬瘟热病毒单克隆抗体的制备及其应用[D].南京:南京农业大学,2012.
[8]Bi Z W,Wang Y S,Wang X L,et al. Phylogenetic analysis of canine distemper virus in domestic dogs in Nanjing,China[J]. Archives of Virology,2015,160(2):523-527.
[9]Sixt N,Cardoso A,Vallier A,et al. Canine distemper virus DNA vaccination induces humoral and cellular immunity and protects against a lethal intracerebral challenge[J]. Journal of Virology,1998,72(11):8472-8476.
[10]Iwatsuki K,Tokiyoshi S,Hirayama N,et al. Antigenic differences in the H proteins of canine distemper viruses[J]. Veterinary Microbiology,2000,71(3/4):281-286.
[11]Bi Z W,Xia X X,Wang Y S,et al. Development and characterization of neutralizing monoclonal antibodies against canine distemper virus hemagglutinin protein[J]. Microbiology and Immunology,2015,59(4):202-208.
[12]Shi P,Cao Z G,Cheng Y,et al. Identification of linear B-Cell epitopes on hemagglutinin protein of canine distemper virus using two monoclonal antibodies[J]. Frontiers in Veterinary Science,2020,7:47.
[13]Li W,Cai C,Xue M,et al. Phylogenetic analysis of canine distemper viruses isolated from vaccinated dogs in Wuhan[J]. Journal of Veterinary Medical Science,2018,80(11):1688-1690.
[14]Anis E,Holford A L,Galyon G D,et al. Antigenic analysis of genetic variants of Canine distemper virus[J]. Veterinary Microbiology,2018,219:154-160.
[15]由叢华,张传美,张洪亮,等. 鉴别犬瘟热病毒强弱毒株SYBR Green Ⅰ 荧光定量RT-PCR检测方法的建立[J].中国兽医杂志,2017,53(3):23-25.
[16]王雅文,赵建军,闫喜军. 犬瘟热病毒受体及其跨宿主感染[J].病毒学报,2017,33(3):477-482.
[17]Ader-Ebert N,Khosravi M,Herren M,et al. Sequential conformational changes in the morbillivirus attachment protein initiate the membrane fusion process[J]. PLoS Pathogens,2015,11(5):e1004880.王大鹏,唐章生,林 勇,等. 不同投饲方式对克氏原螯虾稻田冬繁产量和水质的影响[J]. 江苏农业科学,2020,48(20):183-187.
