托里贝母种子的萌发特性及解除休眠技术研究
2020-12-14王佳琪黄俊华王蕾
王佳琪 黄俊华 王蕾


摘要:为了解托里贝母种子基本特性以及GA3处理与适宜的温度对解除种子休眠及萌发的作用。采用扫描电镜来观察种子形态,TTC法测定种子活力;浸种称重法测定种皮透水性;体视显微镜下解剖种子并观察种胚发育及萌发情况;光照培养箱培养找到种子生长萌发最佳温度。结果表明,托里贝母种皮薄,种子吸水速率较快,不存在透水性障碍;根据种胚生长变化,托里贝母种胚发育不完全,存在形态后熟和生理后熟;种子需在5~10 ℃下完成形态后熟,经80 d使种胚发育成熟,已完成形态后熟的种子需经过0~5 ℃低温在120 d完成生理后熟,促进种子快速萌发;50 mg/L GA3能有效提高胚率,同时其处理下60 d便可完成形态后熟,发芽率也有明显提高。托里贝母种皮无吸水障碍,种皮透性不是引起休眠的直接原因;种子属于形态生理休眠类型;5~10 ℃促进种胚生长,0~5 ℃促使萌发,50 mg/L GA3可有效解除休眠,促进萌发。
关键词:托里贝母;解除休眠;种胚;赤霉素;萌发
中图分类号:S567.23+1.01 文献标志码: A 文章编号:1002-1302(2020)20-0154-06
贝母属是我国传统的中药材,早在秦汉时期《神农本草经》中就有记载,列为中品,因“形如聚贝”而得名,是中医止咳、平喘的常用药[1]。我国贝母属种质资源以四川和新疆2省最为丰富[2],但在我国云南、甘肃和西藏等海拔3 500 m以上的高原地区也有分布。在新疆则以准噶尔盆地以东的塔城、伊犁一带居多[3]。本研究中的托里贝母(Fritillaria tortifolia)是百合科贝母属多年生草本植物,是重要的药用植物,有清热润肺、化痰止咳的功效,由于其独特的花型、斑斓的花色等特点,也使其具备了较高的观赏价值及经济价值,是一类很有潜力的球根花卉,适用于园林绿化、庭院观赏、切花盆花等领域[4-7]。
本研究选取的托里贝母为我国准噶尔西部山地特有种,地域性强,由于地上部分生育期短,在成熟种子中,种胚发育不全、分化程度低,导致种子萌发前需要一个较长的胚形态后熟阶段及成胚后生理后熟阶段才能萌发。在自然条件下,托里贝母种子很难萌发,因其具有较长的休眠期,即使在人工栽植培育条件下,不经过适当处理的托里贝母种子同样也不容易萌发。因此找出托里贝母种子休眠期长的原因,缩短萌发周期是目前研究的关键点。目前,对托里贝母研究进展缓慢,绝大多数研究主要集中在对其化学成分分析上,对种子方面的研究极为贫乏,对于种子休眠原因、解除休眠相关研究尚鲜有报道。因此,本研究以托里贝母为试材,利用电镜扫描观察种子形态,探究种皮透水性、胚发育程度对托里贝母种子休眠的影响,以外源GA3处理配合适宜温度来解除种子休眠,并促进萌发,来确定托里贝母种子休眠类型,最终提出休眠解除方法,为该种的引种驯化提供重要依据。
1 材料与方法
1.1 试验材料
该试验中所用的托里贝母于2018年7月采集自新疆塔城地区,挑选大小一致且饱满有光泽、发育良好的种子,采后均经过低温储藏。所进行的各试验于2018年8月至2019年1月在新疆农业大学林学与园艺学院风景园林植物点实验室开展。
1.2 试验方法
1.2.1 种子形态特征观测、千粒质量及含水量的测定 用肉眼直接对种子的外部形态进行观察,记录种子的基本特征。在体视显微镜下观察种子形态,测定种子的纵径、横径。
随机选取1 000粒种子,重复3次,分别称质量并记录,取其平均值,作为种子的千粒质量。
含水量的测定:称取1.5 g种子,分为3组,记录每组称质量数据,放置于80 ℃的烘箱中,每隔2 h称质量1次,至3组样品连续3次达到恒质量,用千分之一电子天平称质量,最后取平均值。
种子含水量=烘前种子质量-烘后种子质量/烘前种子质量×100%。
1.2.2 新疆贝母属种子的扫描电镜形态 用电镜扫描观察法观察种子微观种皮形态,随机挑选出大小一样且颗粒饱满的干种子10粒,先用2.5%戊二醛将种子固定,随后用丙酮脱水,转入乙酸异戊酯后,进行临界点干燥、喷金。为了将新疆不同种类的贝母种子作对比,分别挑选托里贝母种子、额敏贝母种子、新疆贝母种子、大白花贝母种子,进行微观表皮结构的分析比较,在扫描电子显微镜下观察种子表面。
1.2.3 种子生活力测定 种子生活力采用TTC染色法,将待测托里贝母种子于30 ℃温水中浸种 24 h,使种子充分吸胀,种胚能迅速染色。取吸胀的种子30粒,重复3次,用刀片沿种胚生长方向横向切开,选取含种胚较多部分置于培养皿中,加入适量的0.5% TTC溶液,以刚好覆盖种子为度,置于35 ℃暗环境恒温箱中遮光染色24 h,然后清水冲洗,观察种胚及胚乳染色情况,根据染色程度,鉴定种子有无生活力,计算种子生活力。凡胚被染成红色的是活种子。
种子生活力=染色种子数量/测定种子数量×100%。
1.2.4 种子吸水规律测定 挑选饱满的种子,每组30粒,3次重复。分别在天平上准确称取干质量后均匀摆置于玻璃培养皿(d=90 mm),置于25 ℃培养箱中,加水浸泡,每隔0、2、4、6、8、10、12、24、36、48、60、72、84 h取出,快速用滤纸吸干种子表面水分,准确称取质量,最后计算种子吸水率。
种子吸水率=(吸水后种子质量-风干种子质量)/风干种子质量×100%。
1.2.5 不同温度下对种胚生长的影响 選取饱满种子,用蒸馏水浸泡48 h,放入铺有2层滤纸的培养皿中,分别置于0~5、5~10、10~15、20~30 ℃不同变温条件下进行培养,每个处理30粒,设3次重复,每隔20 d取出观察种子形态变化,测定种子萌发的最佳温度。在体视显微镜下测量种胚及胚乳长度,计算胚率并拍照。
胚率=种胚长/胚乳长×100%。
1.2.6 外源GA3处理对种胚生长及萌发的影响 挑选饱满的种子,用不同浓度的GA3浸种48 h,浓度梯度为0(CK)、20、30、50、80、150 mg/L,放入铺有2层滤纸的培养皿中,加蒸馏水以浸润滤纸为度,并将皿盖盖好保持湿润,置于温度5~10 ℃、相对湿度85%的培养箱中进行萌发试验。每个处理为30粒种子,3次重复。每隔20 d观察种子形态变化,计算胚率并拍照。在种子完成形态后熟后,根据最适浓度,将种子置于0~5 ℃,每隔10 d记录1次种子发芽情况,并计算发芽率。当胚根突出珠孔1 mm時,种子视为已萌发。
发芽率=正常发芽粒数/供试种子总 数×100%。
1.3 数据分析
试验数据统计及分析使用SPSS 19.0软件,图表绘制使用Excel 2003软件,数据使用平均值±标准误差来表示。外源GA3处理下种胚生长变化在95%显著水平上使用单因素方差(ANOVA)分析。
2 结果与分析
2.1 托里贝母种子的形态特征
托里贝母种子外观扁平,呈三角倒卵形,边缘有狭翅(图1-A),种皮浅棕黄色至棕黄色,种皮薄而透明,胚所占空间极小,为点状胚,但胚乳含量较丰富(图1-B)。采用电子天平称取托里贝母种子千粒质量,并借助体视显微镜对其进行观察,测得托里贝母种子的平均千粒质量为(3.424±0.03) g。种子长(6.41±0.05) mm,宽(3.84±0.03) mm,厚 (0.5±001) mm。种子含水量为(8.00±0.13)%,种子生活力为(74.44±5.56)%。
在扫描电子显微镜下观测,明显观察到托里贝
母种皮相较于额敏贝母种皮光滑,没有明显的褶皱,存在类似于水波纹的纹路,沟壑较浅;额敏贝母和新疆贝母种皮呈现出不同程度的海鸟式凹凸状,额敏贝母的沟壑较深而新疆贝母种皮较平缓,类似于海底珊瑚礁的形状。大白花贝母种皮的表面存在类似于橘络状的褶皱,沟壑较浅(图2)。相对于额敏贝母和新疆贝母,托里贝母种皮的纹理呈现出密而浅的规律,有放大的树皮表面的纹样,但托里贝母种皮表面与大白花种皮表面相较而言,托里贝母种皮又比大白花贝母种皮的纹路深且褶皱明显(图3)。说明不同贝母种子之间种皮微观形态存在差异,可作为区别贝母种类的依据之一。
2.2 托里贝母种子吸水特性
由图4可见,托里贝母种子吸水可划分为3个阶段。种子在快速吸水期(0~8 h)吸水率逐渐上升,尤其在前2 h急剧上升;在缓慢吸水期(8~<24 h)8~12 h种子吸水率波动较小;在饱和吸水期(24 h及以后)在24 h吸水率达最大值,之后吸水率趋于稳定,吸水速度放缓趋于平稳,达到饱和。种子吸水率在4 h后均达到100%以上,说明托里贝母种子不存在透水性障碍。
2.3 托里贝母种子休眠的解除
2.3.1 温度对种胚生长的影响 经过消毒后用蒸馏水浸泡托里贝母种子48 h,不同温度处理结果表明,在0 d各温度处理原始胚率均为18.9%;20~40 d,有不同程度的上升,其中5~10 ℃增幅最快,已增至79.05%,0~5 ℃增幅最慢,仅为56.89%;40~60 d,在其他各处理均上升时,20~30 ℃呈下降态势,降至61.29%,0~5 ℃急剧上升至7390%;
60~80 d,5~10 ℃趋于平稳,0~5 ℃呈大幅增长,而10~15 ℃和20~30 ℃波动较小;80~100 d,0~5 ℃在100 d赶超5~10 ℃,为89.42%,而10~15 ℃ 和20~30 ℃均有所降低;100~160 d,0~5 ℃ 胚率不断攀升超过其他处理,胚率达最大值为96.26%,而5~10 ℃增幅放缓,10~15 ℃和 20~30 ℃ 呈下降趋势(图5)。托里贝母种子在前80 d以5~10 ℃胚率增幅最快,80~160 d以0~5 ℃胚率增幅最快。说明在低温下托里贝母种胚能快速生长,在高温超过20 ℃条件下种子生长会受到抑制,因此其不适宜在高温下生长萌发。
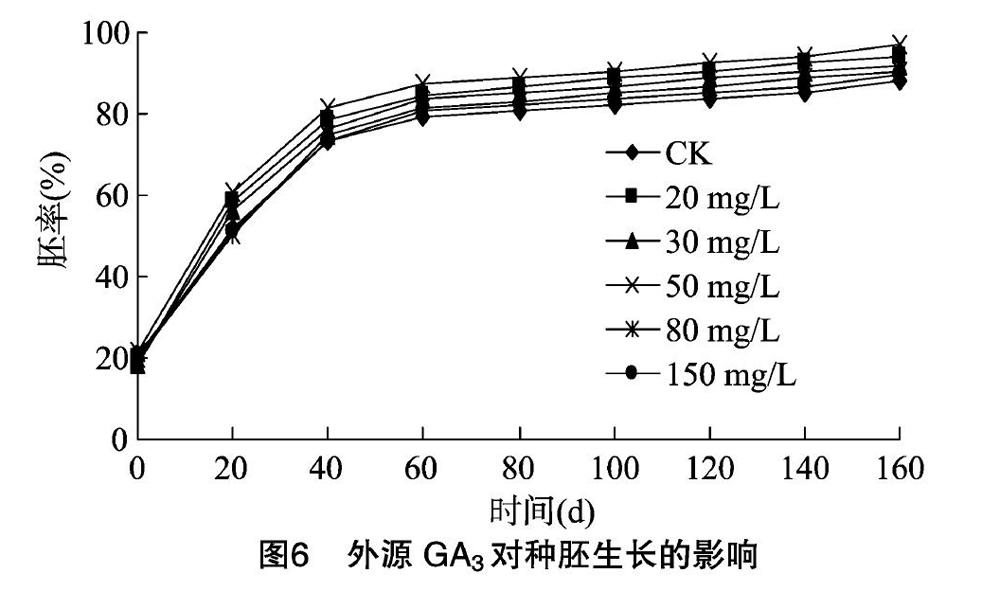
2.3.2 外源GA3对种胚生长的影响 根据图6分析可得出,不同外源GA3处理下随着时间的延长,种胚开始发育,胚率也随之逐渐升高。从20 d开始,可发现50 mg/L GA3明显高于其他浓度,此后各浓度胚率大小均为50 mg/L GA3>20 mg/L GA3>30 mg/L GA3>80 mg/L GA3>150 mg/L GA3>CK,其中80 mg/L GA3和150 mg/L GA3胚率始终较接近;0~40 d各浓度胚率均快速增长,且增幅最大,此期间为种胚快速生长发育时期;40~60 d各浓度胚率有小幅增长,50 mg/L GA3增长较快;60~80 d各浓度胚率增速缓慢,趋于平稳,尤其GA3处理胚率基本无变化,可以认为其在60 d已完成形态后熟,而CK需80 d完成形态后熟;80 d后随时间增长,各浓度胚率平稳增长,生长变化不大;在160 d各浓度胚率均达最大值。从图7托里贝母种胚生长变化动态看出,种胚随时间的延长而变化,到80 d生长变缓,平稳增长,整体呈上升趋势。
2.3.3 外源GA3对种胚生长的方差分析 由表1可知,所有浓度处理的胚率均随时间的延长而增长,160 d时各处理胚率均达到最大值;CK处理80 d后,胚率不再出现显著差异,而50 mg/L GA3处理60 d后,胚率就不再存在显著差异。综上,托里贝母种子自然解除形态休眠需要80 d,而50 mg/L GA3只需60 d即可解除形态休眠,说明50 mg/L GA3能有效缩短托里贝母种子形态休眠时间。0、20 d时,所有处理均无差异;40 d时,20、50 mg/L GA3处理与CK存在显著差异,说明20、50 mg/L GA3处理能有效提高胚率,其中以50 mg/L GA3效果最为显著。
2.4.3 外源GA3及低温条件对种子萌发的影响 由图8可知,在0~<60 d各处理均无发芽现象,60 d 时0~5 ℃处理开始发芽,发芽率为3.33%;60~80 d,0~5 ℃处理发芽率缓慢增长,仅增长到6.67%;80~100 d,0~5 ℃处理发芽率快速增长,可达20%,在100 d时,50 mg/L GA3处理开始发芽;100~120 d,0~5 ℃处理发芽率依旧呈增长态势,增至30%,在120 d CK处理开始发芽;120~140 d,50 mg/L GA3和CK处理发芽率增长较缓慢,0~5 ℃ 处理在130 d发芽率增至36.67%;140~160 d,0~5 ℃處理发芽率急剧攀升至60%,50 mg/L GA3和CK处理发芽率有小幅增长,为1333%和10%;160~180 d,0~5 ℃处理发芽率缓慢增加,在180 d为63.33%,50 mg/L GA3和CK处理发芽率快速上升至40%和30%;180~200 d,各处理发芽率均稳步上升,200 d发芽率分别为7333%、50%、40%。由此可知,托里贝母种子在CK处理下80 d完成形态休眠,80~<120 d种子无萌动现象,为种子生理后熟阶段,120 d开始萌发,结束休眠。表明托里贝母种子生理后熟期需要在 0~5 ℃ 低温条件下,施以适当浓度的GA3,来促进其种胚生长,快速萌发。
3 讨论与结论
3.1 种皮结构
研究指出,从种子结构分析,种皮薄,久泡后很易破裂,它不可能成为种子萌发的障碍[8]。托里贝母种皮薄而透明且光滑,种子吸水速率较快,吸水率在4 h后均达到100%以上,24 h后吸水达到饱和,最大吸水率为185.54%,说明其种子不存在透水性障碍,其休眠也不是直接由种皮透水性导致的。
3.2 种胚的生长变化
Baskin等根据Nikolaeva的种子休眠综合分类体系,加以改进并提出作为国际通用的种子休眠分类系统,分为物理休眠(PY)、生理休眠(PD)、形态休眠(MD)、复合休眠(PY+PD)和形态生理休眠(MPD)[9-10]。伊贝母被最早指出属于形态生理休眠类型(MPD)[11],之后又发现浙贝母[12]、卷叶贝母[13]、安徽贝母[14]、川贝母[15]、暗紫贝母[16]、梭砂贝母[17]等贝母属植物均存在形态后熟和生理后熟,可见贝母属植物形态生理休眠现象较为普遍。成熟种子中,胚乳充分发育,而胚发育不全或分化程度很低,为生育期短促的类短命植物胚胎发育的特点[18],而这种特性又是其种子休眠期较长的主要原因之一[8]。本研究中托里贝母和其他贝母属植物一样,包括形态后熟和生理后熟2个阶段。采收时种子外观虽已表现成熟,但胚的发育还不完全,其种胚仍然较小,胚乳所占比例较大,需由点状胚经过较长的一段时间来完成其形态上的成熟,发育成线性胚,成胚后仍不能萌发,还需一段时间来完成生理后熟,从而萌发。这与其他贝母属植物种子萌发特性研究结果一致。
3.3 种子休眠的解除
合适的温度是贝母种子育苗成功的关键因素[19]。不同的贝母属植物种子完成形态后熟和生理后熟的温度条件也不一致。伊贝母种子形态后熟需要5~10 ℃低温条件,1.5 ℃低温对解除生理休眠较适宜[20];卷叶贝母形态后熟以15 ℃最为适宜,生理后熟需在5 ℃低温下完成[13];暗紫贝母形态后熟在5~15 ℃,解除生理休眠在20 ℃左右[16]。本研究中托里贝母种子在对照处理下80 d完成形态休眠,进入生理后熟阶段,120 d开始萌发。其完成形态后熟最适温度条件为5~10 ℃,而已完成形态后熟的托里贝母种子,还需经过一个0~5 ℃低温来完成生理后熟。
外源GA3是一种重要的植物生长调节激素,生理活性大,对植物的生长发育至关重要。它能解除种子休眠,还能刺激已经解除休眠种胚的发育,提高种子活力[21],通过GA3还可以解除种皮障碍、软化胚乳和扩展植物胚胎细胞,从而促进种子萌发[22]。本试验发现20、50 mg/L GA3都能有效提高胚率,其中以50 mg/L GA3效果最为显著,可见 50 mg/L GA3更能刺激托里贝母种胚的生长伸长。此外,在50 mg/L GA3处理下,60 d便可完成形态后熟,发芽率也有明显提高,说明此浓度是托里贝母种子种胚生长发育及萌发的最适浓度,这与马生军等的结论[23-24]一致。
基于本研究结果,在整个种子萌发过程中,不同处理种子发芽率情况为0~5 ℃>外源GA3>5~10 ℃。0~5 ℃低温大大提高了托里贝母种子的发芽率,因此,0~5 ℃持续低温处理种子萌发情况优于外源GA3和5~10 ℃处理。在种子形态休眠期,不同处理种子胚率情况为外源GA3>5~10 ℃>0~5 ℃。外源GA3处理可将形态休眠时间缩短至60 d,并有效提高胚率,而在5~10 ℃处理下需80 d才能完成形态后熟,说明外源GA3更能有效解除托里贝母种子的形态休眠,促进种胚的生长伸长;在同一条件处理下,外源GA3虽能有效解除形态休眠,但在生理后熟期效果并不明显。在种子生理后熟期,在5~10 ℃处理下到120 d才开始发芽,表明经120 d托里贝母种子才能解除休眠;但在0~5 ℃低温条件下,经120 d其发芽率便可达30%,外源GA3在120 d发芽率仅为6.67%,说明0~5 ℃低温对解除种子生理休眠效果更为明显。尽管外源GA3在解除形态休眠中发挥的作用更明显,但0~5 ℃低温是解除生理休眠的最适条件。综上所述,外源GA3常被用于解除种子休眠,因为它是多功能的生长调节剂,具有取代低温,打破种子休眠、促进植物萌发伸长等生理调节效应,对种子萌发和苗期生长有明显促进作用[25]。而低温对于种子生理休眠的效果更为明显,也更能促进种子萌发,因为已长成的胚,最少还需要继续保持低温刺激,才能完成多数萌发[8]。一般来说,分布于北方温带地区的药用植物,萌发时适宜较低温度,同时种子萌发的适温与植物生长的适温密切相关,这主要是由于植物对生态环境条件的适应性[26]。托里贝母种子属于低温萌发型种子,此特性与其生长环境有一定关系,也是其对生态环境条件的适应。
综上所述,托里贝母种胚发育不完全,需由点状胚经一段时间完成形态后熟发育成线性胚,成胚后仍不能萌发,还需完成生理后熟,从而萌发,故其存在形态生理休眠;分析种子吸水特性发现种子吸水速率较快,其休眠也不是由种皮透水性导致的;解除其休眠便可促进种子生长萌发,通过胚率测定发现,胚率基本无变化,达到形态休眠解除需80 d,生理休眠需120 d,而在50 mg/L GA3处理下60 d便可解除种子形态休眠,说明外源GA3可以解除托里贝母种子形态休眠。可知,在5~10 ℃下80 d可完成形态后熟,已完成形态后熟的托里贝母种子,需经过0~5 ℃低温在120 d完成生理后熟,进而促进种子快速萌发。
参考文献:
[1]常彦莉. 甘肃贝母种子发育及发芽特性研究[D]. 兰州:甘肃农业大学,2010.
[2]李 萍,徐国钧,徐珞珊,等. 中药贝母类的研究[J]. 药学学报,1996,26(2):463-470.
[3]王果平,樊丛照,李晓瑾,等. 新疆贝母属植物鉴定技术研究进展[J]. 中国现代中药,2012,14(9):51-54.
[4]梁松筠. 百合科(狭义)植物的分布区对中国植物区系研究的意义[J]. 植物分类学报,1995,33(1):27-51.
[5]杨继祥. 人参、贝母、天麻栽培与加工[M]. 北京:中国林业出版社,1987:138.
[6]袁燕波,郝丽红,于晓南. 贝母属观赏植物种质资源及其园林应用价值[J]. 中国野生植物资源,2013,32(5):32-37,44.
[7]郝丽红,汤正娇,于晓南. 贝母属6个新疆野生种质调查及其园林应用价值[J]. 浙江农业学报,2013,26(3):661-666.
[8]张维经. 伊贝母种子休眠特性的研究[J]. 植物学报,1978,20(2):175-177.
[9]Nikolaeva M G. Ecological and physiological aspects of seed dormancy and germination[J]. Botanicheskii Zhurnal,2001,86:1-14.
[10]Baskin C C,Baskin J M. Seeds:ecology,biogeography,and evolution of dormancy and germination[J]. Crop Science,2015,52(9):52-4756.
[11]王有生,王文杰. 伊贝母种子的休眠特性及化学药剂对解除休眠的效应[J]. 中药材,1989(4):7-10.
[12]苏 新. 浙贝母种子休眠特性的初步研究[J]. 时珍国药研究,1991(3):129.
[13]陈 瑛,张 军,李先恩. 卷叶贝母种子胚后熟的温度条件[J]. 中国中药杂志,1993(5):270-272,317.
[14]周良骝,谢中稳,张袖丽. 安徽贝母种子休眼与萌发的研究[J]. 安徽农业科学,1994(增刊2):91-93.
[15]胡莹莹. 川贝母种子萌发特性及育苗技术研究[D]. 雅安:四川农业大学,2008.
[16]马永贵,金 兰,罗桂花,等. 青海暗紫贝母种子休眠解除的初步研究[J]. 中华中医药杂志,2012,27(12):3214-3217.
[17]高永茜,肖亚琼. 梭砂贝母种子萌发特性[J]. 福建林业科技,2017,44(2):77-81.
[18]胡适宜. 被子植物胚胎学[M]. 北京:人民教育出版社,1982:143-149.
[19]胡 平,夏燕莉,杨玉霞,等. 温度对太白贝母种子萌发的影響[J]. 现代中药研究与实践,2018,32(1):7-9.
[20]王文杰,王金芳. 温度对伊贝母种子萌发的效应[J]. 中药材,1989(5):9-11.
[21]高春智,何炎红,田有亮,等. 不同浓度赤霉素浸种对樟子松种子萌发的影响[J]. 内蒙古农业大学学报(自然科学版),2012,33(3):67-72.
[22]张素清,陆爱君. 植物激素对种子萌发的影响[J]. 辽宁林业科技,2015(3):59-61.
[23]马生军,沙 红,包晓玮,等. 伊贝母种子发芽率影响因素的研究[J]. 时珍国医国药,2011,22(6):1481-1482.
[24]金 兰,丁 莉,罗桂花,等. 不同浓度GA3对川贝母发芽率及酯酶同工酶的影响[J]. 种子,2009,28(8):51-52.
[25]宋廷杰,肖杰易,李祥洲. 川贝母种子赤霉素处理试验研究[J]. 基层中药杂志,1994(1):14-16.
[26]郑光华. 实用种子生理学[M]. 北京:农业出版社,1990:267.相元萍. 洋葱品种资源营养成分比较及杂种优势分析[J]. 江苏农业科学,2020,48(20):160-163.
