浅谈高考对化学平衡常数的考查及教学策略
2020-12-14山东
◇ 山东 孙 正
(作者单位:山东省菏泽市巨野县实验中学)
化学平衡常数的计算是历年高考的热点,2017年全国卷(理综,下同)Ⅰ、Ⅲ,2018年全国卷Ⅰ、Ⅱ、Ⅲ,2019年全国卷Ⅱ、Ⅲ均有考查.2018 年全国卷Ⅰ和2019年全国卷Ⅱ还考查了压强平衡常数的计算,这是对化学平衡常数考点的新考向.在复习备考时要给予足够的重视.
1 浓度平衡常数的计算
例1(2017年全国卷Ⅰ,节选)近期发现,H2S是继NO、CO 之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能.H2S 与CO2在高温下发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g).在610 K 时,将0.10 molCO2与0.40molH2S充入2.5L 的空钢瓶中,反应平衡后水的物质的量分数为0.02.反应平衡常数K=______.

解题策略计算浓度平衡常数时,关键是认真分析题干中的文字、图象、图表信息,找到关于浓度的条件,列“三段式”求出各物质的平衡浓度,代入平衡常数表达式进行计算(注意书写平衡常数表达式时,固体和纯液体不能列入).
2 压强平衡常数的计算
压强平衡常数就是在化学平衡体系中,用各气体物质的分压代替浓度计算得到的平衡常数.
例2(2019年全国卷Ⅱ,改编)某温度下,等物质的量的碘和环戊烯在刚性容器内发生反应mol-1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为__________,该反应的平衡常数Kp=__________Pa.
设容器中起始加入I2(g)和环戊烯的物质的量均为a,平衡时转化的环戊烯的物质的量为x,列出三段式:
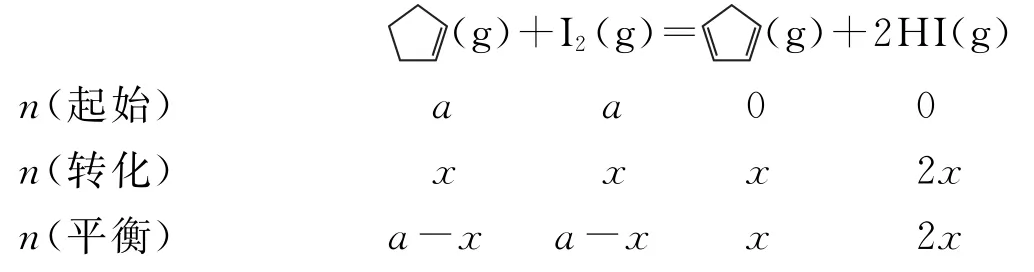
根据平衡时总压增加了20%,故平衡时总压为(1+20%)×105Pa=1.2×105Pa.恒温、恒容时,压强之比等于气体物质的量之比,有

解得x=0.4a,则环戊烯的转化率为
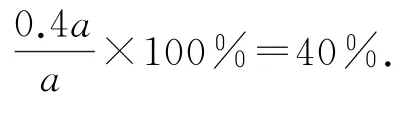

解题策略压强平衡常数表达式中,只出现气态物质.压强平衡常数Kp的计算步骤如下:
1)根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度,并求出各气体组分所占的物质的量分数或体积分数.
2)由气体分压计算公式计算各气体物质的分压,某气体的分压=气体总压强×该气体的体积分数(或各组分物质的量分数).
3)代入压强平衡常数计算公式计算.
综上所述,无论是浓度平衡常数还是压强平衡常数,计算时都要掌握好“一个模式”——三段式,写准“一个表达式”——平衡常数表达式,准确求出“一组数据”——各有关物质的平衡浓度或平衡分压,然后代入平衡常数表达式求解.
