氧化应激失衡在慢性阻塞性肺疾病急性加重期中的作用及其机制研究
2020-12-14王曦苑群黄莎邱国辉耑冰杨朝
王曦,苑群,黄莎,邱国辉,耑冰,杨朝
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)是一种严重危害人类健康的慢性病,目前其发病机制尚未被完全阐明。氧化应激失衡在慢性阻塞性肺疾病急性加重期(AECOPD)中的作用引起了研究者极大的关注,其中缺氧、感染等均可引起氧化应激反应增强,导致氧化应激产物在体内蓄积,对肺组织及全身造成损伤,从而加重AECOPD的发生和发展[1]。AECOPD致残率、致死率很高,及时评估AECOPD的严重程度、寻找新的治疗靶点是实现COPD总体控制目标的必由之路。
本研究组前期研究发现,急性缺氧可引起肺动脉平滑肌细胞(PASMCs)活性氧(reactive oxygen species,ROS)生成异常增加[2]。ROS是氧化应激的主要产物,人体内氧化/抗氧化失衡时,ROS的大量产生可造成炎性基因过度表达、激素受体结构破坏及抗氧化产物活性降低。ROS主要通过氧化细胞的DNA、蛋白质及脂质对机体产生氧化损伤,进一步引起细胞凋亡和组织损伤。8-羟基脱氧鸟苷(8-hydroxydeoxyguanosine,8-OHdG)是DNA氧化损伤的最终产物,能直接有效地评价细胞DNA损伤程度[3]。蛋白质羰基(protein carbonyls,PC)是机体蛋白质氨基酸侧链过氧化损伤的产物,其含量代表细胞蛋白水平的氧化损伤程度[4]。丙二醛(malondialdehyde,MDA)为脂质过氧化产物,可反映细胞膜脂质过氧化水平[5]。研究发现,内源性硫化氢(H2S)可以直接清除胎鼠大脑中的ROS,抑制NADPH氧化酶(NOX)活性,从而减轻氧化损伤[6]。同时亦有研究发现,在单核细胞中H2S可减轻机体的氧化应激损伤,提高机体抗氧化能力[7]。而机体总抗氧化能力(total antioxidant capacity,T-AOC)代表机体拮抗氧化应激损伤的总能力,可作为反映机体抗氧化水平的可靠指标[8]。但目前氧化应激失衡在AECOPD中作用机制的相关报道还较少。因此,本研究通过检测AECOPD患者血清ROS、8-OHdG、PC、MDA、H2S、T-AOC水平,旨在探讨氧化应激失衡在AECOPD中的作用及其机制。
1 对象与方法
1.1 研究对象 选取2016年10月—2017年3月于西北民族大学第一附属医院暨宁夏回族自治区人民医院呼吸内科住院的AECOPD患者60例为病例组。纳入标准:(1)符合《慢性阻塞性肺病全球倡议慢性阻塞性肺病指南(2013更新版)》[9]中关于COPD的诊断标准:第1秒用力呼气容积占用力肺活量百分比(FEV1/FVC)≤70%,且第1秒用力呼气容积占预计值百分比(FEV1%pred)<80%;(2)处于急性加重期,即呼吸道症状急性加重,且症状变化程度高于日常变异。排除标准:(1)COPD以外的其他呼吸系统疾病;(2)左心室收缩或舒张功能不全、急性心肌梗死、严重心律失常、不稳定型心绞痛、瓣膜性心脏病、心肌病;(3)严重的失代偿性肝、肾疾病;(4)脑卒中;(5)全身性自身免疫性疾病;(6)近期有重大手术史、创伤史;(7)近期有口服影响代谢类药物如免疫抑制剂等药物史;(8)不能配合肺功能检测者。
选择同期于西北民族大学第一附属医院暨宁夏回族自治区人民医院体检的健康者60例为对照组。
本研究经西北民族大学第一附属医院暨宁夏回族自治区人民医院伦理委员会批准(2017伦审【科研】第057号),受试者均签署知情同意书。
1.2 研究方法 病例组患者经14 d雾化吸入和抗感染等对症治疗后好转出院,14 d后门诊随访病情明显缓解,咳嗽、咳痰、气促等症状稳定或症状轻微,未超出日常变异,为COPD稳定期。
1.2.1 一般资料收集 收集受试者一般资料,包括年龄、性别、体质指数(BMI)、FEV1/FVC。
1.2.2 氧化应激指标(ROS、8-OHdG、PC、MDA)、抗氧化应激指标(H2S、T-AOC)及血气分析指标〔动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)〕检测 病例组患者分别于入院当日(急性加重期)及出院14 d后门诊随访当日(稳定期),对照组于体检当日,抽取外周静脉血4 ml、动脉血2 ml。静脉血2 h内于常温低速离心机上以4 000 r/min离心10 min(离心半径80 mm),收集上清液,分装置于-80 ℃冰箱冻存备用。(1)采用酶联免疫吸附试验(ELISA)[3]检测血清ROS、8-OHdG、PC、H2S(试剂盒购自上海酶联生物科技有限公司),测定450 nm处各孔吸光度(OD值),通过绘制标准曲线计算各指标水平。(2)采用硫代巴比妥酸反应比色法[4]检测血清MDA,于波长535 nm处测定各孔OD值,MDA=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准浓度×样品测试前稀释倍数,试剂盒购自南京建成生物工程研究所。(3)采用菲罗啉比色法[5]检测血清T-AOC,于波长490 nm处测定各孔OD值,绘制标准曲线计算T-AOC,试剂盒购自南京建成生物工程研究所。动脉血行血气分析,记录 PaO2及 PaCO2。
1.2.3 FEV1%pred检测 采用MasterCreen肺功能测定仪(购自德国Jaeger公司)检测受试者FEV1%pred,连续检测3次,取最佳值。根据《慢性阻塞性肺病全球倡议慢性阻塞性肺病指南(2013更新版)》[9]中的分期标准,将AECOPD患者进一步分为Ⅱ级亚组(50%≤FEV1%pred<80%,25例)、Ⅲ级亚组(30%≤FEV1%pred<50%,21例)、Ⅳ级亚组(FEV1%pred<30%,14例)。
1.2.4 肺动脉收缩压(pulmonary artery systolic pressure,PASP)检测 受试者均于平静呼吸5 min后由专业人员进行超声心动图检查。超声心动图诊断仪(iE33)购自美国Philips Andover公司。测量右房室瓣最大反流速度(V),然后根据伯努利公式计算跨右房室瓣反流压差(ΔP),ΔP=4V2;PASP=4V2+右心房压[10]。根据《2015年欧洲心脏病学会(ESC)/欧洲呼吸学会(ERS)肺动脉高压诊治指南》[11]推荐的PH诊断标准,以入院时PASP>50 mm Hg(6.67 kPa,1 mm Hg=0.133 kPa)为PH,将AECOPD患者进一步分为PH亚组(23例)、非PH亚组(37例)。
1.3 统计学方法 采用SPSS 20.0软件进行统计学分析。计量资料以(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料以相对数表示,组间比较采用χ2检验;两变量间的相关性分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 病例组与对照组一般资料比较 病例组与对照组年龄、性别、BMI比较,差异无统计学意义(P>0.05);病例组FEV1/FVC低于对照组,差异有统计学意义(P<0.05,见表 1)。
2.2 COPD患者急性加重期、稳定期与对照组氧化应激、抗氧化应激、血气分析指标及FEV1%pred、PASP比较 COPD患者急性加重期ROS、8-OHdG、PC、MDA、PaCO2、PASP高于对照组,H2S、T-AOC、PaO2、FEV1%pred低于对照组,差异有统计学意义(P<0.05,见表2)。COPD患者稳定期ROS、8-OHdG、PC、MDA、PASP高于对照组,H2S、T-AOC、PaO2、FEV1%pred低于对照组,差异有统计学意义(P<0.05);COPD患者稳定期与对照组PaCO2比较,差异无统计学意义(P>0.05,见表3)。COPD患者急性加重期 ROS、8-OHdG、PC、MDA、PaCO2、PASP高于稳定期,H2S、T-AOC、PaO2低于稳定期,差异有统计学意义(P<0.05);COPD患者急性加重期与稳定期FEV1%pred比较,差异无统计学意义(P>0.05,见表4)。
2.3 Ⅱ级亚组、Ⅲ级亚组、Ⅳ级亚组氧化应激、抗氧化应激、血气分析指标及PASP比较 Ⅱ级亚组、Ⅲ级亚组、Ⅳ级亚组ROS、8-OHdG、PC、MDA、H2S、T-AOC、PaO2、PaCO2、PASP比较,差异有统计学意义(P<0.05)。Ⅲ级亚组PC、MDA高于Ⅱ级亚组,H2S、T-AOC低于Ⅱ级亚组,差异有统计学意义(P<0.05);Ⅳ级亚组ROS、8-OHdG、PC、MDA、PaCO2、PASP高于Ⅱ级亚组、Ⅲ级亚组,H2S、T-AOC、PaO2低于Ⅱ级亚组、Ⅲ级亚组,差异有统计学意义(P<0.05,见表5)。
2.4 PH亚组与非PH亚组氧化应激、抗氧化应激、血气分析指标及FEV1%pred比较 PH亚组ROS、8-OHdG、PC、MDA、PaCO2高于非PH亚组,H2S、T-AOC、PaO2低于非PH亚组,差异有统计学意义(P<0.05);PH亚组与非PH亚组FEV1%pred比较,差异无统计学意义(P>0.05,见表6)。

表1 病例组与对照组一般资料比较Table 1 Comparison of general data between case group and control group
表2 COPD患者急性加重期与对照组氧化应激、抗氧化应激、血气分析指标及FEV1%pred、PASP比较(±s)Table 2 Comparison of oxidative stress,antioxidant stress,blood gas analysis indexes and FEV1%pred,PASP between COPD patients in acute exacerbation stage and control group
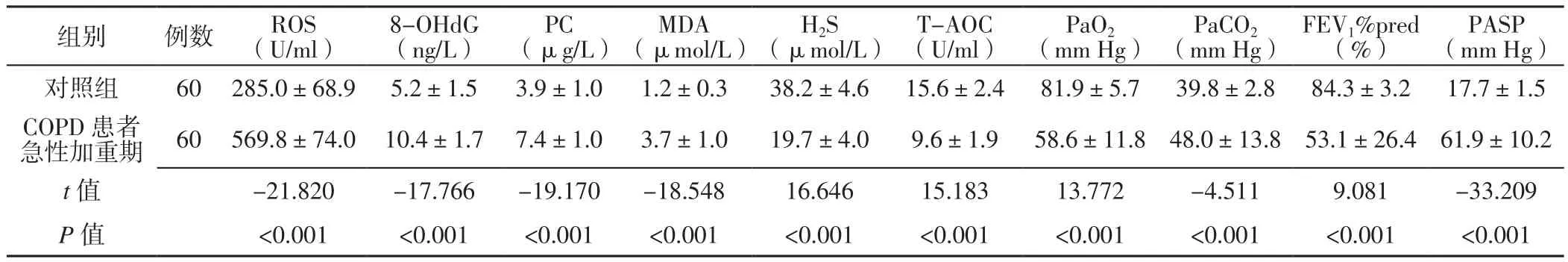
表2 COPD患者急性加重期与对照组氧化应激、抗氧化应激、血气分析指标及FEV1%pred、PASP比较(±s)Table 2 Comparison of oxidative stress,antioxidant stress,blood gas analysis indexes and FEV1%pred,PASP between COPD patients in acute exacerbation stage and control group
注:ROS=活性氧,8-OHdG=8-羟基脱氧鸟苷,PC=蛋白质羰基,MDA=丙二醛,H2S=硫化氢,T-AOC=总抗氧化能力,PaO2=动脉血氧分压,PaCO2=动脉血二氧化碳分压,FEV1%pred=第1秒用力呼气容积占预计值百分比,PASP=肺动脉收缩压;COPD=慢性阻塞性肺疾病
组别 例数 ROS(U/ml)8-OHdG(ng/L)PC(μg/L)MDA(μmol/L)H2S(μmol/L)T-AOC(U/ml)PaO2(mm Hg) PaCO2(mm Hg)FEV1%pred(%)PASP(mm Hg)对照组 60 285.0±68.9 5.2±1.5 3.9±1.0 1.2±0.3 38.2±4.6 15.6±2.4 81.9±5.7 39.8±2.8 84.3±3.2 17.7±1.5 COPD患者急性加重期 60 569.8±74.0 10.4±1.7 7.4±1.0 3.7±1.0 19.7±4.0 9.6±1.9 58.6±11.8 48.0±13.8 53.1±26.4 61.9±10.2 t值 -21.820 -17.766 -19.170 -18.548 16.646 15.183 13.772 -4.511 9.081 -33.209 P 值 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
表3 COPD患者稳定期与对照组氧化应激、抗氧化应激、血气分析指标、FEV1%pred、PASP比较(±s)Table 3 Comparison of oxidative stress,antioxidant stress,blood gas analysis indexes and FEV1%pred,PASP between COPD patients at stable stage and control group

表3 COPD患者稳定期与对照组氧化应激、抗氧化应激、血气分析指标、FEV1%pred、PASP比较(±s)Table 3 Comparison of oxidative stress,antioxidant stress,blood gas analysis indexes and FEV1%pred,PASP between COPD patients at stable stage and control group
组别 例数 ROS(U/ml)8-OHdG(ng/L)PC(μg/L)MDA(μmol/L)H2S(μmol/L)T-AOC(U/ml)PaO2(mm Hg) PaCO2(mm Hg)FEV1%pred(%)PASP(mm Hg)对照组 60 285.0±68.9 5.2±1.5 3.9±1.0 1.2±0.3 38.2±4.6 15.6±2.4 81.9±5.7 39.8±2.8 84.3±3.2 17.7±1.5 COPD 患者稳定期 60 396.9±83.4 8.1±1.3 5.2±1.1 2.6±0.8 24.4±7.3 11.7±1.9 68.4±22.0 41.6±9.7 54.0±24.7 54.2±5.1 t值 -7.965 -11.317 -6.774 -12.692 12.389 9.869 4.601 1.342 9.456 -53.184 P 值 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 0.184 <0.001 <0.001
2.5 AECOPD患者氧化应激指标、抗氧化应激指标、PaO2与FEV1%pred、PASP的相关性分析 AECOPD患者 ROS、8-OHdG、PC、MDA与 FEV1%pred呈 负 相关,与PASP呈正相关(P<0.05);H2S、T-AOC与FEV1%pred呈正相关,H2S、T-AOC、PaO2与PASP呈负相关(P<0.05,见表7)。
3 讨论
气道阻塞和肺气肿是COPD患者气道损伤的主要病理学改变,而肺血管收缩、重塑是COPD相关PH患者主要的病理生理改变。研究发现,氧化应激不仅直接损伤肺组织,而且可激活相应的分子机制,导致肺内炎症、抗蛋白酶氧化失活和气道黏液高分泌等病理改变,从而促进AECOPD的发生、发展[1]。ROS作为氧化应激的主要代谢产物,可以通过氧化损伤DNA、蛋白质及诱导脂质过氧化、活化肥大细胞等方式引起一系列病理生理改变[2]。本研究结果显示,COPD患者急性加重期ROS、8-OHdG、PC、MDA、PaCO2、PASP高于对照组,而PaO2、FEV1%pred低于对照组;COPD患者急性加重期ROS、8-OHdG、PC、MDA、PaCO2、PASP高于稳定期,PaO2低于稳定期,考虑在COPD发病时存在氧化应激失衡、高碳酸血症及肺血管压力上升,而在AECOPD时上述表现更加明显。Ⅲ级亚组PC、MDA高于Ⅱ级组;Ⅳ级亚组ROS、8-OHdG、PC、MDA、PaCO2、PASP高于Ⅱ级亚组、Ⅲ级亚组,提示氧化应激失衡随着肺功能的下降而加重。AECOPD患者PaO2与PASP呈负相关,提示缺氧与肺动脉压力有关。AECOPD患者ROS、8-OHdG、PC与FEV1%pred呈负相关,提示ROS、8-OhdG、PC水平越高,患者气道阻塞程度越重,推测缺氧可引起PASMCs产生内源性ROS,ROS通过损伤DNA、蛋白质,诱发气道阻塞,进而在AECOPD发生及发展中起重要作用。AECOPD患者MDA与FEV1%pred呈负相关,但相关性不大(r<0.400),考虑可能与糖皮质激素干扰有关。COPD患者稳定期ROS、8-OHdG、PC、MDA、PASP高于对照组,PaO2、FEV1%pred低于对照组,提示即使COPD患者处于稳定期,其也可能存在氧化应激失衡。罗勇等[12]通过烟雾产生外源性ROS损伤大鼠肺组织,测得损伤肺组织中8-OHdG、PC、MDA水平较对照组明显升高,间接提示氧化应激负荷增加与COPD患者肺损伤有关,本研究结果与其一致。
表4 COPD患者急性加重期与稳定期氧化应激、抗氧化应激、血气分析指标、FEV1%pred、PASP比较(±s)Table 4 Comparison of oxidative stress,antioxidant stress,blood gas analysis indexes and FEV1%pred,PASP between acute exacerbation stage and stable stage of COPD patients

表4 COPD患者急性加重期与稳定期氧化应激、抗氧化应激、血气分析指标、FEV1%pred、PASP比较(±s)Table 4 Comparison of oxidative stress,antioxidant stress,blood gas analysis indexes and FEV1%pred,PASP between acute exacerbation stage and stable stage of COPD patients
组别 例数 ROS(U/ml)8-OHdG(ng/L)PC(μg/L)MDA(μmol/L)H2S(μmol/L)T-AOC(U/ml)PaO2(mm Hg) PaCO2(mm Hg)FEV1%pred(%)PASP(mm Hg)COPD患者急性加重期 60 569.8±74.0 10.4±1.7 7.4±1.0 3.7±1.0 19.7±4.0 9.6±1.9 58.6±11.8 48.0±13.8 53.1±26.4 61.9±10.2 COPD患者稳定期 60 396.9±83.4 8.1±1.3 5.2±1.1 2.6±0.8 24.4±7.3 11.7±1.9 68.4±22.0 41.6±9.7 54.0±24.7 54.2±5.1 t值 12.012 8.325 11.463 6.653 -4.374 -6.054 -3.041 2.939 -0.178 5.230 P 值 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 0.003 0.004 0.859 <0.001
表5 Ⅱ级亚组、Ⅲ级亚组、Ⅳ级亚组氧化应激、抗氧化应激、血气分析指标及PASP比较(±s)Table 5 Comparison of indexes of oxidative stress,antioxidant stress and blood gas analysis and PASP in grade Ⅱ,Ⅲ and Ⅳ subgroups

表5 Ⅱ级亚组、Ⅲ级亚组、Ⅳ级亚组氧化应激、抗氧化应激、血气分析指标及PASP比较(±s)Table 5 Comparison of indexes of oxidative stress,antioxidant stress and blood gas analysis and PASP in grade Ⅱ,Ⅲ and Ⅳ subgroups
注:与Ⅱ级亚组比较,aP<0.05;与Ⅲ级亚组比较,bP<0.05
组别 例数 ROS(U/ml)8-OHdG(ng/L)PC(μg/L)MDA(μmol/L)H2S(μmol/L)T-AOC(U/ml)PaO2(mm Hg) PaCO2(mm Hg)PASP(mm Hg)Ⅱ级亚组 25 553.5±57.7 9.7±1.1 6.7±0.3 3.5±0.7 22.2±1.5 10.7±0.8 64.2±6.2 45.6±11.4 54.9±5.8Ⅲ级亚组 21 567.9±53.4 10.0±2.1 7.6±0.7a 4.0±0.7a 19.7±3.4a 9.9±1.1a 61.5±8.1 45.1±10.4 53.8±4.7Ⅳ级亚组 14 608.9±34.8ab 11.0±1.0ab 8.3±0.1ab 4.5±0.2ab 17.4±1.6ab 8.7±1.0ab 54.3±7.4ab 56.4±5.3ab 61.2±10.9ab F值 5.218 3.402 57.570 11.934 19.241 19.515 8.604 6.602 5.207 P值 0.008 0.040 <0.001 <0.001 <0.001 <0.001 0.001 0.003 0.008
表6 PH亚组与非PH亚组氧化应激、抗氧化应激、血气分析指标及FEV1%pred比较(±s)Table 6 Comparison of indexes of oxidative stress,antioxidant stress and blood gas analysis and FEV1%pred in PH and non PH subgroups
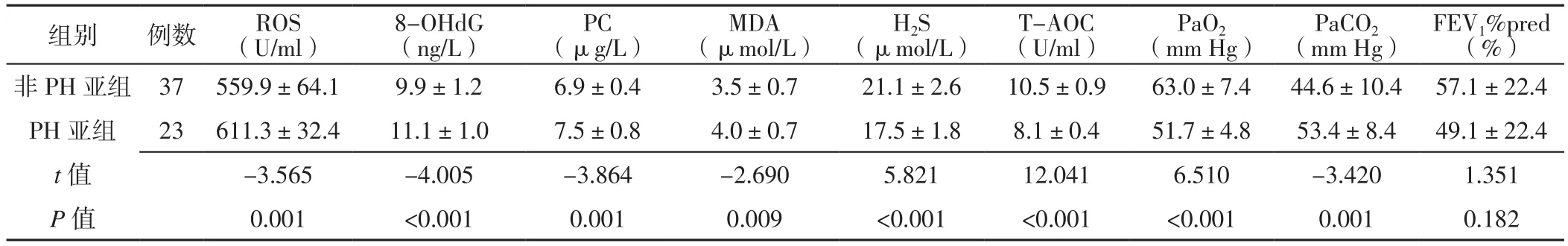
表6 PH亚组与非PH亚组氧化应激、抗氧化应激、血气分析指标及FEV1%pred比较(±s)Table 6 Comparison of indexes of oxidative stress,antioxidant stress and blood gas analysis and FEV1%pred in PH and non PH subgroups
注:PH=肺动脉高压
组别 例数 ROS(U/ml)8-OHdG(ng/L)PC(μg/L)MDA(μmol/L)H2S(μmol/L)T-AOC(U/ml)PaO2(mm Hg) PaCO2(mm Hg)FEV1%pred(%)非PH亚组 37 559.9±64.1 9.9±1.2 6.9±0.4 3.5±0.7 21.1±2.6 10.5±0.9 63.0±7.4 44.6±10.4 57.1±22.4 PH 亚组 23 611.3±32.4 11.1±1.0 7.5±0.8 4.0±0.7 17.5±1.8 8.1±0.4 51.7±4.8 53.4±8.4 49.1±22.4 t值 -3.565 -4.005 -3.864 -2.690 5.821 12.041 6.510 -3.420 1.351 P 值 0.001 <0.001 0.001 0.009 <0.001 <0.001 <0.001 0.001 0.182

表7 AECOPD患者氧化应激指标、抗氧化应激指标、PaO2与FEV1%pred、PASP的相关性分析Table 7 Correlation analysis of oxidative stress indexes,antioxidant stress indexes,PaO2 and FEV1% pred and PASP in AECOPD patients
缺氧是导致肺血管收缩、重塑的主要原因之一。本研究组前期研究发现,PASMCs线粒体电子传递链酶复合体可以感受缺氧,引起ROS生成增加,导致PASMCs收缩增强[2,13]。长期反复的肺血管异常收缩可促进肺血管细胞增殖,最终导致PH的形成。但ROS是否可以通过损伤肺通气功能引发通气/血流比例(V/Q)失调、肺泡换气能力下降,进而诱发缺氧进一步加重,从而导致PASP上升,尚待进一步临床研究证实。本研究结果显示,PH亚组ROS、8-OHdG、PC、MDA、PaCO2高于非PH亚组,PaO2低于非PH亚组,提示AECOPD患者在合并PH的情况下,缺氧的程度与氧化应激程度更加严重。相关性分析结果显示,AECOPD患者ROS、8-OHdG、PC、MDA与PASP呈正相关,说明氧化应激损伤程度越重,PASP升高、肺血管重构程度越明显,提示ROS的氧化应激损伤可能通过损伤肺通气功能,进而与PH的发病有关。PEREZ-VIICAINO等[14]通过抗氧化处理,有效地抑制了鼠肺动脉血管重构及PH的程度,提示ROS与PH的病理生理改变相关,本研究结果与其一致。
内源性H2S具有强大的抗氧化及抗炎作用。T-AOC代表了机体整体抗氧化体系,包括抗氧化酶(如超氧化物歧化酶等)、非抗氧化酶(H2S等)两类抗氧化系统,这些抗氧化物质可清除自由基,减轻氧化应激对机体的损伤。氧化应激过度消耗抗氧化物时,T-AOC水平降低。本研究结果显示,COPD患者急性加重期、稳定期H2S、T-AOC均低于对照组,COPD患者急性加重期H2S、T-AOC低于稳定期;Ⅲ级亚组H2S、T-AOC低于Ⅱ级亚组,Ⅳ级亚组H2S、T-AOC低于Ⅱ级亚组、Ⅲ级亚组;PH亚组H2S、T-AOC低于非PH亚组;AECOPD患者H2S、T-AOC与FEV1%pred呈正相关,与PASP呈负相关。提示AECOPD发作时过度消耗了体内的抗氧化物质,且疾病程度越重或者合并PH时,抗氧化物质水平下降也越明显;这也进一步说明,AECOPD患者体内抗氧化能力下降,存在氧化/抗氧化失衡。朱宏伟等[15]研究显示,外源性给予H2S能够减轻大鼠肺组织的氧化应激和炎性反应。而增加血清H2S能否改善AECOPD症状有待进一步实验证实。
综上所述,氧化应激失衡参与了AECOPD的发病,表现为氧化应激指标(ROS、8-OHdG、PC、MDA)异常升高和抗氧化应激指标(H2S、T-AOC)异常下降;其机制可能为ROS通过损伤DNA(增加8-OHdG)、蛋白质(增加PC)及脂质水平(增加MDA)参与AECOPD及其相关PH的发生与发展。但本研究仅对患者血清氧化应激、抗氧化应激指标进行分析,并未对肺组织氧化应激、抗氧化应激指标进行检测,后期可通过动物实验进一步验证本研究结论。
作者贡献:王曦进行文章构思、设计及文献整理,撰写论文;苑群负责整理数据;黄莎负责病例分组,文章校正;邱国辉负责摘要修订;耑冰负责文章质量控制;杨朝负责全文质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
