3株奶牛生殖道分离乳酸菌的益生特性评价
2020-12-11宋朋杰武小虎王东升杨洁李亚娟蒋威沈文祥邵丹严作廷
宋朋杰 武小虎 王东升 杨洁 李亚娟 蒋威 沈文祥 邵丹 严作廷
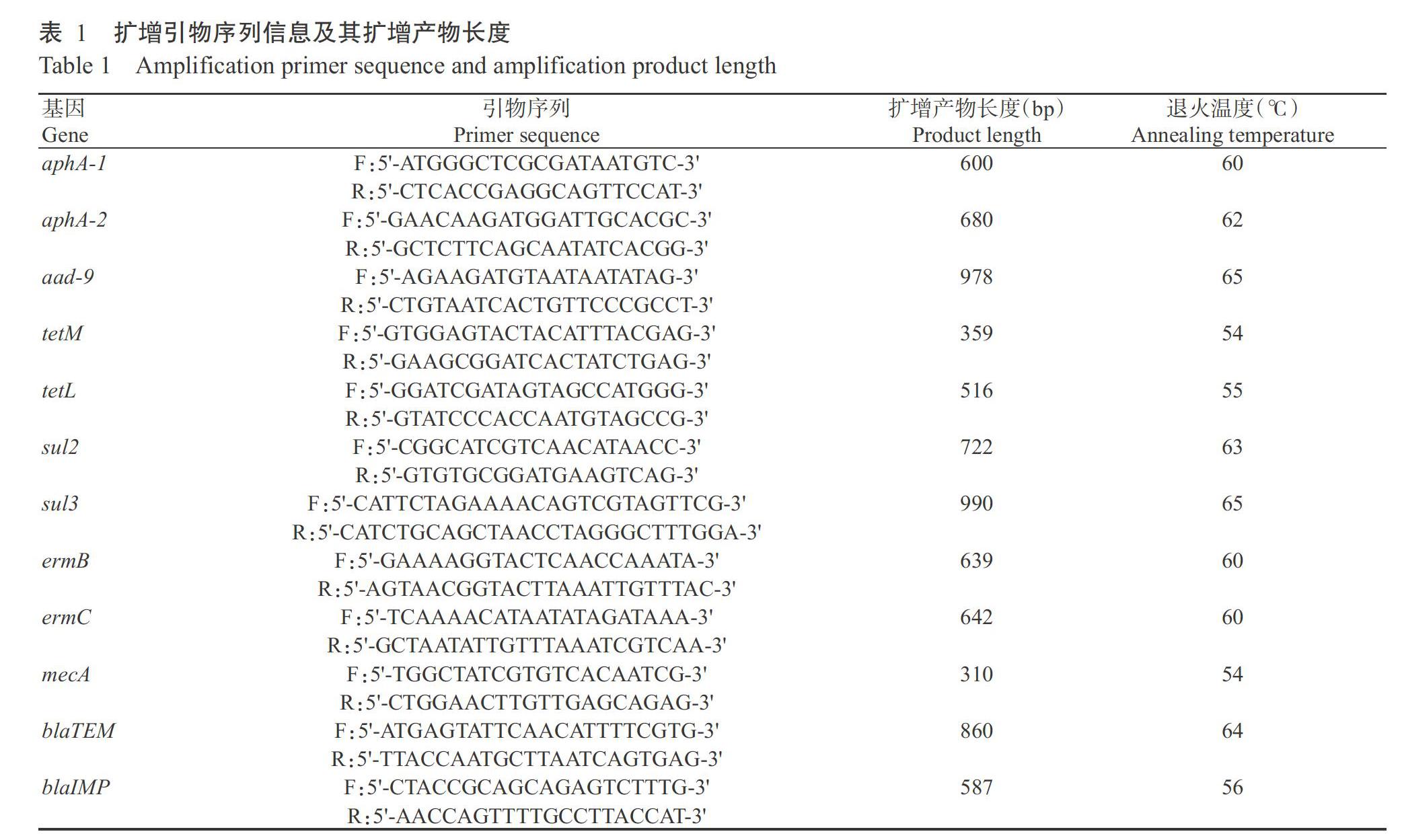

摘要:【目的】評价健康奶牛生殖道分离乳酸菌益生特性,发掘其作为益生菌制剂细菌成分的可能性,为开发防治奶牛子宫内膜炎的微生态制剂提供科学依据。【方法】以直肠把握法无菌采集产后40~60 d健康奶牛子宫分泌物,采用MRS培养基在厌氧条件(氧气浓度<1.2%,37 ℃)下分离乳酸菌,通过扩增16S rDNA序列进行鉴定,并进行抑菌活性、耐药性、黏附子宫内膜上皮细胞特性及安全性评估,分析其开发成益生菌制剂的可能性。【结果】经16S rDNA测序分析共获得8株乳酸菌,分别为植物乳杆菌、副干酪乳杆菌、蜡样芽孢杆菌、鼠李糖杆菌、蒙氏肠球菌、德氏乳杆菌、戊糖乳杆菌和嗜热链球菌,根据预试验结果选取其中3株(植物乳杆菌、副干酪乳杆菌和鼠李糖杆菌)进行益生特性评价。3株奶牛生殖道乳酸菌培养上清液对大肠杆菌、无乳链球菌及金黄色葡萄球菌均表现出良好的抑制效果,约在接种 3 h后进入典型的指数生长期,生长至平台期后植物乳杆菌OD620 nm为1.375、鼠李糖杆菌OD620 nm为1.314、副干酪乳杆菌OD620 nm为1.250。副干酪乳杆菌的产酸能力最强,植物乳杆菌和鼠李糖杆菌的产酸能力几乎相同,但均不产H2O2。3株奶牛生殖道乳酸菌对青霉素G、氯霉素、阿莫西林、氨苄西林、头孢噻肟、头孢唑林和四环素等7种抗菌药物高度敏感;能同时检测到磺胺类耐药基因sul2,在副干酪乳杆菌和鼠李糖杆菌中还同时检测到氨基糖苷类耐药基因aphA-2和β-内酰胺类耐药基因blaIMP。副干酪乳杆菌能很好地黏附于奶牛子宫内膜上皮细胞,且黏附效率与副干酪乳杆菌浓度呈正相关。3株奶牛生殖道乳酸菌的混合菌液经腹腔注射小鼠后未引起脏器病变,且对小鼠的行为活动、采食饮水亦无明显影响。【结论】从奶牛生殖道分离获得的植物乳杆菌、副干酪乳杆菌和鼠李糖杆菌可作为潜在的益生菌,用于开发防治奶牛子宫内膜炎的微生态制剂。
关键词: 奶牛;生殖道;乳酸菌;子宫内膜炎;益生特性;微生态制剂
中图分类号: S852.6 文献标志码: A 文章编号:2095-1191(2020)09-2278-09
Probiotic evaluation of three strains of lactic acid
bacteria isolated from cow genital tract
SONG Peng-jie1, WU Xiao-hu1*, WANG Dong-sheng1, YANG Jie1, LI Ya-juan1,2,
JIANG Wei1, SHEN Wen-xiang1, SHAO Dan1, YAN Zuo-ting1*
(1Lanzhou Institude of Husbandry and Pharmaceutical Sciences, Chinese Academic of Agricultural Sciences/Key Laboratory of Veterinary Pharmaceutical Development of Ministry of Agriculture and Rural Affairs/Engineering & Technology Research Center of Traditional Chinese Veterinary Medicine of Gansu Province, Chinese Academic of Agricultural Sciences, Lanzhou 730050, China; 2College of Animal Science and Technology,
Guangxi University, Nanning 530004, China)
Abstract:【Objective】To evaluate the probiotic characteristics of lactic acid bacteria isolated from the reproductive tract of dairy cows, explore its potential to be bacterial component to provide raw materials for microecological agents, and offer theoretical basis for the development of microecological agents for prevention and treatment of endometritis in cows. 【Method】The vaginal secretions of healthy dairy cows from 40 to 60 d after parturition were collected aseptically by rectal palpation method. Lactic acid bacteria were isolated by MRS medium under anaerobic conditions(oxygen concentration <1.2%, 37 ℃). The antimicrobial activity, drug resistance, adhesion to endometrial epithelial cells and safety were evaluated to analyze the possibility of its development as probiotics by 16S rDNA sequence amplification. 【Result】A total of 8 lactic acid bacteria were obtained by 16S rDNA sequencing, including Lactobacillus plantarum, L. paracasei, Bacillus cereus, Rhamnose lactobacillus, Enterococcus mongholicus, L. delbrueckii, L. pentosus and Streptococcus thermophilus. According to the preliminary experimental results, three of them(L. plantarum, L. paracasei and Rhamnose lactobacillus) were selected for probiotic evaluation. About 3 h after inoculation, all three strains entered the typical exponential growth phase,and the supernatant of genital tractlactic acid bacteria showed fine inhibition to Escherichia coli, Streptococcus agalactiae and Staphylococcus aureus, and the OD620nm of L. plantarum was 1.375, R. lactobacillus was 1.314, L. paracasei was 1.250 at platform stage. L. paracasei had the strongest acid producing ability, while L. plantarum and R. lactobacillus had almost the same acid production capacity, but they did not produce H2O2. Three strains of genital tract lactic acid bacteria were sensitive to 7 antibiotics such as penicillin G, chloramphenicol, amoxicillin, ampicillin, cefotaxime, cefazolin and tetracycline, and sulfa resistance genes sul2 were detected. In L. paracasei and L. rhamnosus, amino glycoside resistance gene aphA-2 and β-lactam resistance gene blaIMP were detected. L. paracasei could adhere to epithelial cells of genital tract, and adhesion rate was positively correlated with L. paracasei concentration. The mixed bacteria liquid of the three strains of lactic acid bacteria isolated from the reproductive tract of cows were injected into rat, and did not cause visceral diseases, and had no obvious effects on behavior and ingestion of rat. 【Conclusion】L. plantarum,L. paracasei and L. rhamnosus have the potential as probiotics to further develop lactic acid bacteria microecological preparations.
Key words: cows; genital tract; lactic acid bacteria; endometritis; probiotic characters; microecological preparations
Foundation item:National Key Research and Development Program(2017YFD0502201); Central Public-interest Scientific Institution Basal Research Fund(1610322018003); Lanzhou Science and Technology Planning Project(2018-1-100)
0 引言
【研究意义】子宫内膜炎作为奶牛产后的一种多发病,是导致奶牛不孕、受孕率低下及空怀期延长的主要病因。据统计,在不孕奶牛中患子宫内膜炎的比例高达95%(Zobel,2013;马帅等,2018;邵丹等,2019)。患子宫内膜炎的奶牛因其子宫局部存在炎症,而阻碍精子运行及受精卵着床,严重影响生殖激素水平,致使其繁殖效率明显降低,给整个奶牛业带来巨大经济损失。益生菌(Probiotics)是指适当摄入后对宿主产生各种有益影响的可传代培养微生物(Prado et al.,2015;杨虹等,2019),具有抵抗机体各种不利条件(唾液酶、低pH、胰液和胆汁等)的能力,且能在胃肠道黏膜、呼吸道黏膜、乳腺上皮及子宫内膜上皮等部位定殖而发挥生物学功能,有利于宿主微生物环境的调节(Zoumpopoulou et al.,2017)。乳酸菌是最常见的一种益生菌,具有绿色安全的特点,在维持奶牛胃肠道菌群平衡上已得到广泛应用。Peter等(2018)研究表明,将布氏乳杆菌投入患子宫内膜炎奶牛子宫中能显著降低IL-1β和IL-8等炎性细胞因子的释放,对奶牛子宫内膜炎症反应具有明显抑制作用。因此,开展健康奶牛生殖道分离乳酸菌的益生特性评价,对开发防治奶牛子宫内膜炎的微生态制剂具有重要意义。【前人研究进展】目前,已有采用益生菌治疗牛子宫内膜炎的相关研究报道。Otero等(2006)从健康奶牛生殖道分离获得76株乳酸菌,且证实大部分菌株能抑制奶牛子宫内膜炎病原菌的生长。McFarland(2014)研究表明,将鼠李糖乳杆菌、乳酸片球菌和罗伊氏乳杆菌按25∶25∶2比例组合后,能明显降低原代子宫内膜上皮细胞的大肠杆菌感染率,并使IL-8和IL-1β的表达量分别降低4.7和2.2倍。Liu等(2016)研究发现,从健康奶牛生殖道内分离获得的鼠李糖乳杆菌GR-1能改善大肠杆菌诱导破坏的奶牛子宫内膜上皮细胞超微结构,限制炎症反应,降低细胞凋亡概率,即具有预防奶牛产后子宫疾病的功效。Genís等(2016)研究发现,鼠李糖乳杆菌、乳酸片球菌、罗伊氏乳杆菌和萨克乳杆菌均能有效抑制大肠杆菌感染子宫内膜上皮细胞,并降低炎性细胞因子IL-8和IL-1β的表达,在调节奶牛子宫内膜炎和炎症反应方面具有巨大潜力。桑梦琪等(2018)研究证实从健康奶牛子宫颈口分离到的乳酸菌具有良好安全性。关于乳酸菌对奶牛生殖健康潜在的有益影响,李炳志(2008)从健康奶牛子宫分离乳酸菌并制成发酵上清液,对21头患子宫内膜炎的奶牛进行子宫灌注治疗,结果显示其有效率为95.23%(20/21),治愈率达85.71%(18/21);侯荣伦(2011)研究发现健康奶牛生殖道内的优势菌群为乳酸菌,并分離出4株对金黄色葡萄球菌和致病性大肠杆菌具有很强抑制作用的乳酸菌,可作为开发奶牛生殖道微生态制剂的潜在菌株;李向楠(2014)从产后30~60 d的健康奶牛子宫颈口分离获得4株乳酸菌,并证实其对致病性大肠杆菌具有抑菌作用;Prabhurajeshwar和Chandrakanth(2017)在产后奶牛生殖道内投放益生菌,结果发现其能有效调节奶牛生殖道菌群平衡,阻止致病性微生物群在生殖道内定殖,进而有效防止奶牛产后子宫内膜炎的发生;Peter等(2018)研究发现布氏乳杆菌能提高患亚临床奶牛子宫内膜炎奶牛受孕率,且能降低子宫内膜趋化因子(CXCL1/2、CXCL3和CXC)的表达量。【本研究切入点】乳酸菌代谢产物对多种致病性、产毒性和腐败性微生物具有抑制作用,且在平衡生殖道和胃肠道菌群紊乱及疾病预防方面发挥关键作用(Perczak et al.,2018)。抗生素的使用虽然在很大程度上减少了乳房炎及子宫内膜炎造成的危害,但同时诱发日趋严重的细菌耐药性问题,因此研发新型高效的益生菌制剂替代抗生素用于临床治疗已成为趋势(Francoz et al.,2017)。至今,奶牛子宫内膜炎的治疗仍以抗生素为主,尚无用于防治奶牛子宫内膜炎的微生态制剂上市。【拟解决的关键问题】以临床分离的乳酸菌为研究对象,进行抑菌活性、耐药性、黏附子宫内膜上皮细胞特性及安全性评估,分析其作为益生菌制剂细菌成分的可能性,为开发防治奶牛子宫内膜炎的微生态制剂提供科学依据。
1 材料与方法
1. 1 试验材料
试验所涉及样品均采集自甘肃省规模化奶牛养殖场产后40~60 d的健康奶牛;致病性大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphglococcas aureus)和无乳链球菌(Streptococcus agalactiae)由中国农业科学院兰州畜牧与兽药研究所中兽医研究室分离保存;原代奶牛子宫内膜上皮细胞由中国农业大学王九峰教授课题组惠赠;营养肉汤培养基、MRS培养基、MRS肉汤培养基、MHA琼脂培养基、血平板培养基及牛津杯等购自广东环凯微生物科技有限公司。3,3',5,5'-四甲基联苯胺(TMB)、辣根过氧化物酶(HRP)购自北京索莱宝科技有限公司;青霉素、氯霉素及苯唑西林等13种药敏纸片购自Oxoid Limited公司;Gibco胎牛血清和Gibco兽用子宫培养拭子购自古氏贸易(上海)有限公司;M0401通用细菌采样管、0.22 μm细菌滤器及细菌DNA提取试剂盒购自OMEGA公司;16S rDNA PCR试剂盒购自TaKaRa公司。主要仪器设备:Ettler Toledo便携式pH计,麦氏比浊仪,UV-BlueStar Plus紫外—可见光分光光度计,LAI-3-T厌氧培养箱,生物安全柜等。
1. 2 样品采集及乳酸菌分离
从多个规模化奶牛场采集产后健康奶牛的子宫分泌物。采用直肠把握法触摸子宫颈和子宫角,以判断子宫复旧是否良好,选择子宫复旧良好、卵巢无异常的奶牛进行采样。采样时以温水冲洗奶牛外阴,再用75%酒精棉球对外阴进行消毒,将兽用培养拭子轻轻插入阴道,右手通过直肠辅助将拭子经子宫颈进入子宫体内,将拭子头从管体中推出并在子宫内轻轻晃动,以保证其充分接触到子宫内膜,然后将拭子向后拉入管体,避免污染。取出拭子迅速折断,将粘有子宫分泌物的脱脂棉部分置于细菌专用采样管内,冰浴6 h内带回实验室进行细菌分离。
1. 3 试验方法
1. 3. 1 乳酸菌分离鉴定 将采集的样本用无菌棉签小心涂布于MRS培养基上,在厌氧(氧气浓度小于1.2%)培养箱中37 ℃培养24~36 h,将生长良好的典型菌落反复接种至MRS培养基上,直至菌落形态一致,经革兰氏染色镜检,并提取DNA用于扩增16S rDNA序列。PCR扩增引物为5'-GAGCGGATAAC AATTTCACACAGG-3'和5'-CGCCAGGGTTTTCCC AGTCACGAC-3',扩增程序:94 ℃预变性5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1.5 min,进行30个循环;72 ℃延伸5 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后进行测序,测序结果输入NCBI核酸数据库进行比对分析。
1. 3. 2 微量稀释法和牛津杯法测试乳酸菌抑菌能力 将分离乳酸菌接种于MRS肉汤培养基中,厌氧下37 ℃培养24 h后4000 r/min离心20 min,取上清液用细菌过滤嘴过滤后备用;将过夜培养的大肠杆菌、金黄色葡萄球菌和无乳链球菌调整至0.5麦氏接种于MHA药敏培养基上,每个培养基放置3只经高压灭菌的牛津杯,牛津杯中加入乳酸菌培养上清液0.2 mL,置于37 ℃培养箱中培养24 h后读取抑菌圈直径。取无菌96孔板,检测乳酸菌培养上清液的最小抑菌浓度(MIC)。A1~A12每孔加入0.3 mL乳酸菌培养上清液,其余每孔加入0.1 mL MH肉汤培养基,以排枪从A1~A12每孔吸0.1 mL至B1~B12,混匀后吸0.1 mL至C1~C12,依次进行二倍稀释直至H1~H12。调整过夜培养的大肠杆菌、金黄色葡萄球菌和无乳链球菌浓度,按1%比例接种至96孔板中,最后3列不接种作为空白对照,37 ℃培养24 h后检测其抑菌效果。
1. 3. 3 乳酸菌耐药性及耐药基因检测 将过夜培养的分离乳酸菌浓度调整至0.5麦氏,取0.2 mL涂布于MRS培养基上,采用药敏纸片法测定乳酸菌对13种抗菌药物的敏感性。采用细菌DNA提取试剂盒提取乳酸菌基因组DNA,通过PCR检测氨基糖苷类、β-内酰胺类、大环内酯类、四环素类和磺胺类等抗菌药物的常见耐药基因。特异性引物及扩增片段大小见表1。PCR扩增程序:94 ℃预变性5 min;94 ℃ 1 min,退火30 s,72 ℃ 1 min,进行35个循环;72 ℃延伸10 min。
1. 3. 4 乳酸菌生长曲线及产酸产H2O2能力测定 将过夜培养的新鲜乳酸菌液按1%比例接种于MRS肉汤培养基中,每隔2 h取样检测OD620 nm及培养物上清液pH,绘制乳酸菌的生长曲线和产酸曲線。TMB溶于二甲基亚砜(DMSO)配制TMB溶液(15 mg/mL),HRP溶于无菌水配制HRP溶液(10 mg/mL),将二者加入高压灭菌的MRS培养基中,最终每个培养基中含5.0 mg TMB和0.2 mg HRP。然后将植物乳杆菌、副干酪乳杆菌和鼠李糖杆菌接种至MRS培养基上,置于厌氧培养箱中培养,用于鉴别H2O2。HRP催化H2O2产生O2,而TMB在O2存在的情况下可将菌落染成蓝色(Rodríguez et al.,2011)。即产H2O2的菌落为蓝色,不产H2O2的菌落则不变色。
1. 3. 5 奶牛子宫内膜上皮细胞传代培养 正常奶牛子宫内膜上皮细胞贴壁生长,呈典型的铺路石状。复苏后无菌条件传代,弃细胞培养液,以PBS洗涤3次,去除细胞碎片和代谢产物,加入0.5 mL 0.25%胰酶,置于37 ℃细胞培养箱中消化5 min,待细胞变圆润、细胞间隙变大,且倒置显微镜下观察有少量圆润细胞漂浮时结束消化,弃胰酶,加入高糖型DMEM液体培养基,调整浓度至2.0×105个/mL,按10%比例加入胎牛血清,吹打成均匀的单个细胞后分装于细胞培养瓶(5 mL/瓶)。
1. 3. 6 乳酸菌黏附子宫内膜上皮细胞试验 新鲜培养的奶牛子宫上皮细胞以高糖型DMEM液体培养基稀释至1×105个/mL,按2.0 mL/孔接种于置有细胞爬片的6孔培养板中,培养24 h贴壁后备用;过夜培养的乳酸菌以PBS进行稀释,经4000 r/min离心洗涤2次后以等体积的高糖型DMEM液体培养基重悬,分别按100∶1、600∶1和1000∶1的比例[细菌数(CFU/mL)∶细胞数(个/mL)]加入6孔培养板中,每个比例设3个重复;然后置于细胞培养箱(37 ℃,5% CO2,饱和湿度)中继续孵育2 h,弃上清液,用PBS冲洗爬片3次以去除未黏附的乳酸菌;经8%甲醛固定后进行吉姆萨染色,油镜下观察黏附效果,每个细胞爬片观察10个视野并进行乳酸菌黏附计数。
黏附率(%)=黏附细菌数/初始细菌数×100
1. 3. 7 小鼠致病性试验 培养18 h的分离乳酸菌菌液4000 r/min离心10 min,弃上清液,PBS洗涤3次,然后用PBS调整浓度至1×109 CFU/mL。将SPF昆明小鼠分成4组,每组5只。试验组小鼠腹腔注射0.1 mL混合菌液,阳性对照组小鼠腹腔注射0.1 mL大肠杆菌菌悬液(1.0×107CFU/mL),阴性对照组小鼠腹腔注射0.1 mL PBS,空白对照组小鼠不做任何处理。定时观察小鼠的精神及行为有无异常,持续观察48 h后剖检观察其脏器有无病理变化。
2 结果与分析
2. 1 奶牛生殖道乳酸菌测序结果
经16S rDNA测序分析共获得8株乳酸菌,经BLAST比对分析,确定获得的8株乳酸菌(图1)分别为植物乳杆菌(Lactobacillus plantarum)、副干酪乳杆菌(L. paracasei)、蜡样芽孢杆菌(Bacillus cereus)、鼠李糖杆菌(L. rhamnosus)、蒙氏肠球菌(Enterococcus mundtii)、德氏乳杆菌(L. delbrueckii)、戊糖乳杆菌(L. pentosus)和嗜热链球菌(Streptococcus thermophiles)。根据预试验结果,选择2株具有良好抑菌活性(植物乳杆菌和副干酪乳杆菌)及1株具有良好黏附性(鼠李糖杆菌)的乳酸菌进行后续研究。
2. 2 奶牛生殖道乳酸菌培养上清液抑菌效果
由图2可看出,植物乳杆菌、副干酪乳杆菌和鼠李糖杆菌培养上清液对大肠杆菌、无乳链球菌及金黄色葡萄球菌均表现出良好的抑制效果。其中,对大肠杆菌的抑菌圈直径在18~20 mm(图3);对无乳链球菌的抑菌圈直径在27~30 mm;对金黄色葡萄球菌的抑菌圈直径在24~28 mm,且鼠李糖杆菌对金黄色葡萄球菌的抑菌效果明显优于植物乳杆菌和副干酪乳杆菌。總体来看,以鼠李糖杆菌的抑菌效果最佳。植物乳杆菌培养上清液对大肠杆菌、金黄色葡萄球菌和无乳链球菌的MIC分别为2-3、2-4和2-4;副干酪乳杆菌培养上清液对大肠杆菌、金黄色葡萄球菌和无乳链球菌的MIC分别为2-3、2-3和2-4;鼠李糖杆菌培养上清液对大肠杆菌、金黄色葡萄球菌和无乳链球菌的MIC均为2-4(表2)。
2. 3 奶牛生殖道乳酸菌的生长曲线及产酸产H2O2测定结果
3株奶牛生殖道乳酸菌均随生长时间的推移,其菌体浓度逐渐增加,约在接种3 h后即进入典型的指数生长期,至接种9 h后生长曲线趋于平坦,在接种13~14 h时达最大值(图4)。乳酸菌生长至平台期后,植物乳杆菌OD620 nm为1.375,鼠李糖杆菌OD620 nm为1.314,副干酪乳杆菌OD620 nm为1.250。
由图5可看出,3株奶牛生殖道乳酸菌的产酸情况在接种14~16 h时达平台期,但在接种16 h后发酵液pH还在继续降低,直到接种24 h后发酵液pH才趋于稳定,说明植物乳杆菌、副干酪乳杆菌和鼠李糖杆菌在接种16 h后其产酸过程仍在继续,并于接种24 h时达产酸最大值。其中,副干酪乳杆菌最先到达稳定期且产酸能力最强,其发酵液pH达3.68;植物乳杆菌和鼠李糖杆菌的产酸能力几乎相同,发酵结束后其pH分别为3.80和3.82。此外,植物乳杆菌、副干酪乳杆菌和鼠李糖杆菌在MRS培养基上形成的菌落颜色均无明显变化,说明不产H2O2。
2. 4 奶牛生殖道乳酸菌的药敏试验及耐药基因检测结果
由表3可知,3株奶牛生殖道乳酸菌对青霉素G、氯霉素、阿莫西林、氨苄西林、头孢噻肟、头孢唑林和四环素等7种抗菌药物高度敏感,说明植物乳杆菌、副干酪乳杆菌与鼠李糖杆菌联合使用具有抗菌药物可控制性。此外,3株奶牛生殖道乳酸菌均对苯唑西林产生抗性(耐药),植物乳杆菌和副干酪乳杆菌对卡那霉素已产生抗性,植物乳杆菌和鼠李糖杆菌对诺氟沙星已产生抗性。耐药基因检测结果(表4)表明,在3株奶牛生殖道乳酸菌中同时检测到磺胺类耐药基因sul2,在副干酪乳杆菌和鼠李糖杆菌中还同时检测到氨基糖苷类耐药基因aphA-2和β-内酰胺类耐药基因blaIMP。
2. 5 奶牛生殖道乳酸菌的黏附上皮细胞试验结果
乳酸菌通过黏附于肠黏膜、子宫内膜或生殖道黏膜形成稳定的生物屏障,而抑制病原菌入侵及定殖,因此黏附性是评价乳酸菌益生特性的重要指标之一(佘银等,2018)。黏附上皮细胞试验结果表明,3株奶牛生殖道乳酸菌中只有副干酪乳杆菌能很好地黏附于奶牛子宫内膜上皮细胞(图6)。按100∶1、600∶1和1000∶1的比例(副干酪乳杆菌∶奶牛子宫内膜上皮细胞)进行副干酪乳杆菌黏附奶牛子宫内膜上皮细胞试验时,其对应的黏附率分别为6.1%、12.6%和16.5%,表明随着副干酪乳杆菌浓度的增加,单个奶牛子宫内膜上皮细胞黏附的副干酪乳杆菌越来越多,即其黏附效率与副干酪乳杆菌浓度呈正相关。
2. 6 奶牛生殖道乳酸菌对小鼠致病性的检测结果
腹腔注射大肠杆菌菌悬液的阳性对照组小鼠在攻毒后表现为精神沉郁,活动减少,至攻毒48 h后有2只小鼠死亡,剖检发现其腹腔有积水,肠道发生轻度黏连;剖检未死亡的3只小鼠也发现其腹腔存在积水。腹腔注射奶牛生殖道乳酸菌混合菌液的试验组小鼠精神状态良好,行为无异常,采食饮水均正常,剖检发现其腹腔无积水,脏器无移位、无出血症状,与空白对照组小鼠相比无明显差异。
3 讨论
目前,微生态制剂已在人类医学临床上展开应用并取得良好成效(Zhang et al.,2018),但针对畜牧行业的益生菌应用研究很少,尤其在奶牛生殖系统疾病防控方面尚无相关产品问世。本研究从产后健康奶牛子宫分泌物中分离出8株乳酸菌,最终筛选获得3株具有益生特性的乳酸菌。乳酸菌通过产生有机酸、H2O2及细菌素,而抑制病原菌的入侵和生长,或通过激活机体肠道的过氧化物酶—硫氰酸盐反应系统,参与肠道抑菌过程(Voltan et al.,2008)。有机酸(乳酸、乙酸、丙酸、苹果酸及琥珀酸等)是乳酸菌的主要代谢物质之一,也是主要的抑菌成分(Wu and Shah,2017)。Zhao等(2007)研究发现,嗜酸乳杆菌能产生多种有机酸,其代谢产物不仅能抑制大肠杆菌和炭疽杆菌的生长,还能降低培养基中的胆固醇水平。本研究采用牛津杯抑菌试验检测奶牛生殖道乳酸菌的抑菌活性,结果显示筛选得到的3株奶牛生殖道乳酸菌对3种致病菌(大肠杆菌、金黄色葡萄球菌和无乳链球菌)均具有良好的抑菌效果,抑菌圈直径均在18 mm以上。3株奶牛生殖道乳酸菌的产酸能力差异不显著,但抑菌试验结果显示抑菌活性最高的是鼠李糖杆菌,说明有机酸对抑菌活性并不是起决定性作用,可能还存在其他物质具有抑菌活性。朱芬花等(2017)分析了奶牛阴道分离乳酸菌的抑菌活性,但并未分析乳酸菌培养上清液的MIC。本研究在此基础上,参考96孔板检测抗菌药物MIC的方法(Matuschek et al.,2018)检测3株奶牛生殖道乳酸菌培养上清液的MIC,结果显示不同乳酸菌培养上清液对不同致病菌的抑菌效果各不相同,总体上以鼠李糖杆菌的效果最佳。此外,本研究分离获得的植物乳杆菌、副干酪乳杆菌和鼠李糖杆菌均不具备产生H2O2的能力,因此具体是其培养上清液中的哪种物质在发挥作用还有待进一步研究。
抗菌药物敏感性是评价益生菌安全性的重要指标之一(Kumar and Kumar,2015;Sgibnev and Krem-leva,2017)。本研究结果表明,3株奶牛生殖道乳酸菌对青霉素G、氯霉素、阿莫西林、氨苄西林、头孢噻肟、头孢唑林和四环素等7种抗菌药物高度敏感,即对抗菌药物的敏感性良好。细菌不能直接利用环境中的叶酸,而需通过氨苯甲酸、谷氨酸和二氢蝶啶合成叶酸,以满足自身的生长需求(寇宏等,2018)。磺胺类药物的化学结构与对氨基苯甲酸相似,是通过竞争作用抑制细菌叶酸合成而达到抑菌目的。sul2、sul3和sull是磺胺类抗菌药物的耐药基因(庄林林,2016),本研究从植物乳杆菌中检测到sul2和sul3基因,从副干酪乳杆菌和鼠李糖杆菌中仅检测到sul2基因,可能是由于磺胺类药物的长期大量使用致使不同乳酸菌产生耐药性。aphA-1、aphA-2和aad-9是氨基糖苷类抗菌药物的耐药基因(Nzila et al.,2000),本研究从副干酪乳杆菌中检测到aphA-1和aphA-2基因,从鼠李糖杆菌中检测到aphA-2和aad-9基因;此外,从副干酪乳杆菌和鼠李糖杆菌同时检测到β-内酰胺类抗生素耐药基因blaIMP。综合3株奶牛生殖道乳酸菌的药敏试验及耐药基因检测结果可知,携带耐药基因的奶牛生殖道乳酸菌并非对相应的抗菌药物完全耐药,其具体原因还需进一步探索。总体来看,从奶牛生殖道分离获得的植物乳杆菌、副干酪乳杆菌和鼠李糖杆菌对大部分抗菌药物敏感,且在可控范围之内。
黏附性是临床上筛选益生菌的重要指标之一(Klopper et al.,2018),黏附性越强说明益生菌在局部成功定殖的可能性越大(Inturri et al.,2015)。当高黏附性的乳酸菌优先定殖于奶牛子宫内膜上皮细胞时,可在子宫内形成一道安全的物理屏障,即乳酸菌可直接黏附在肠道或生殖道表面并与黏附细胞进行信号交流(Grigoryan et al.,2018),进而通过空间位阻效应减少病原菌的黏附及分泌抑菌活性分子,以减少病原菌在局部定殖而达到抑菌目的(白东宁等,2011;任大勇,2013)。乳酸菌黏附子宮内膜上皮细胞试验结果显示,副干酪乳杆菌能很好地黏附于奶牛子宫内膜上皮细胞,且随副干酪乳杆菌浓度的增加,其黏附效率逐渐升高。此外,小鼠致病性试验结果显示,以3株奶牛生殖道乳酸菌的混合菌液经腹腔注射小鼠后并未引起脏器病变,且对小鼠的行为活动、采食饮水亦无明显影响,说明从奶牛生殖道分离获得的植物乳杆菌、副干酪乳杆菌和鼠李糖杆菌具有良好安全性,可用于开发防治奶牛子宫内膜炎的微生态制剂。
4 结论
从奶牛生殖道分离获得的植物乳杆菌、副干酪乳杆菌和鼠李糖杆菌具有安全性、产酸特性、抗菌药物敏感性及抑菌活性,尤其是副干酪乳杆菌具有良好的黏附性,可作为潜在的益生菌,用于开发防治奶牛子宫内膜炎的微生态制剂。
参考文献:
白东宁,齐雪峰,赵献军,段连茂,靳亚平,李义,王大会,王芳. 2011. 嗜酸乳杆菌体外黏附山羊子宫内膜上皮细胞条件的优化[J]. 西北农林科技大学学报(自然科学版),39(3):40-44. [Bai D N,Qi X F,Zhao X J,Duan L M,Jin Y P,Li Y,Wang D H,Wang F. 2011. Optimization of in vitro condition for Lactobacillus acidophilus adhesion on goat endometrial epithelial cells[J]. Journal of Northwest A & F University(Natural Science Edition),39(3):40-44.]
侯荣伦. 2011. 奶牛生殖道菌群分析和乳酸菌的分离与鉴定及其生物学特性研究[D]. 呼和浩特:内蒙古农业大学. [Hou R L. 2011. Analysis of microbial flora in the dairy cows genital tract and isolation and identification Lactobacillus and thebiological characteristics of Lactobacillus[D]. Huhhot:Inner Mongolia Agricultural University.]
寇宏,吕世明,谭艾娟,王想,张顺然,罗致茜,林习,杨睿智. 2018. 贵州省猪源大肠杆菌对磺胺类抗菌药物耐药性及耐药基因检测[J]. 中国兽医杂志,54(9):75-78. [Kou H,Lü S M,Tan A J,Wang X,Zhang S R,Luo Z X,Lin X,Yang R Z. 2018. Detecting antibiotic resistance and resistance genes of sulfonamides in Escherichia coli isolated from swine farms in Guizhou Province[J]. Chinese Journal of VeterinaryMedicine,54(9):75-78.]
李炳志. 2008. 奶牛子宫内膜炎菌群分析及微生态制剂对其疗效观察[D]. 杨陵:西北农林科技大学. [Li B Z. 2008.Analysis on microflora in vagina edometritis cows and the therapeutic efficacy of micro-ecological agent in treated it[D]. Yangling:Northwest A & F University.]
Genís S,Bach A,Fàbregas F,Arís A. 2016. Potential of lactic acid bacteria at regulating Escherichia coli infection and inflammation of bovine endometrium[J]. Theriogenology,85(4):625-637.
Grigoryan S,Bazukyan I,Trchounian A. 2018. Aggregation and adhesion activity of Lactobacilli isolated from fermented products in vitro and in vivo:A potential probiotic strain[J]. Probiotics and Antimicrobial Proteins,10(2):269-276.
Inturri R,Stivala A,Blandino G. 2015. Microbiological cha-racteristics of the probiotic strains B. longum BB536 and L. rhamnosus HN001 used in combination[J]. Minerva Gastroenterologica e Dietologica,61(4):191-197.
Klopper K B,Deane S M,Dicks L M T. 2018. Aciduric strains of Lactobacillus reuteri and Lactobacillus rhamnosus,isolated from human feces,have strong adhesion and aggregation properties[J]. Probiotics and Antimicrobial Proteins,10(1):89-97.
Kumar A,Kumar D.2015. Characterization of Lactobacillus isolated from dairy samples for probiotic properties[J]. Anaerobe,33:117-123.
Liu M C,Wu Q,Wang M L,Fu Y H,Wang J F. 2016. Lactobacillus rhamnosus GR-1 limits Escherichia coli-induced inflammatory responses via attenuating MyD88-dependent and MyD88-independent pathway activation in bovine endometrial epithelial cells[J]. Inflammation,39(4):1483-1494.
Matuschek E,?hman J,Webster C,Kahlmeter G2. 2018. Antimicrobial susceptibility testing of colistin-evaluation of seven commercial MIC products against standard broth microdilution for Escherichia coli,Klebsiella pneumo-niae,Pseudomonas aeruginosa,and Acinetobacter spp.[J]. Clinical Microbiology and Infection,24(8):865-870.
McFarland L V. 2014. Use of probiotics to correct dysbiosis of normal microbiota following disease or disruptive events:A systematic review[J]. BMJ Open,4(8):e005047.
Nzila A M,Mberu E K,Sulo J,Dayo H,Winstanley P A,Sibley C H,Watkins W M. 2000. Towards an understanding of the mechanism of pyrimethamine-sulfadoxine resistance in Plasmodium falciparum:Genotyping of dihydrofolate reductase and dihydropteroate synthase of Kenyan parasites[J]. Antimicrobial Agents & Chemotherapy,44(4):991-996.
Otero M C,Morelli L,Nader-Macías M E. 2006. Probiotic properties of vaginal lactic acid bacteria to prevent metritis in cattle[J]. Letters in Applied Microbiology,43(1):91-97.
Perczak A,Goliński P,Bry?a M,Wa?kiewicz A. 2018. The efficiency of lactic acid bacteria against pathogenic fungi and mycotoxins[J]. Arhiv za Higijenu Rada i Toksiko-logiju,69(1):32-45.
Peter S,G?rtner M A,Michel G,Ibrahim M,Klopfleisch R,Lübke-Becker A,Jung M,Einspanier R,Gabler C. 2018. Influence of intrauterine administration of Lactobacillusbuchneri on reproductive performance and pro-inflammatory endometrial mRNA expression of cows with subcli-nical endometritis[J]. Scientific Reports,8(1):5473. doi: 10.1038/s41598-018-22856-y.
Prabhurajeshwar C,Chandrakanth R K. 2017. Probiotic potential of Lactobacilli with antagonistic activity against patho-genic strains:An in vitro validation for the production of inhibitory substances[J]. Biomedical Journal,40(5):270-283.
Prado C F,De Dea Lindner J,Inaba J,Thomaz-Soccol V,Brar S K,Soccol C R. 2015. Development and evaluation of a fermented coconut water beverage with potential health benefits[J]. Journal of Functional Foods,12:489-497.
Rodríguez C,Cofré J V,Sánchez M,Fernández P,Boggiano G,Castro E. 2011. Lactobacilli isolated from vaginal vault of dairy and meat cows during progesteronic stage of estrous cycle[J]. Anaerobe,17(1):15-18.
Sgibnev A,Kremleva E. 2017. Influence of hydrogen pero-xide,lactic acid,and surfactants from vaginal Lactobacilli on the antibiotic sensitivity of opportunistic bacteria[J]. Probiotics and Antimicrobial Proteins,9(2):131-141.
Voltan S,Martines D,Elli M,Brun P,Longo S,Porzionato A,Macchi V,D'Incà R,Scarpa M,Palù G,Sturniolo G C,Morelli L,Castagliuolo I. 2008. Lactobacillus crispatus M247-derived H2O2 acts as a signal transducing molecule activating peroxisome proliferator activated receptor-gamma in the intestinal mucosa[J]. Gastroenterology,135(4):1216-1227.
Wu Q L,Shah N P. 2017. High γ-aminobutyric acid production from lactic acid bacteria:Emphasis on Lactobacillus brevis as a functional dairy starter[J]. Critical Reviews in Food Science and Nutrition,57(17):3661-3672.
Zhang H B,Wen W T,Shen J L,Wei L X. 2018. Effect of microecological preparation supplementation on woman with polycystic ovary syndrome:A meta-analysis protocol[J]. Medicine(Baltimore),97(44):e13040.
Zhao R X,Sun J L,Mo H Z,Zhu Y. 2007. Analysis of functional properties of Lactobacillus acidophilus[J]. World Journal of Microbiology and Biotechnology,23(2):195-200.
Zobel R.2013. Endometritis in simmental cows:Incidence,causes,and therapy options[J]. Turkish Journal of Veterinary and Animal Sciences,37(2):134-140.
Zoumpopoulou G,Pot B,Tsakalidou E,Papadimitriou K. 2017. Dairy probiotics:Beyond the role of promoting gut and immune health[J]. International Dairy Journal,67:46-60.
(責任编辑 兰宗宝)
