术中冰冻切片检查在I型子宫内膜癌中的临床应用价值
2020-12-11毛熙光
熊 旺,毛熙光
(西南医科大学附属医院 妇产科, 四川 泸州 646000)
子宫内膜癌(EC,Endometrial carcinoma)是发生于子宫内膜的女性生殖系统三大恶性肿瘤之一,其发病率仅低于宫颈癌,伴随着国民生活习惯及饮食结构的变化子宫内膜癌发病率呈逐年上升趋势,发病人群由过去的老年女性渐渐呈年轻化改变[1-2]。有报道在欧美部分发达国家子宫内膜癌的发病率已然超过宫颈癌的发病率[3]。1983年Bokhman的一项对于366例子宫内膜癌患者的前瞻性研究中将子宫内膜癌按照发生机制分为I型和II型[4],也是目前子宫内膜癌主要的分型方式,其中I型称雌激素依赖型(Estrogen-dependent),又称为子宫内膜样腺癌,与雌激素长期刺激有关,在临床工作中最为常见(约占80%~90%),在子宫内膜非典型性或复杂性增生基础上产生,具有发病年龄轻、恶性程度低且预后好的特点;II型称非雌激素依赖型(Estrogen-independent),又称非子宫内膜样腺癌,发病与雌激素无明显关系,临床上比较少见(约占10%~20%),在癌灶周围可以是萎缩的子宫内膜,多见于老年妇女,肿瘤恶性度高,分化及预后较差。I型子宫内膜癌早期诊治预后很好,所以关于I型子宫内膜癌早发现、早诊断、早治疗显得尤为关键[5]。美国国立综合癌症网络(NCCN,National comprehensive cancer network)发布的2020子宫肿瘤临床实践指南(第1版)推荐所有能耐受手术且无生育要求及无远处转移的患者均提倡行子宫切除+双附件切除+手术分期,术后依据是否具备高危因素选择临床观察或进一步补充治疗[6]。有研究显示子宫内膜癌术中实施淋巴结切除术患者与未实施淋巴结切除患者对比其复发率及生存率没有明显改善[7-9],尤其是子宫内膜癌I型患者早期淋巴转移率更低[10],所以在低危子宫内膜癌手术中是否常规实施全面手术分期依然颇有争议。FS是在手术进行当中判断肿瘤细胞等级、分期、癌灶浸润肌层深度、宫颈间质是否受累的唯一可靠手段,对于指导手术分期有很大意义[11]。随着病理技术的进步,术中FS的符合率也得到相应的提升,但其具体的临床应用价值仍值得进一步研究和探讨。本文旨在回顾性分析术中FS在I型子宫内膜癌手术分期中的临床应用价值。
1 资料与方法
1.1 一般资料 将2018年11月至2019年11月在西南医科大学附属医院妇产科就诊的103例子宫内膜癌患者中筛选出术后证实为I型子宫内膜癌的64例患者为研究对象,年龄在27~71岁之间,平均年龄(53.57±8.59)岁。纳入标准:所有纳入本实验研究中的I型子宫内膜癌患者均为初始发病且在我院妇产科行初始治疗,术前已行诊断性刮宫(D&C,Diagnostic curettage)检查确诊为子宫内膜非典型增生或直接提示查见腺癌,所有样本均行术中FS和术后PS病理检查,并且术后PS证实为I型子宫内膜癌且临床资料完整准确者。排除标准:术前进行过放、化疗或新辅助治疗者,外院治疗后未控或复发转至我院妇产科治疗者,子宫、卵巢双源性癌和转移性子宫体癌患者,术后PS病检证实非I型子宫内膜癌或临床资料不完整者。该研究已通过西南医科大学附属医院临床实验伦理学委员会审查。
1.2 研究方法
1.2.1 手术和切除组织处理 该研究中64例I型子宫内膜癌患者中IA期43例、IB期9例、II期6例、IIIA期1例、IIIB期2例、IIIC1期1例、IIIC2期1例、IVB期1例。其中1例27岁已完成生育的子宫内膜高分化子宫内膜样腺癌IA期患者实施了腹腔镜下筋膜外全子宫+双侧输卵管切除术。46例患者手术时实施了腹式筋膜外全子宫+双附件切除术,46例患者中实施了盆腔淋巴结切除术或盆腔+腹主动脉旁淋巴结切除术分别有6例和5例。分别有5例和12例患者实施了次广泛全子宫+双附件+盆腔淋巴结+腹主动脉旁淋巴结切除术和广泛全子宫+双附件+盆腔淋巴结+腹主动脉旁淋巴结切除术。1例IVB期患者实施了子宫内膜癌肿瘤细胞减灭术。手术途径有经腹和腹腔镜手术。手术切除的子宫先经主刀医师剖视标本后立即送病理科冰冻检查室行快速FS病理检查。病理科冰冻医师收到标本先肉眼观察标本并测量肉眼病灶大小和初步判断取材部位,再将标本置于特制包埋剂冷冻于-20 ℃环境中预处理后用恒温冷冻切片机切片3~4张,其中包括可疑宫颈内口受累处及可疑癌灶浸润肌层最深处组织,厚度为5 μm,经冰冻染色后同时由两名主治医及以上职称病理科医师阅片(至少有一名高级职称医师)并在30 min左右报告结果给主刀医师。冰冻切片病理检查完成后再将标本进行常规石蜡包埋制片镜检,3~5 d后报告最终结果。
1.2.2 肿瘤学标准 子宫内膜癌按照发生机制分为I型和II型[12]。按照1973年国际妇产科联盟(FIGO,International federation of gynecology and obstetrics)制定的子宫内膜癌组织结构分级标准[13],对于I型子宫内膜癌肿瘤分级主要按照肿瘤非鳞状化生实性成分所占比例分为3级:高分化(G1级)≤5%,中分化(G2级)6%~50%,低分化(G3级)>50%。采用国际妇产科联盟(FIGO,2009)修订的手术病理分期中子宫肌层浸润深度及宫颈间质是否受累作为判断标准[14]。
1.2.3 诊断标准及评价指标 以I型子宫内膜癌患者术后PS结果为金标准。计算患者术中FS在判断I型子宫内膜癌肿瘤细胞等级、癌灶浸润子宫肌层深度及子宫颈间质受累情况的符合率。

2 结果
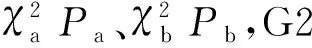
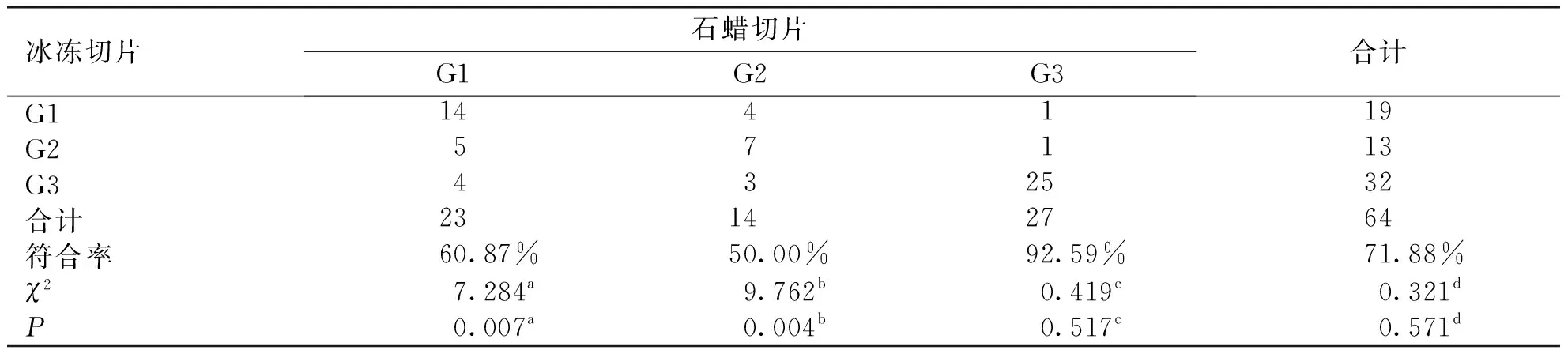
表1 I型子宫内膜癌肿瘤细胞等级诊断
2.2 术中FS在判断I型子宫内膜癌癌灶浸润子宫肌层深度方面的符合率 与术后PS结果对比,术中FS在判断癌灶浸润子宫肌层深度的总体符合率达92.19%(59/64),其中癌灶侵犯子宫肌层<1/2符合率96.23%(51/53)显著高于≥1/2符合率72.73%(8/11)(χ2=6.984,P=0.032)。并且FS与PS在判断I型子宫内膜癌癌灶浸润子宫肌层深度方面具有高度一致性(κ=0.72)。
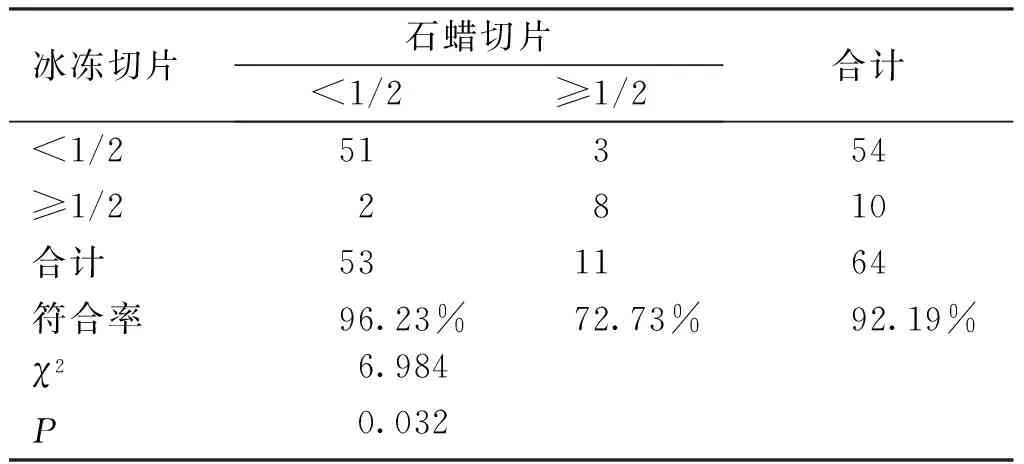
表2 I型子宫内膜癌癌灶浸润子宫肌层深度
2.3 术中FS在判断I型子宫内膜癌子宫颈间质是否受累方面的符合率 与术后PS结果对比,术中FS在判断子宫颈间质是否受累的总体符合率达89.06%(57/64),未累及宫颈间质符合率94.12%(48/51)显著高于累及宫颈间质的符合率69.23%(9/13)(χ2=6.587,P=0.027)。并且FS与PS在判断I型子宫内膜癌子宫颈间质是否受累方面具有高度一致性(κ=0.61)。
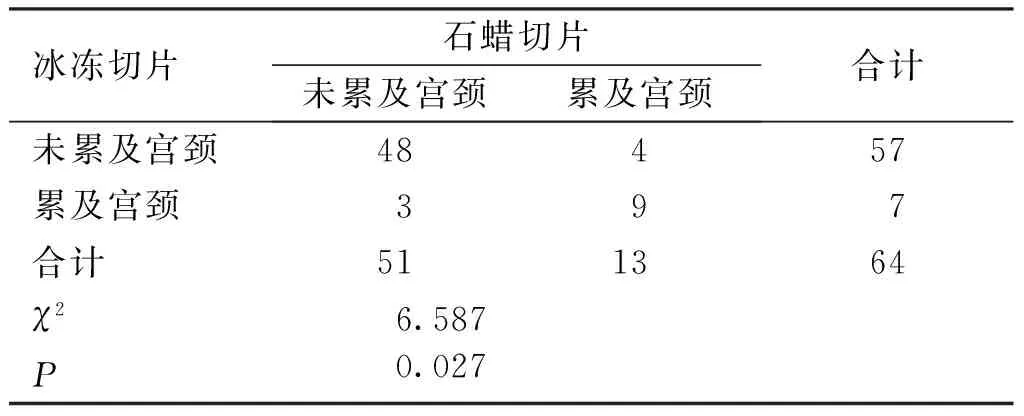
表3 I型子宫内膜癌子宫颈间质受累情况
3 讨论
子宫内膜癌是威胁女性健康的生殖系统三大恶性肿瘤之一,主要根据肿瘤累及范围及组织学类型,结合患者年龄及全身情况制定适宜的治疗方案[16]。在子宫肿瘤临床实践指南(NCCN,2020)第一版中并未将术中FS推荐为子宫内膜癌手术必需程序,而是建议所有能耐受手术且无生育要求及远处转移的患者均行全面手术分期,指南中谈到淋巴结评估包含了盆腔和(或)腹主动脉旁淋巴结切除,即便是肿瘤局限在子宫体也应该行淋巴结切除术,对于判断预后有重要意义[6]。但有研究表明子宫内膜癌患者淋巴结切除并不能降低术后复发率和死亡率[7-9],一定程度上增加了术中风险如损伤血管神经和术后并发症如淋巴水肿、淋巴囊肿、乳糜瘘等的发生率,影响患者术后生活质量[17-18]。也有研究表明肿瘤细胞分级为G1、G2级IA期子宫内膜癌只有不到5%的患者盆腔淋巴结转移阳性,肿瘤组织低分化、肿瘤浸润子宫深肌层、肿瘤病灶直径大于2cm、淋巴脉管间隙受侵是I型子宫内膜癌淋巴结转移的高危独立危险因素。梅奥标准对于早期子宫内膜样腺癌是否实施淋巴结切除术的建议是同时满足肿瘤侵犯肌层小于1/2、肿瘤直径小于2cm、组织分化为G1级和G2级的患者可以仅实施筋膜外全子宫+双附件切除术[19-20],经受住了近19年时间的考验证明这个建议是合理并安全的。术中FS可以在一定程度上预测淋巴结转移状态,减少不必要的淋巴结切除术并降低漏诊转移淋巴结阳性的可能性。
本研究结果显示:术中FS在判断I型子宫内膜癌肿瘤细胞等级的整体符合率(71.88%)有待提升,但G3级的符合率(92.59%)明显高于G1和G2级(60.87%,50.00%),与相关文献报道近似[21-24]。肿瘤细胞等级上升有6例(9.38%),肿瘤细胞等级降低有12例(18.75%)。术中FS与术后PS对比结果不一致常常发生在术中FS判断为G3级(7例)和术后PS诊断为G1级(9例)的患者中,可能因为G3级的诊断可以同时有G1、G2、G3级肿瘤区域,即肿瘤等级为G3级的肿瘤可以在术后PS中同时有G1、G2级视野,而对于G1级的诊断区间小,非鳞状化生实性成分所占比例必须≤5%,所以当判断为G1级时就只能有G1级区域,如果取材有G3级或者G2级的肿瘤区域就判断为相应等级,肿瘤细胞等级相应上升。肿瘤细胞学等级为G2级判断符合率最低,可能因为G2的判断依据为非鳞状化生实性成分所占比例6%~50%,诊断区间同时存在上限和下限,加之FS取材的随机性和FS报告的时效性,导致G2级判断最为困难。本研究中G1级升为G3级、G2级升为G3级各占1例,其中1例因浸润深肌层、1例累及宫颈间质均实施了全面分期手术,G3降级为G2或G1有7例,术中均实施了全面分期术,经过术后PS证实其中有3例肿瘤浸润子宫深肌层,4例提示肿瘤累及宫颈间质,无1例因为术中FS报告的细胞学等级偏差影响是否行全面手术分期的决定。术中FS结果与术后PS结果对比在判断I型子宫内膜癌肿瘤细胞等级为G3级的符合率最高,而G3级作为I型子宫内膜癌淋巴结转移高危独立危险因素,可在一定程度上指导手术分期,从而降低子宫内膜癌患者淋巴结转移阳性的漏切率和手术再分期率。
术中FS在判断肿瘤癌灶浸润子宫肌层深度的整体符合率为92.19%,其中判断癌灶浸润子宫肌层<1/2符合率96.23%显著高于≥1/2符合率72.73%,与周婵萍等研究的结果一致[22],但江梅珍[21]、张惠[23]、王利丽[24]等认为术中FS在判断癌灶浸润子宫深肌层方面更加准确。自2000年开始FIGO发布的子宫内膜癌手术病理分期中取消肿瘤局限在子宫内膜这一分期标准,扩大了IA期诊断区间,并且术中FS切片由以往的常规取材2张或3张增加至现在的3~4张,扩大了取材范围,提高了I型子宫内膜癌术中冰冻对肿瘤浸润子宫肌层深度判断整体符合率,尤其是在肿瘤浸润子宫肌层<1/2方面的符合率。3例术中FS结果为癌灶浸润子宫肌层<1/2但术后PS结果证实为≥1/2,其中2例因术中FS提示细胞学等级为G3(术后PS证实为G3)实施了全面手术分期,仅1例患者手术分期不完全,术后转至我院肿瘤科补充治疗。2例术中FS结果为癌灶浸润子宫肌层≥1/2但术后PS结果证实为<1/2,其中1例因术中FS提示G3级、1例术中FS提示宫颈间质受累(术后PS均得到证实)均实施了全面手术分期。64例患者中仅有1例因手术分期不完全转诊肿瘤科补充放化疗。
术中FS在判断子宫颈间质受累与否方面总体符合率为89.06%,且未累及宫颈间质符合率94.12%显著高于累及宫颈间质的符合率69.23%。子宫内膜癌手术病理分期修订版(FIGO,2000)开始以子宫间质是否直接受累作为II期标准,不包括累及宫颈管腺体,从而使子宫内膜癌II期诊断区间缩窄可能是其符合率有待提高的原因之一,由于术中FS时效性因素的限制,对于宫颈间质受累的判断不同于细胞等级及子宫肌层浸润深度,只能在宫颈内口最可疑受累处取1张切片镜检,限制了宫颈间质受累的检出率,甚至一些病理医生因为术中FS在子宫颈间质受累情况方面检出困难并不把宫颈间质是否受累作为常规报告项目,但是本研究中宫颈间质是否受累的差异并未影响是否实施全面手术分期的决定。本研究中4例术中FS提示未累及宫颈而术后PS提示累及宫颈的患者,但是因为术中FS提示:1例癌灶浸润子宫肌层深度≥1/2、3例为G3级,均行了全面手术分期。3例术中FS提示累及宫颈但术后PS提示未累宫颈的患者均实施了全面手术分期,且术后PS结果证实3例患者均为G3级。
总之,目前FS是子宫内膜癌术中唯一能判断I型子宫内膜癌肿瘤细胞等级、肿瘤浸润子宫肌层深度、子宫颈间质是否受累的可靠方法[11],但是术中FS并不作为子宫内膜癌常规推荐,并且在细胞学等级方面总体符合率有待提升[25]。也有学者认为只要术前检查确定为子宫内膜癌,则不需要术中FS这一步骤,直接实施全面手术分期[26]。但是随着术中FS技术提高,目前在判断G3级、肿瘤浸润深度及累及宫颈管间质与否方面有较高的符合率,结合本研究结果表明虽然术中FS与术后PS在判断肿瘤细胞等级方面仅仅具有中等一致性,但是判断I型子宫内膜癌癌灶浸润子宫肌层深度及子宫颈间质是否受累方面具有高度一致性,可以在一定程度上帮助识别子宫内膜癌患者淋巴结转移的高危因素,对个体化手术方式有明确的指导意义,尤其是对早期肿瘤局限于子宫体的I型子宫内膜癌患者指导意义巨大。有部分研究已经尝试开展术中FS多学科协作模式[27],优化程序、缩短报告时间、保证质量及准确性,并且取得了成果,将来可能推广成为术中FS的一种新的模式。
