聚焦2020年高考,领悟“氯”题风采
2020-12-10◇孙晶
◇ 孙 晶
己亥庚子之交发生的新型冠状病毒肺炎疫情,是新中国成立以来在我国发生的传播速度最快、感染范围最广、防控难度最大的一次重大、突发的公共卫生事件.沧海横流,尽显英雄本色.在这场严峻斗争中,含氯化合物等消毒剂大显身手.因此,对于含氯化合物的考查也成为2020年高考的一大热点.
1 含氯化合物与灭菌消毒
例1(2020年全国卷Ⅰ)国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒.对于上述化学药品,下列各项说法错误的是( ).
A.CH3CH2OH能与水互溶
B.NaCl O通过氧化灭活病毒
C.过氧乙酸相对分子质量为76
D.氯仿的化学名称是四氯化碳

乙醇分子中有羟基,其与水分子可以形成氢键,因此乙醇能与水互溶,选项A正确;次氯酸钠具有强氧化性,能使蛋白质变性,故其能通过氧化灭活病毒,选项B正确;过氧乙酸的分子式为C2H4O3,其相对分子质量为76,选项C正确;氯仿的化学名称为三氯甲烷,选项D错误.答案为D.
【灵犀一点】该题以新冠肺炎预防中常见的消毒剂为命题载体,考查了对物质俗名与成分的对应关系,要求学生在平时的学习中要注重细节,拓宽自己的知识面,加强自己的知识储备.
2 以微流程和信息给予形式考查
例2(2020年山东卷)实验室分离Fe3+和Al3+的流程如图1所示.
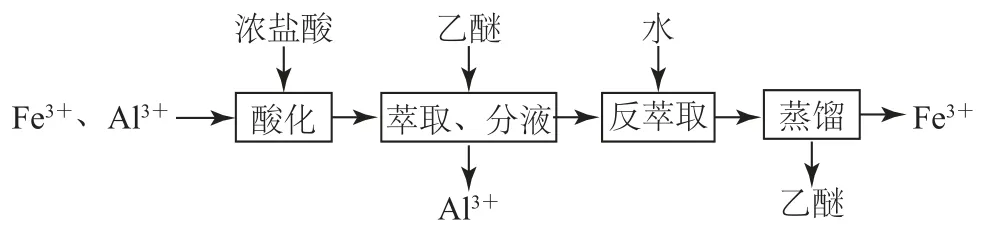
图1
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6℃)中生成缔合物Et2O·H+·[FeCl4]-.下列说法错误的是( ).
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管

萃取振荡时会产生气体,为避免气体压力过大,发生意外,分液漏斗上口应该倾斜向下,选项A说法错误;分液时,密度大的液体在下层,密度小的液体在上层,下层液体由分液漏斗下口放出,下层液体放完后,密度小的上层液体从分液漏斗上口倒出,选项B说法正确;Fe3+在浓盐酸中生成黄色配离子,该离子在乙醚中生成缔合物,乙醚与水不互溶,故分液后水相为无色,则水相中不再含有Fe3+,说明已经达到分离目的,选项C说法正确;蒸馏时选用直形冷凝管,能使馏分全部转移到锥形瓶中,而不会残留在冷凝管中,选项D说法正确.答案为A.
【灵犀一点】直形冷凝管一般用于蒸馏,即在用蒸馏法分离物质时使用.而球形冷凝管一般用于反应装置,即在反应时考虑到需要减少反应物的蒸发流失而用球形冷凝管冷凝回流.
3 海水淡化与离子交换膜
例3(2020年山东卷)微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化.现以NaCl溶液模拟海水,采用惰性电极,用图2装置处理有机废水(以含CH3COO-的溶液为例).下列说法错误的是( ).
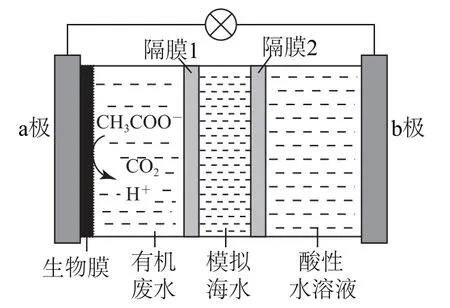
图2
A.负极反应为CH3COO-+2 H2O-8e-=2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1

a极为负极,CH3COO-失电子被氧化成CO2和H+,结合电荷守恒可得电极反应式为CH3COO-+2H2O-8e-=2CO2↑+7H+,选项A说法正确;为了实现海水的淡化,根据电荷守恒原理,可知Cl-透过隔膜1向a极移动,Na+透过隔膜2向b极移动,即隔膜1是阴离子交换膜,隔膜2是阳离子交换膜,选项B说法错误;当电路中转移1 mol电子时,根据电荷守恒可知,海水中会有1 mol Cl-移向负极,同时有1 mol Na+移向正极,即除去1 mol NaCl(质量为58.5 g),选项C说法正确;b极为正极,水溶液为酸性,所以H+得电子产生氢气,电极反应式为2 H++2e-=H2↑,所以当转移8 mol电子时,正极产生4 mol气体,根据负极反应式可知负极产生2 mol气体,物质的量之比为4∶2=2∶1,选项D说法正确.答案为B.
【灵犀一点】本题写出负极的电极方程式以后,根据电荷守恒,即可迅速判断Cl-透过隔膜1向a极移动,则隔膜1就为阴离子交换膜,因为该题是单项选择题,则可快速锁定选项B说法错误,这样可摈弃其余的无效信息,缩短解题时间.
4 融合实验探究、结构分析和平衡移动全方位考查
例4(2020年天津卷)已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色.现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl-⇌[CoCl4]2-+6H2O ΔH,用该溶液做实验,溶液的颜色变化如图3所示.
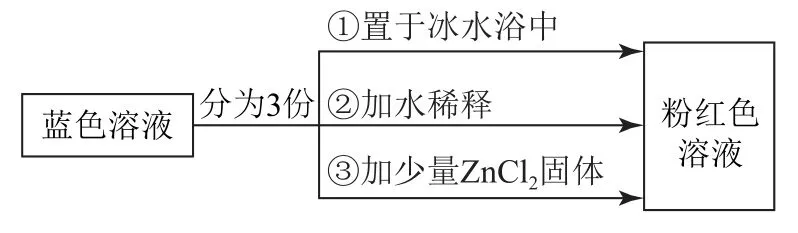
图3
以下结论和解释正确的是( ).
A.等物质的量的[Co(H2O)6]2+和[CoCl4]2-中σ键数之比为3∶2
B.由实验①可推知ΔH<0
C.实验②是由于c(H2O)增大,导致平衡逆向移动
D.由实验③可知配离子的稳定性:[ZnCl4]2->[CoCl4]2-

共价单键是σ键;双键中一个是σ键,一个是π键;三键中一个是σ键,两个是π键,由此可知1个[Co(H2O)6]2+中含有18个σ键,1个[CoCl4]2-中含有4个σ键,等物质的量的[Co(H2O)6]2+和[CoCl4]2-所含σ键数之比为18∶4=9∶2,选项A错误;实验①将蓝色溶液置于冰水浴中,溶液变为粉红色,说明降低温度平衡逆向移动,则逆反应为放热反应,正反应为吸热反应,ΔH>0,选项B错误;实验②加水稀释,溶液变为粉红色,加水稀释,溶液的体积增大,[Co(H2O)6]2+、[CoCl4]2-、Cl-浓度都减小,[Co(H2O)6]2+、Cl-的化学计量数之和大于[CoCl4]2-的化学计量数,则瞬时浓度的商大于化学平衡常数,平衡逆向移动,选项C错误;实验③加入少量ZnCl2固体,溶液变为粉红色,说明Zn2+与Cl-结合成更稳定的[ZnCl4]2-,导致溶液中c(Cl-)减小,平衡逆向移动,则由此说明稳定性:[ZnCl4]2->[CoCl4]2-,选项D正确.答案为D.
【灵犀一点】本题有两个易错点:选项A中[Co(H2O)6]2+中不仅有Co2+与H2O分子间的配位键,而且每个H2O分子中还有2个O—Hσ键;选项C中H2O为溶剂,视为纯液体,加水稀释,溶液体积增大,相当于利用“对气体参与的反应,增大体积、减小压强,平衡向气体系数之和增大的方向移动”来理解.
