反应历程命题热点探析
2020-12-10刘树领正高级教师
◇ 刘树领(正高级教师)
近年来,在重基础、考能力命题指导思想下,图示类试题逐渐成为化学命题的主要形式,命题素材与设问不断出新,从物质之间的转化关系、传统的工艺流程、实验装置图、电化学装置图等逐渐转化为陌生反应机理图,使得化学的宏观辨识与微观探析、变化观念与平衡思想、证据推理与模型认知、科学态度与社会责任等核心素养得到较好的体现,同时又较好地体现出重基础、重综合、重创新、重应用等特点.由于反应机理比较陌生,图示又比较复杂,使得反应机理类试题成为难点之一.
1 侧重于微粒存在形式及其转化关系
例1(2020年全国卷Ⅰ)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图1所示.

图1
下列叙述错误的是( ).
A.CH3COI是反应中间体
B.甲醇羰基化反应为

C.反应过程中Rh的成键数目保持不变
D.存在反应CH3OH+HI=CH3I+H2O
分析图示中微粒种类及转化关系较多,导致本题看似复杂,但只要根据题干与选项提示分析箭头指向即可轻松解题.本题较好地考查识图分析能力.根据“铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化”可知,甲醇羰基化反应所需的反应物除甲醇外还需要CO,因此在历程中出现的如CH3COI以及各种配离子等,都可视作中间产物,故选项A、B说法均正确;铑配合物在整个反应历程中成键数目、配体种类等均发生了变化,选项C说法错误;反应中间体CH3COI与水作用生成的HI可以使甲醇转化为CH3I,方程式可写成,选项D说法正确.答案为C.
例2(2019年全国卷Ⅰ)固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题.图2为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图.下列叙述错误的是( ).

图2
A.冰表面第一层中,HCl以分子形式存在
B.冰表面第二层中,H+浓度为5×10-3mol·L-1(设冰的密度为0.9 g·cm-3)
C.冰表面第三层中,冰的氢键网格结构保持不变
D.冰表面各层之间,均存在可逆反应
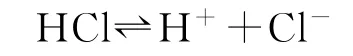
分析本题考查氯化氢气体在冰表面的吸附和溶解,侧重考查接受、吸收、整合化学信息的能力及分析和解决化学问题的能力.明确图示中符号、箭头表示的含义及氯化氢分子与水分子、氯离子与水分子的个数比,是解答问题的关键,难点是有关H+浓度的计算.由示意图可知,三原子的微粒为H2O分子,二原子的微粒为HCl分子.由冰的表面第一层与气相中的两条直线的箭头可知,此界面上为HCl的吸附与解吸过程,故进入第一层中的HCl以分子形式存在,选项A说法正确;由冰的表面第二层与第一层之间出现的弯线箭头可知,第一层与第二层之间存在溶解平衡,又因第二层中Cl-和H2O的个数比为10-4∶1,少于第一层吸附的氯化氢分子数10-3∶1,故第二层中存在氯化氢的电离平衡HCl⇌H++Cl-.
设水的物质的量为1 mol,因溶解的HCl分子很少,故所得溶液的质量可近似认为18 g·mol-1×1 mol=18 g,所以溶液的体积为10-3L·m L-1=2.0×10-2L,H+浓度为5×10-3mol·L-1,选项B说法正确;从图示上看第三层是规则排列的水分子,即与HCl的吸附和溶解无关,冰的氢键网络结构保持不变,选项C说法正确;而第一层和第三层均不存在可逆反应HCl⇌H++Cl-,选项D说法错误.答案为D.
应对策略:关注直线或弯线箭头的指向,以确定变化前后微粒的具体存在形式与反应物、生成物种类,进而明确原子种类及价态异同,最后根据题意解答具体问题.
2 侧重于微粒转化过程中的能量变化及化学键变化
例3反应CO2(g)+3 H2(g)⇌CH3OH(g)+H2O(g)使用不同催化剂的调控中,研究人员发现,一定条件下,Pt单原子催化剂有着高达90.3%的甲醇选择性.反应历程如图3所示,其中吸附在催化剂表面上的物种用∗表示,Ts表示过渡态.
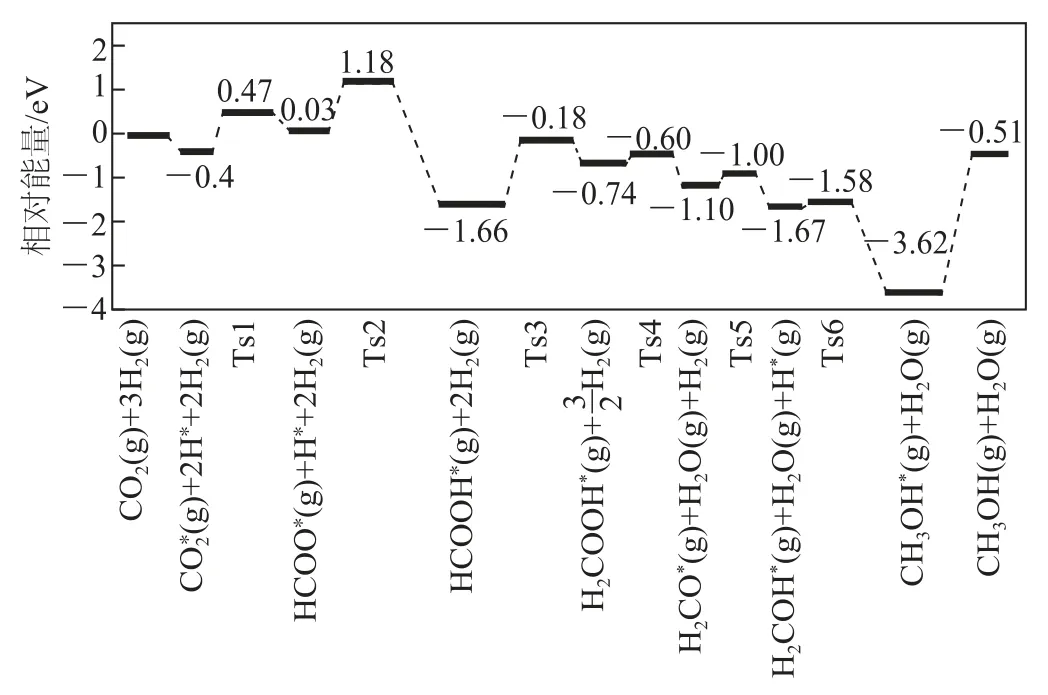
图3
下列说法正确的是( ).
A.该反应的ΔH>0
B.经历Ts1,CO2共价键发生断裂,且生成羧基
D.如果换用铜系催化剂,所得反应历程与上图相同
分析考查陌生反应过程中的能量变化及催化原理等知识,侧重考查接受、吸收、整合化学信息的能力及分析和解决化学问题的能力,解答的关键要运用“能量越低物质越稳定”及能量变化的影响因素等知识.具体为:焓变只与反应物、生成物本身的能量高低有关,与其他无关,故根据图示可知反应CO2(g)+3 H2(g)⇌CH3OH(g)+H2O(g)的ΔH<0,选项A错误;经历Ts1,CO2共价键发生断裂,生成了HCOO∗而不是羧基,选项B错误;能垒(活化能)为1.48 e V,即

对应的是HCOOH∗(g)+2H2(g)→Ts3(过渡态),故为反应HCOOH∗(g)+2H2(g)=H2COOH∗(g)+的正反应活化能,选项C正确;不同的催化剂其降低活化能的历程是不同的,选项D错误.答案为C.
例4(2018年北京卷)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程.该历程示意图如图4所示.

图4
下列说法不正确的是( ).
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
分析通过催化剂催化历程示意图,考查考生的识图及催化过程中的能量变化、结构变化等知识.由图示知CH4与CO2在催化剂存在时生成一种物质CH3COOH,其原子利用率为100%,选项A说法正确;CH4选择性活化变为①的过程中,只有1个C—H键发生断裂,选项B说法正确;①能量高于②,故①→②放出能量,同时形成C—C键,选项C说法正确;催化剂只影响化学反应速率,不影响化学平衡,选项D说法错误.答案为D.
应对策略:在微粒变化过程中,首先要关注每种微粒(或结构单元)所对应的能量高低,其次分析微粒在发生变化时涉及的化学键变化及能量变化.
3 侧重于电化学、反应速率、化学平衡等综合知识的考查
例5(2020年山东卷)1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子;第二步Br-进攻碳正离子完成1,2-加成或1,4-加成.反应进程中的能量变化如图5所示.已知在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70∶30和15∶85.下列说法正确的是( ).

图5
A.1,4-加成产物比1,2-加成产物稳定
B.与0℃相比,40℃时1,3-丁二烯的转化率增大
C.从0℃升至40℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D.从0℃升至40℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度
分析考查陌生反应过程中的能量变化及速率、平衡移动的影响因素等知识,侧重考查接受、吸收、整合化学信息的能力及分析和解决化学问题的能力,解答的关键是明确图象表达的化学意义,其突破口是运用“能量越低物质越稳定”的基本原理知识.根据图象分析可知该加成反应为放热反应,且生成的1,4-加成产物的能量比1,2-加成产物的能量低,即1,4-加成产物比1,2-加成产物稳定,选项A正确;不管生成1,4-加成产物还是1,2-加成产物的反应,均为放热反应,故升高温度平衡均逆向移动,转化率会减小,选项B错误;升温时,反应速率均增大,平衡均逆向移动,选项C错误、选项D正确.答案为A、D.
例6(2020年天津卷)理论研究表明,在101 kPa和298 K下,HCN(g)⇌HNC(g)异构化反应过程的能量变化如图6所示.下列说法错误的是( ).
A.HCN比HNC稳定
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.正反应的活化能大于逆反应的活化能
D.使用催化剂,可以改变反应的反应热
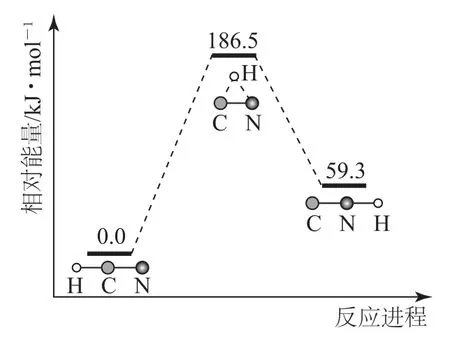
图6
分析考查识图能力及能量越低越稳定原理知识.由图示可直接判断出HCN比HNC能量低,即HCN比HNC稳定,选项A说法正确;焓变只与起始物质的能量有关,故异构化反应的ΔH=59.3 k J·mol-1-0 kJ·mol-1=+59.3 kJ·mol-1,选项B说法正确;正反应的活化能(186.5 kJ·mol-1)大于逆反应的活化能(186.5 kJ·mol-1-59.3 kJ·mol-1=127.2 kJ·mol-1),选项C说法正确;催化剂只影响反应速率,与焓变无关,选项D说法错误.答案为D.
应对策略:首先通过图示判断出所给反应的焓变或活化能高低,然后运用平衡移动原理或影响速率的因素来分析解答.
由上可知,以工农业生产、生活及最新科技研究成果为反应历程的素材,提供反应历程就是为了提供证据,使宏观物质变化能通过微观角度揭示出实质,体现出宏微结合、变化与守恒学科思想;通过读图、识图,较好地考查了数形结合、构性结合等学科思想;通过具体问题考查了信息提取与灵活应用解答问题的能力.因此有理由预测,今后的高考命题中会继续出现反应机理类试题.
链接练习
1.我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3].计算机模拟单个DMF分子在铜催化剂表面的反应历程如图7所示,下列说法正确的是( ).

图7
A.该历程中最小能垒的化学方程式为(CH3)2NCH2OH∗=(CH3)2NCH2+OH∗
B.该历程中最大能垒(活化能)为2.16 e V

D.增大压强或升高温度均能加快反应速率,并增大DMF平衡转化率
2.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图8所示.
下列说法正确的是( ).
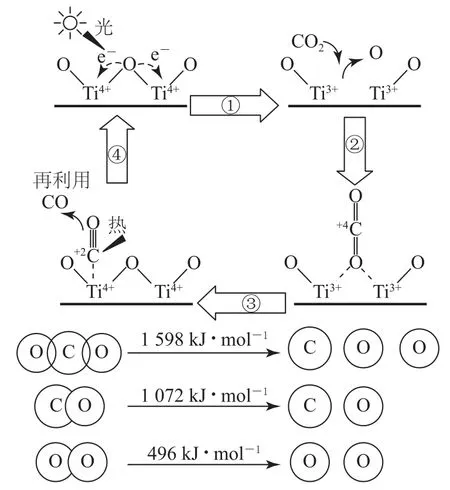
图8
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率

链接练习参考答案
1.A.2.B.
