大豆不溶性膳食纤维对高脂饮食诱导小鼠肥胖的预防作用
2020-12-10王赛男于寒松谷春梅徐锡奇
王赛男,于寒松,谷春梅,贺 阳,张 田,徐锡奇
(吉林农业大学食品科学与工程学院,吉林长春 130118)
随着人们生活节奏加快和膳食结构改变,长期高脂饮食(HFD)会引发肥胖症等一系列慢性疾病[1-2]。目前,肥胖症发病率和死亡率在全球范围内飞速增长,已成为备受关注的公共健康问题[3-4]。肥胖人群多选择节食和药物治疗来减肥,但常伴有严重的副作用。研究证明摄入来自全谷物、蔬菜和水果的膳食纤维(Dietary fiber,DF)可以降低肥胖症的患病风险[5-6]。因此,调整膳食结构,摄入DF是预防肥胖的安全举措之一。中国是大豆的主要生产国和最大消费国,每年生产约2000万吨豆渣[7-8]。然而,豆渣通常作为饲料或直接抛弃,造成了严重的资源浪费和环境问题[9]。豆渣中DF的含量可占豆渣干物质的50%~60%,其中不溶性膳食纤维(Insoluble dietary fiber,IDF)占DF总量的90%以上,是IDF较好的来源[10-11]。
研究认为脂质代谢紊乱是引发肥胖的原因,而脂质代谢过程受到众多信号通路调控,包括脂肪酸、甘油三酯(TG)合成及脂肪酸氧化等[12]。其中二酰甘油酰基转移酶1(DGAT1)、二酰甘油酰基转移酶2(DGAT2)、硬脂酰辅酶A去饱和酶1(SCD1)是甘油三酯合成关键酶[13]。此外,过氧化物酶体增殖物激活受体α(PPARα)在肝脏中高度表达,主要是通过增强其靶基因肉碱棕榈酰转移酶1a(CPT1a)的表达,促进脂肪酸β氧化,在代谢调节中起重要作用[14-15]。随着对DF参与机体糖脂代谢研究的不断深入,发现DF可以通过调节糖原合成、减少糖异生、调控脂质合成和分解代谢等途径来缓解糖脂代谢紊乱[16-17]。其中可溶性膳食纤维(Soluble dietary fiber,SDF)的健康益处已被广泛研究和应用[18-19],而IDF更多地被认为仅对促进肠道蠕动有益[20]。目前,关于IDF参与宿主脂质代谢的作用机制方面报道较少,张春霞等[21]发现山楂IDF可以参与脂质代谢调节过程,改善机体血脂水平,但并未进行机理研究。Chang等[22]研究了梨果渣中IDF的抗肥胖作用,但其主要分析IDF对机体肠道菌群的变化,并未深入探究IDF参与脂质代谢的作用机制。此外,Kim等[23]研究发现在肥胖小鼠日常饮食中添加豆渣,可以通过上调肝脏中PPARα表达水平,下调FAS表达水平来缓解肥胖,但没有对豆渣中的IDF提取物进行相关研究。
综上所述,虽然已有报道证实豆渣的IDF具有调节血脂的功效,但对豆渣的IDF提取物调节血脂及其机制的研究还未见报道,且前期研究发现豆渣DF可通过调节脂质合成代谢相关基因表达水平达到缓解机体肥胖的效果,因此本文以大豆不溶性膳食纤维(SIDF)为研究对象,探究其对HFD诱导小鼠肥胖的预防作用及其在基因水平上的作用机制,为SIDF作为功能成分预防肥胖提供更深入的理论依据,同时提高豆渣的附加值和综合利用。
1 材料与方法
1.1 材料与仪器
大豆不溶性膳食纤维(纯度>90.5%) 实验室自制;总胆固醇(T-CHO)测试盒、甘油三酯(TG)测试盒、高密度脂蛋白胆固醇(HDL-C)测试盒、低密度脂蛋白胆固醇(LDL-C)测试盒、葡萄糖(GLU)测定试剂盒 南京建成生物工程研究所;小鼠胰岛素(INS)酶联免疫分析试剂盒 上海泛柯实业有限公司;6周龄C57BL/6J雄性小鼠 50只,平均体重18~22 g,购于北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004;基础饲料、高脂饲料 北京科澳协力饲料有限公司。
CPA-125电子天平 德国Sartorius公司;叶拓101系列鼓风干燥箱 上海叶拓仪器仪表有限公司;KL04-A离心机 美国Agilent公司;HBS-1096B酶标仪 美国Molecular Devices公司;Toptical196梯度荧光定量PCR仪 德国耶拿分析仪器股份有限公司;F013030045手持式匀浆器 美国Dremel公司。
1.2 实验方法
1.2.1 动物分组及饲养 雄性C57BL/6J小鼠适应性饲养7 d后随机分为5组:正常饮食对照组(ND)、高脂饮食对照组(HFD)、不溶性膳食纤维低(LSIDF)、中(MSIDF)、高剂量组(HSIDF),每组10只小鼠,每笼饲养5只。由于SIDF具有良好的吸水性和膨胀性,其灌胃剂量依据Ma等[24]和石彦囯等[25]的报道,稍作修改。ND组和HFD组灌胃生理盐水,SIDF低、中、高剂量组灌胃剂量分别为250 mg/kg、500 mg/kg、1 g/kg BW/d。各组的饲料配比如表1,除ND组饲喂基础饲料外,其余各组饲喂高脂饲料[26]。持续饲喂20周,摄食量及小鼠体重分别每天及每周进行监测记录。动物实验末期,将所有小鼠隔夜禁食12 h,眼球采血,3500 r/min 15 min离心后取上清备用。取肝脏、腹部脂肪、附睾脂肪及肾周脂肪,称重后-80 ℃条件储存。
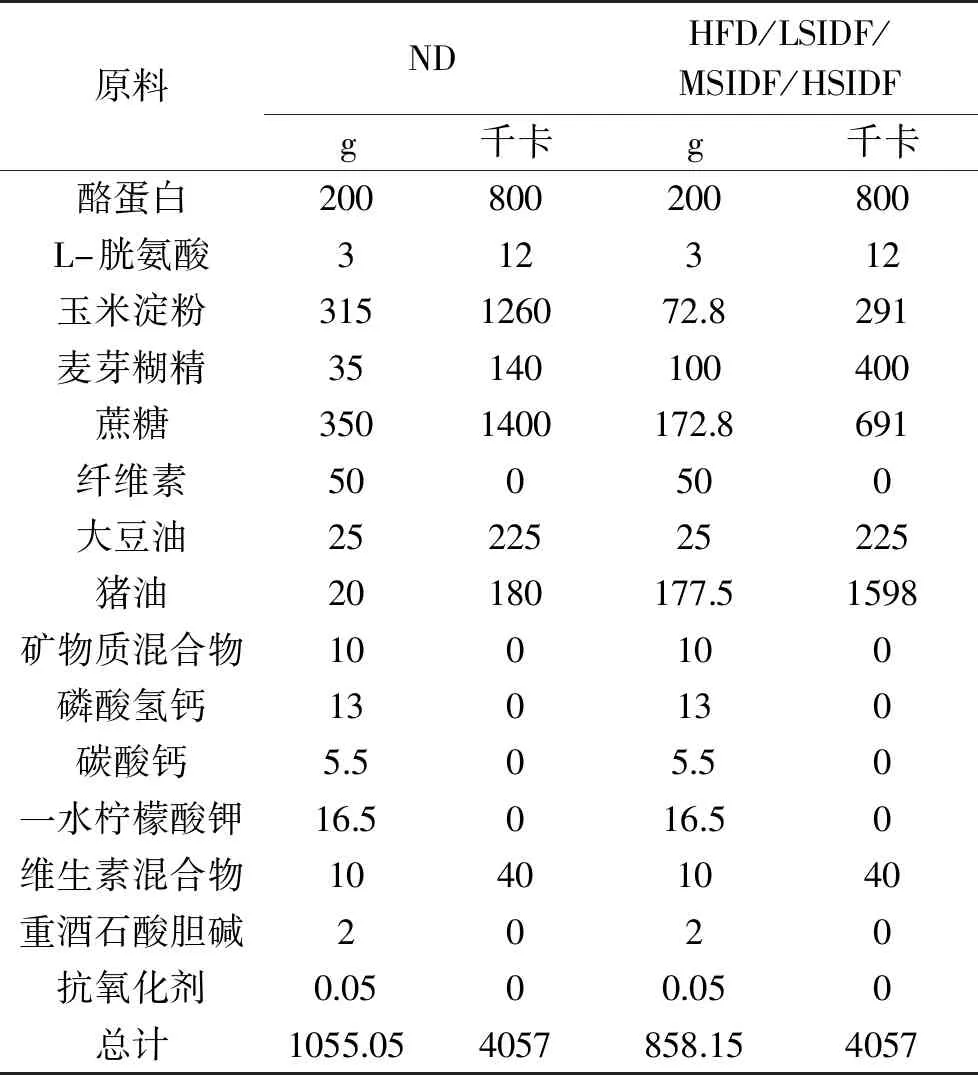
表1 饲料的组成
1.2.2 体重和摄食量 实验过程中每周定时分别对各组小鼠进行称重并记录,精确到0.1 g。每次投放适量的食物,投放前对饲料进行称重,隔天称余下饲料的重量(各组小鼠笼盒中的大块残渣称量记录,残渣碎屑忽略不计),计算每日食物摄入量。
1.2.3 血清中脂类指标的测定 取各组小鼠血清,测定各组小鼠血清中总胆固醇(TC)、TG,高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)和低密度脂蛋白脂蛋白(Low density lipoprotein cholesterol,LDL-C)的含量。
1.2.3.1 TC含量测定 选用96孔板操作,分别设置空白孔、标准孔和各组样本孔,向空白孔中加入2.5 μL蒸馏水,标准孔中加入2.5 μL校准品,样本孔中加入2.5 μL血清,各个操作孔中均加入250 μL工作液,混匀,37 ℃孵育10 min,波长510 nm处用酶标仪测定各孔吸光值。TC含量按式(1)计算。

式(1)
1.2.3.2 TG含量测定 参照1.2.3.1中操作步骤,TG含量按式(2)计算。

式(2)
1.2.3.3 HDL-C含量测定 选用96孔板操作,分别设置空白孔、标准孔和各组样本孔,向空白孔中加入2.5 μL蒸馏水,标准孔中加入2.5 μL校准品,样本孔中加入2.5 μL血清,各个操作孔中均加入180 μL R1溶液,混匀,37 ℃孵育10 min,波长546 nm处用酶标仪测定各孔吸光值A1。向各个操作孔中加入60 μL R2溶液,混匀,37 ℃孵育5 min,波长546 nm处用酶标仪测定各孔吸光值A2。HDL-C含量按式(3)计算。
HDL-C含量(mmol/L)=[(样本A2-样本A1)-(空白A2-空白A1)]/[(标准A2-标准A1)-(空白A2-空白A1)]×校准品浓度(mmol/L)
式(3)
1.2.3.4 LDL-C含量测定 参照1.2.3.3中操作步骤,LDL-C含量按式(4)计算。
LDL-C含量(mmol/L)=[(样本A2-样本A1)-(空白A2-空白A1)]/[(标准A2-标准A1)-(空白A2-空白A1)]×校准品浓度(mmol/L)
式(4)
1.2.4 肝脏中脂类指标的测定 准确称取各组小鼠肝脏组织100 mg,置于5 mL离心管中,按重量(g)∶体积(mL)=1∶9的比例,加入0.9 mL无水乙醇,冰水浴条件下机械匀浆,2500 r/min,离心10 min,取上清液测定各组小鼠肝脏中TC和TG含量,具体实验步骤参照1.2.3.1和1.2.3.2进行。
1.2.5 肝脏指数和脂肪系数的测定 分离出各组小鼠的肝脏、腹部脂肪、附睾脂肪和肾周脂肪组织,用生理盐水清洗,滤纸吸干水分,称量并记录,肝脏指数按式(5)计算,脂肪系数按式(6)计算。

式(5)

式(6)
1.2.6 HE染色 将各组小鼠肝脏(约100 mg)浸于4%的多聚甲醛固定液中,常规石蜡包埋,石蜡切片,将石蜡切片进行苏木素-伊红(HE)染色。光学显微镜下从低倍到高倍依次观察肝脏组织病理变化。
1.2.7 肝脏脂肪合成代谢相关基因表达的测定
1.2.7.1 肝脏组织中总RNA的提取及反转录 实验方法根据刘清清[27]方法略有改动。采用Trizol法提取各组小鼠肝脏组织中总RNA,称取肝脏组织50 mg,置于无RNA酶离心管内,加1 mL Trizol试剂,匀浆后每管加200 μL预冷的三氯甲烷,振荡20 s,冰浴静置15 min,4 ℃ 12000×g离心15 min,小心移取400 μL RNA上清液至离心管中,向每管加入等体积异丙醇沉淀RNA,室温静置10 min,4 ℃ 12000×g离心10 min,留取沉淀即为RNA,用75%乙醇洗涤,静置5 min,4 ℃ 8000×g离心5 min,留取沉淀用无RNA酶水溶解并测定其浓度。根据测得浓度进行反转录制得cDNA于-20 ℃储存备用。
1.2.7.2 实时荧光定量PCR 将1.2.7.1所得的cDNA取2 μL于PCR管中,分别加入SYBR Green I染料12.5 μL,上下游引物各1 μL以及蒸馏水8.5 μL进行PCR 扩增。各基因引物的上下游序列见表2。
1.3 数据处理
2 结果与分析
2.1 大豆不溶性膳食纤维对小鼠体重和摄食量的影响
如图1(a)所示,SIDF干预期间,HFD组小鼠体重增加比ND组更快。补充SIDF 12周后,与HFD组相比,SIDF组小鼠体重增加开始逐渐减缓。SIDF干预20周时,与HFD组(38.56±1.15 g)相比,LSIDF、MSIDF、HSIDF组小鼠体重分别降低至(32.87±1.32)、(31.69±1.01)、(29.10±1.12) g(P<0.001),HSIDF组体重降低最为显著。如图1(b)所示,与ND组相比,HFD组摄食量显著减少(P<0.05),但该组能量摄入较高。此外,SIDF干预组摄食量相对于HFD组有所减少(P>0.05)。结果表明,SIDF可控制小鼠体重增长,这是由于SIDF具有良好的吸水性和持水性,可以增加机体饱腹感,从而降低小鼠摄食量,进而达到抑制或减缓小鼠体重增长的效果。此结果与汪平权等[9]关于豆渣对小鼠体重控制作用研究结果表现一致,说明SIDF发挥主要作用。由此可见,长期摄入SIDF能有效减缓HFD引起的机体体重增加,对预防肥胖具有积极作用。

图1 SIDF对HFD诱导小鼠体重和摄食量的影响

表2 实时荧光定量聚合酶链式反应的引物序列
2.2 大豆不溶性膳食纤维对小鼠血脂水平的调节作用
SIDF干预20周后,小鼠血清脂质水平如图2所示,与ND组相比,HFD组血清中TC、TG和LDL-C水平显著升高,分别升高10.32%(P<0.05)、13.61%(P<0.01)、60.55%(P<0.001),HDL-C水平显著降低 21.98%(P<0.01)。由此可见,长期HFD会导致血脂代谢紊乱。与HFD组相比,LSIDF、MSIDF和HSIDF组小鼠血脂水平得到改善,TC水平分别显著降低8.97%(P<0.05)、15.11%(P<0.001)、11.19%(P<0.01),TG水平分别显著降低9.11%(P<0.01)、22.11%(P<0.001)、26.22%(P<0.001),LDL-C含量显著降低25.72%、31.42%、36.76%(P<0.001),HDL-C含量显著升高28.15%、25.35%、39.49%(P<0.001)。实验结果说明SIDF对HFD引起的血脂水平升高起到拮抗作用,其中SIDF组TC、TG、LDL-C水平下降,HDL-C水平升高。王康乐等[28]指出当肝脏脂质代谢紊乱时,其血脂指标一般表现为TC、TG、LDL-C水平升高,HDL-C水平降低。由此可见,SIDF可通过调节血脂水平来改善肝脏脂质代谢紊乱。其中,血清TG水平降低与SIDF可以结合脂肪,直接阻碍脂肪的吸收有关。此外,SIDF可抑制肠道内TC的吸收,阻碍胆汁酸重吸收进入肝肠循环,导致胆汁酸和TC排出,同时HDL受体活性增强,可转运血液中更多的TC转移至肝脏分解代谢,因此导致血清中TC、LDL-C的含量降低,HDL-C含量升高从而实现调节脂质代谢的作用[29-30]。
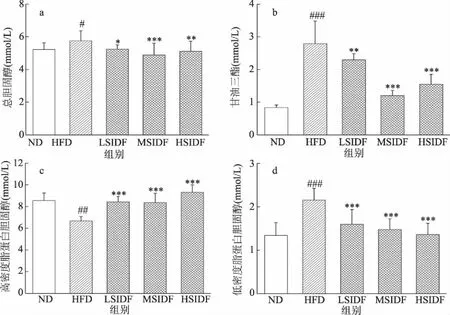
图2 SIDF对HFD诱导小鼠血清血脂水平的影响
2.3 大豆不溶性膳食纤维对小鼠肝脏脂质水平的调节作用

图3 SIDF对HFD诱导小鼠肝脏脂质水平的影响
小鼠肝脏脂质水平如图3所示,与ND组相比,HFD组小鼠肝脏TC水平显著升高55.65%(P<0.001),TG水平升高至ND组的2.34倍(P<0.001)。与HFD组相比,LSIDF、MSIDF和HSIDF组小鼠肝脏中TC水平分别降低4.95%(P>0.05)、8.67%(P<0.05)、18.61%(P<0.001),TG水平分别降低17.75%(P<0.05)、56.97%(P<0.001)、44.5%(P<0.001),其中MSIDF和HSIDF组效果优于LSIDF组。实验结果表明SIDF可有效调节小鼠肝脏脂质水平,降低TC、TG含量,由于SIDF可以促进TC和胆汁酸的排泄,进而加快肝脏中TC转化为胆汁酸,因此间接导致肝脏TC、TG水平降低。报道已证实胡萝卜和藜麦中IDF均可促进TC和胆汁酸排出,进而有效降低肝脏TC、TG水平[31-32]。因此摄入SIDF对HFD引起的肝脏脂质代谢紊乱具有调节作用,可有效降低肝脏中TC、TG水平。
2.4 大豆不溶性膳食纤维对小鼠肝脏指数和脂肪系数的影响
由图4可知,与ND组(35.99±3.36 mg/g)相比,HFD组(32.49±2.33 mg/g)肝脏指数显著降低(P<0.01),这与小鼠长期高脂饮食有关。与HFD组相比,LSIDF、MSIDF、HSIDF组肝脏指数分别为(28.88±2.02)、(29.63±4.07)、(29.27±2.89) mg/g(P<0.05),可能是由于摄入SIDF减少了肝脏脂肪堆积。由表3可知,与ND组相比,HFD组小鼠脂肪系数显著升高(P<0.01),这与其体内白色脂肪堆积有关。
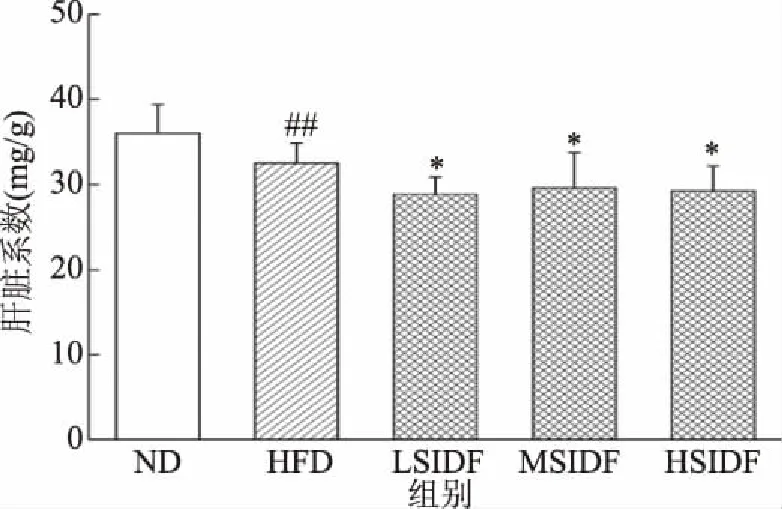
图4 SIDF对HFD诱导小鼠肝脏指数的影响

表3 SIDF对HFD诱导小鼠脂肪系数的影响
乔青莲[33]认为肥胖主要是由于脂肪组织的过度堆积造成的。与HFD组相比,SIDF组脂肪系数显著降低(P<0.001),且HSIDF组优于LSIDF和MSIDF组,存在剂量关系。此外,SIDF组腹部和肾周脂肪重量显著减少(P<0.05)。实验结果表明,摄入SIDF可降低小鼠肝脏指数和脂肪系数,且其脂肪系数与SIDF摄入量呈负相关。白色脂肪组织的积累还会诱发肝脏脂质代谢异常、胰岛素抵抗、高血脂等代谢综合征的重要原因[34]。因此摄入SIDF可通过减少体内白色脂肪积累,降低肝脏脂质变性的风险,进而达到预防或缓解肥胖的目的。
2.5 肝脏组织病理学分析
由图5可知,与ND组相比,HFD组的肝脏组织中脂肪空泡明显,有大量脂滴聚集,存在细胞肿胀和核消失的现象,说明长期HFD会导致肝脏组织脂肪变性,有明显病变的特征。SIDF组相比于HFD组,其肝脏组织中存在少数脂滴,细胞肿胀和核消失的现象有所缓解,且随着SIDF摄入量增加,改善效果越好,说明摄入SIDF能后减少肝脏脂滴聚集,减少肝脏脂肪变性的风险。
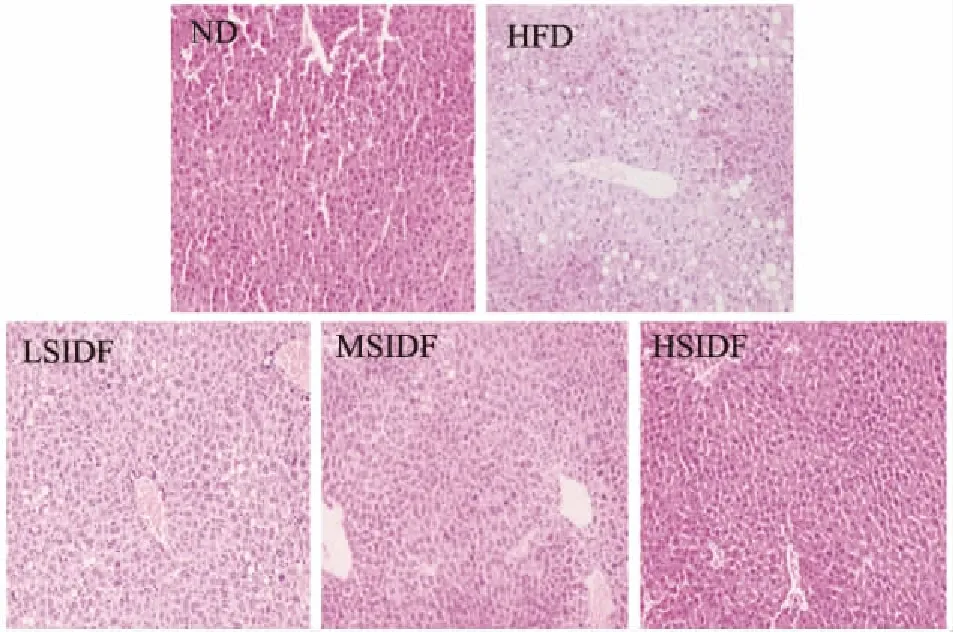
图5 SIDF对小鼠肝脏病理学形态的影响(200×)
2.6 大豆不溶性膳食纤维对肝脏脂肪合成代谢相关基因表达的影响
SIDF干预20周后,小鼠肝脏甘油三酯合成相关基因表达水平如图6(a)所示,DGAT1,DGAT2和SCD1是甘油三酯合成过程中的关键酶,与ND组相比,HFD组小鼠肝脏中DGAT1,DGAT2和SCD1 mRNA表达水平显著升高(P<0.01)。与HFD组相比,LSIDF和MSIDF组对DGAT1,SCD1 mRNA表达水平无显著影响(P>0.05)。HSIDF组可显著下调DGAT1,SCD1 mRNA表达水平,分别下调0.66倍、0.45倍(P<0.01)。SIDF干预组DGAT2 mRNA表达水平显著下调0.58、0.40、0.66倍,HSIDF组效果优于LSIDF和MSIDF组,说明长期摄入SIDF可降低甘油三酯合成速率。

图6 SIDF对HFD诱导小鼠肝脏脂质合成代谢相关基因表达水平的影响
小鼠肝脏脂肪酸合成分解相关基因表达水平如图6(b),与ND组相比,HFD组FAS mRNA表达水平显著上调(P<0.01),但长期干预后,MSIDF和HSIDF组FAS mRNA表达水平显著下调0.59倍(P<0.01)、0.48倍(P<0.001)。与ND组相比,HFD组中CPT1a mRNA表达水平得到显着抑制(P<0.01)。在干预 20 w后,FAS、CPT1a mRNA表达以剂量依赖性方式恢复至正常水平且差异显著(P<0.05)。FAS、PPARα、CPT1a等被认为是脂肪酸合成及β氧化过程中具有代表性的关键酶[26,35]。
由此可见,IDFS可以上调脂质合成相关基因表达水平,同时下调脂肪酸β氧化相关基因表达水平。Kim等[23]研究发现在肥胖小鼠日常饮食中添加豆渣,可以通过上调肝脏中PPARαmRNA表达水平,下调FAS mRNA表达水平来缓解肥胖。通过本项研究认为这可能主要归因于SIDF。由此可见,SIDF可以作为功能成分,通过减少脂质合成,加快脂质分解来达到预防肥胖的目的。
3 结论
实验结果表明低、中、高剂量的SIDF均能减缓由HFD引起的体重增长,降低食物摄入量,并呈剂量依赖趋势。经长期干预可以有效降低小鼠血清和肝脏脂质水平,还有助于减少体内白色脂肪积累,且与SIDF摄入量呈正相关。HSIDF组通过下调DGAT1、DGAT2、SCD1及FAS mRNA表达水平来降低脂质合成速率,同时上调PPARα和CPT1a mRNA表达水平来加速脂肪酸β氧化,促进脂质分解,可有效调节肝脏脂质水平。以上结果说明SIDF可以在基因水平上调节肝脏脂质代谢过程,为SIDF预防肥胖提供了更深入的理论依据,同时提高大豆的附加值和综合利用。但仍存在许多不足,需进一步探讨SIDF抑制HFD诱导肥胖的信号通路及分子调节机制。
