蒜黄根膳食纤维提取工艺优化及其理化性质分析
2020-12-10罗延丽王永康刘鑫燕刘云国康大成
马 斌,罗延丽,王永康,刘鑫燕,刘云国,康大成
(临沂大学生命科学学院,山东临沂 276000)
蒜黄为葱科为多年生草本植物,别名黄韭菜、韭黄,是利用大蒜鳞茎在避光条件下进行栽培而成。我国各地均有种植,营养丰富,是人们普遍种植和喜食的蔬菜。然而蒜黄种植会产生大量的蒜黄根,据田间测定,每产出蒜黄1200公斤,可同时产出蒜黄根1000公斤左右。目前蒜黄根主要作为生产垃圾处理,大量的蒜黄根不仅会产生环境污染问题,也会造成大量的资源浪费。因此探索蒜黄根的有效加工利用,对于延长蒜黄产业链,提高产业经济效益具有重要意义。
膳食纤维是一类不被人体消化分解的结构复杂的多糖类天然大分子物质的总称。按溶解性不同可分为水溶性膳食纤维(soluble dietary fiber,SDF)和非水溶性膳食纤维(insoluble dietary fiber,IDF)两类[1-2]。研究表明,膳食纤维具有促进胃肠蠕动、增加粪便体积、预防便秘和心血管疾病等保健功能,现已作为食品工业的重要基料而被开发和应用[3-4]。据测定,蒜黄根中总膳食纤维(total dietary fiber,TDF)为39.9 g/100 g(干基),IDF含量为34.9 g/100 g(干基),均高于鲜蒜瓣中的TDF和IDF含量(TDF为33.2 g/100 g(干基),IDF为20.4 g/100 g(干基))。因此提取蒜黄根中膳食纤维,一方面可促进资源再利用,另一方面可为功能性食品和健康食品开发提供优质原料。目前国内外已开展对大蒜秸秆的综合利用。黄六容等[5]采用超声、酶解及超声复合酶解法对大蒜秸秆SDF进行改性处理,结果发现,超声—复合酶解法提取的大蒜秸秆TDF结构疏松,比表面积较大,对葡萄糖和胆固醇具有较强的吸附性。赵匀淑等[6]则进一步发现,采用超声—复合酶解法提取得到的SDF,不仅得率最高并且具有良好的自由基清除能力。然而目前国内外尚未开展蒜黄根膳食纤维的提取和综合利用。
因此,本研究以蒜黄根为研究对象,在单因素实验基础上采用响应面曲线法中的Box-Behnken试验对复合酶法提取蒜黄根TDF的工艺进行优化研究,并对最优条件下得到的蒜黄根TDF的功能性质和抗氧化性进行了初步分析,以期为蒜黄根的综合利用提供参考。
1 材料与方法
1.1 材料与仪器
蒜黄根(AlliumsativumL.,由苍山紫皮大蒜鳞茎避光种植而成) 由山东省临沂市平邑县温水镇政府提供;α-淀粉酶(3700 U/g)、纤维素酶(3 U/mg)、中性蛋白酶(50000 U/g) 北京索莱宝科技有限公司;胆固醇(98%)、福林酚溶液 北京索莱宝生物科技有限公司;葡萄糖、邻苯二甲醛、1,1-二苯基-2-三硝基苯肼(DPPH)、无水乙醇、碳酸钠、氢氧化钠等 均为国产分析纯。
BS-210S型电子天平 北京赛多利斯仪器有限公司;万特千分之一分析天平 杭州万特衡器有限公司;超纯水机(芷昂-BEST) 上海芷昂仪器有限公司;DZF-6094型真空干燥箱 上海一恒科学仪器有限公司;752紫外分光光度计 上海精密科学仪器有限公司;Mikro-220R BS-210S型离心机 德国Hettich科学仪器公司;SHZ-S(Ⅲ)循环水式多用真空泵 上海力辰邦西仪器科技有限公司;HWS-24型电热恒温水浴锅 上海资一仪器设备有限公司;雷磁pH计 上海雷磁仪器厂。
1.2 实验方法
1.2.1 蒜黄根TDF提取工艺 新收割的蒜黄根经洗涤、去除蒜瓣后,将剩余的大蒜须根在60 ℃条件下烘干至恒重。粉碎后过60目筛得到蒜黄根粉。准确称取3 g的蒜黄根粉,为保证酶解过程中pH稳定,按料水质量体积比1∶20加入磷酸盐缓冲液(pH6.0,0.001 mol/L NaH2PO4),加入0.4%(w/w,以蒜黄根干粉为基准)的复合酶(经预实验测定,淀粉酶和纤维素酶质量的最优组成比为1∶1)后,调节至指定的pH和温度酶解一定时间,煮沸10 min灭酶,调整pH至6.0,于60 ℃水浴中加入0.2%(w/w,以蒜黄根干粉为基准)的中性蛋白酶酶解30 min后煮沸灭酶10 min,以无水乙醇沉淀1 h,抽滤后将所得滤渣于105 ℃烘箱中干燥即得产品TDF。
1.2.2 单因素实验
1.2.2.1 酶解pH 将蒜黄根粉在温度65 ℃下酶解1.5 h,采用不同酶解pH(5.5、6.0、6.5、7.0、7.5)进行提取,以蒜黄根TDF得率为指标确定酶解pH。
1.2.2.2 酶解时间 将蒜黄根粉在酶解pH6.0、酶解温度65 ℃条件下,采用不同酶解时间(0.5、1.0、1.5、2.0、2.5 h)进行提取,以蒜黄根TDF得率为指标确定酶解时间。
1.2.2.3 酶解温度 将蒜黄根粉在pH6.0,酶解1.5 h条件下,采用不同酶解温度(45、50、55、60、65 ℃)进行提取,以蒜黄根TDF得率为指标确定酶解温度。
1.2.3 响应面法优化提取工艺条件 以单因素实验结果为基础,根据Box-Behnken试验设计原理,以酶解pH、酶解温度和酶解时间为变量,分别以A、B和C表示,以蒜黄根TDF得率为响应值,采用三因素三水平响应面分析法求取优化的工艺参数,实验因素与水平见表1。
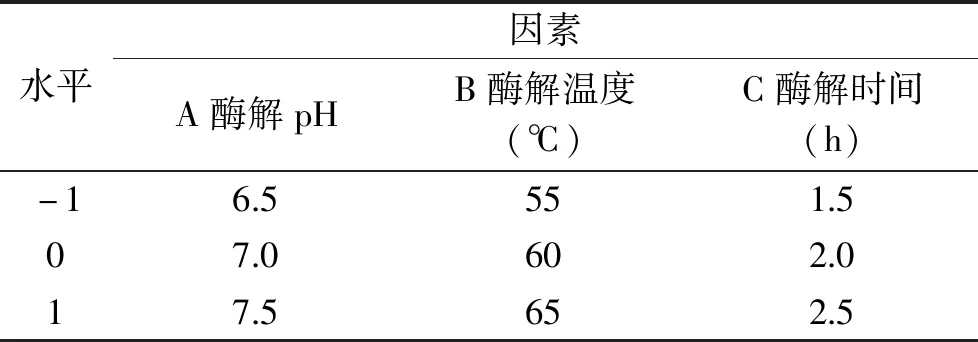
表1 响应面分析因素水平表
1.2.4 蒜黄根TDF得率的测定 参考Xue等[7]方法并做适当修改,称取蒜黄根粉3.0 g(M1),采用1.2.1方法提取后,将抽滤得到的滤渣于105 ℃烘箱中干燥至恒重后,称取产品TDF的质量(M2)。按下式计算蒜黄根TDF得率:
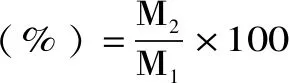
式(1)
1.2.5 持水、持油能力和膨胀性测定
1.2.5.1 持水性 参考Xue等[7]方法并做适当修改,称取蒜黄根粉或经优化条件提取的蒜黄根TDF 1.0 g(M1)于100 mL烧杯中,加入去离子水70 mL,磁力搅拌12 h后转移至离心管中,以5000 r/min离心10 min,除去上清,称取沉淀质量(M2)。按下式计算样品的持水性:

式(2)
1.2.5.2 持油性 参考Jia等[8]方法并做适当修改,称取蒜黄根粉或经优化条件提取的蒜黄根TDF 1.0 g(M1)于50 mL离心管中,加入大豆油10 mL,搅拌均匀后静置16 h,5000 r/min离心10 min,去除上油层,称取沉淀质量(M2)。按下式计算样品的持油性:

式(3)
1.2.5.3 膨胀性 参考申辉等[9]方法,准确称取蒜黄根粉或经优化条件提取的蒜黄根TDF 2.00 g(M),置于50 mL量筒中,静置使粉末表面平整后读数,记录体积数(V1),加入30 mL蒸馏水,搅拌均匀后在25 ℃条件下放置24 h,读取浸泡后膨胀的体积数(V2),按下式计算样品的膨胀性:

式(4)
1.2.6 吸附能力测定
1.2.6.1 吸附葡萄糖能力 参考Peerajit等[10]方法,称取蒜黄根粉或经优化条件提取的蒜黄根TDF 0.1 g(M)于250 mL的锥形瓶中,加入50 mL(V)质量浓度为100 μg/mL(C0)的葡萄糖溶液,37 ℃振荡6 h后,5000 r/min离心20 min,吸取上清液,采用蒽酮法测定上清液中葡萄糖含量(C1)。样品对葡萄糖吸附能力按下式计算:
式(5)
1.2.6.2 吸附胆固醇能力 参考Chu等[11]方法,市售鸡蛋取蛋清留蛋黄,加入9倍体积去离子水充分搅打成均匀乳液,分别称取1.0 g(M)蒜黄根粉和经优化条件提取的蒜黄根TDF于100 mL的锥形瓶中,加入50 g搅拌均匀的蛋黄液,在37 ℃下振荡2 h,10000 r/min转速下离心10 min后吸取上清液,采用邻苯二甲醛法测定胆固醇含量。蒜黄根粉和TDF对胆固醇的吸附量按下式计算:
式(6)
其中,W0为吸附前蛋黄液中胆固醇质量(mg);W1为吸附后蛋黄液中胆固醇质量(mg);M为蒜黄根粉或蒜黄根TDF(g)。
1.2.7 抗氧化能力测定 准确称取0.10 g蒜黄根粉或蒜黄根TDF于50 mL去离子水中充分振荡均匀,用于下述抗氧化性指标测定。
1.2.7.1 总酚含量 参考Ledoux等[12]方法,取2.5 mL样品,加入10%(v/v)福林酚溶液2.5 mL,常温静置反应3 min,再加入75 mg/mL Na2CO3溶液2 mL后混匀,于25 ℃反应1 h,以去离子水为空白,在765 nm下测定吸光度。以没食子酸为标准品绘制标准曲线,标准曲线为Y=0.0013X-0.0265,R2=0.9996。结果以mg/100 g干粉表示。
1.2.7.2 羟基自由基清除能力 参考Shi等[13]方法并做适当修改,取2 mL样品,加入1.4 mL 6 mmol/L H2O2溶液,2 mL 1.5 mmol/L FeSO4溶液,混合均匀,静置10 min之后,加入0.6 mL 6 mmol/L的水杨酸溶液,再次混匀,37 ℃条件下水浴1 h,在波长510 nm条件下测定吸光度值A1。羟基自由基清除率为:
式(7)
其中A0为空白对照吸光度;A1为样品吸光度;A2为样品本底管吸光度,下同。
1.2.7.3 DPPH自由基清除能力 参考Blois等[14]方法略作修改,取3 mL样品,加入无水乙醇配制0.1 mmol/L DPPH溶液3 mL,25 ℃恒温水浴30 min,混匀后于517 nm测其吸光度A1。
式(8)
1.3 数据处理
上述所有试验每个处理组均重复4次,取其平均值。结果采用Microsoft Office Excel 2003和Design-Expert V10进行数据分析处理和作图。对于单因素实验,应用SAS 9.2软件对数据进行方差分析;对于蒜黄根TDF理化性质分析,采用SAS 9.2软件对数据进行t-test分析,差异显著性水平均为P<0.05。
2 结果与分析
2.1 蒜黄根TDF提取单因素实验
2.1.1 酶解pH对蒜黄根TDF得率的影响 酶解pH对蒜黄根TDF得率的影响见图1。由图1可知,蒜黄根粉在65 ℃下酶解1.5 h时其TDF得率随pH的升高呈先上升后下降的趋势。pH7.0时TDF得率最高为70.83%(P<0.05),当pH进一步升高时,蒜黄根TDF得率显著降低(P<0.05)。这可能与pH在7.0附近时,复合酶的活性较高有关[15]。因此选择酶解pH7.0进行下一步工艺条件优化。

图1 酶解pH对蒜黄根TDF得率的影响
2.1.2 酶解时间对蒜黄根TDF得率的影响 酶解时间对蒜黄根TDF的影响见图2。由图2可知,提取时间在0.5~2.0 h之间时,蒜黄根粉TDF得率随时间的延长而升高。当提取时间为2.5 h时,蒜黄根TDF得率与2.0 h无显著差异(P>0.05)。其原因在于,酶解时间较短时,部分淀粉未完全水解,增加酶解时间有助于TDF的提取;当酶解时间超过2.0 h后,TDF得率呈下降趋势。分析原因在于,一方面SDF被降解为低分子量多糖、低聚糖或单糖,而无法被乙醇沉淀;另一方面,部分半纤维素被水解为非膳食纤维,从而使TDF得率降低[16-17]。因此酶解时间选择2.0 h较合适。
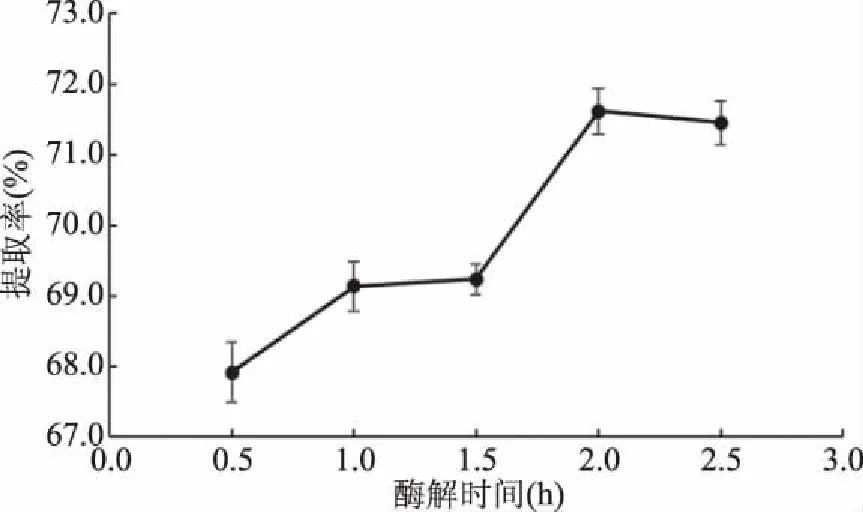
图2 酶解时间对蒜黄根TDF得率的影响
2.1.3 酶解温度对蒜黄根TDF得率的影响 由图3可知,酶解温度在45~60 ℃时,蒜黄根TDF得率随温度升高而升高,在60 ℃时达到最大值,但与55 ℃时差异不显著(P>0.05);当温度在65 ℃时,蒜黄根TDF得率显著下降(P<0.05)。其原因在于复合酶在最适温度60 ℃时酶活性最大,偏离最适温度,两种酶的酶活性将受到抑制[18-19]。因此,酶解温度选择60 ℃较为适宜。

图3 酶解温度对TDF得率的影响
2.2 蒜黄根TDF提取条件响应面优化
2.2.1 模型建立与显著性分析 以酶解pH(A)、酶解温度(B)和酶解时间(C)三个因素,以蒜黄根TDF得率(Y)为响应值进行Box-Behnken设计,实验设计方案见表2。其中实验1~12是析因实验,实验13~17是中心零点实验。零点实验重复5次,用以估计实验误差。
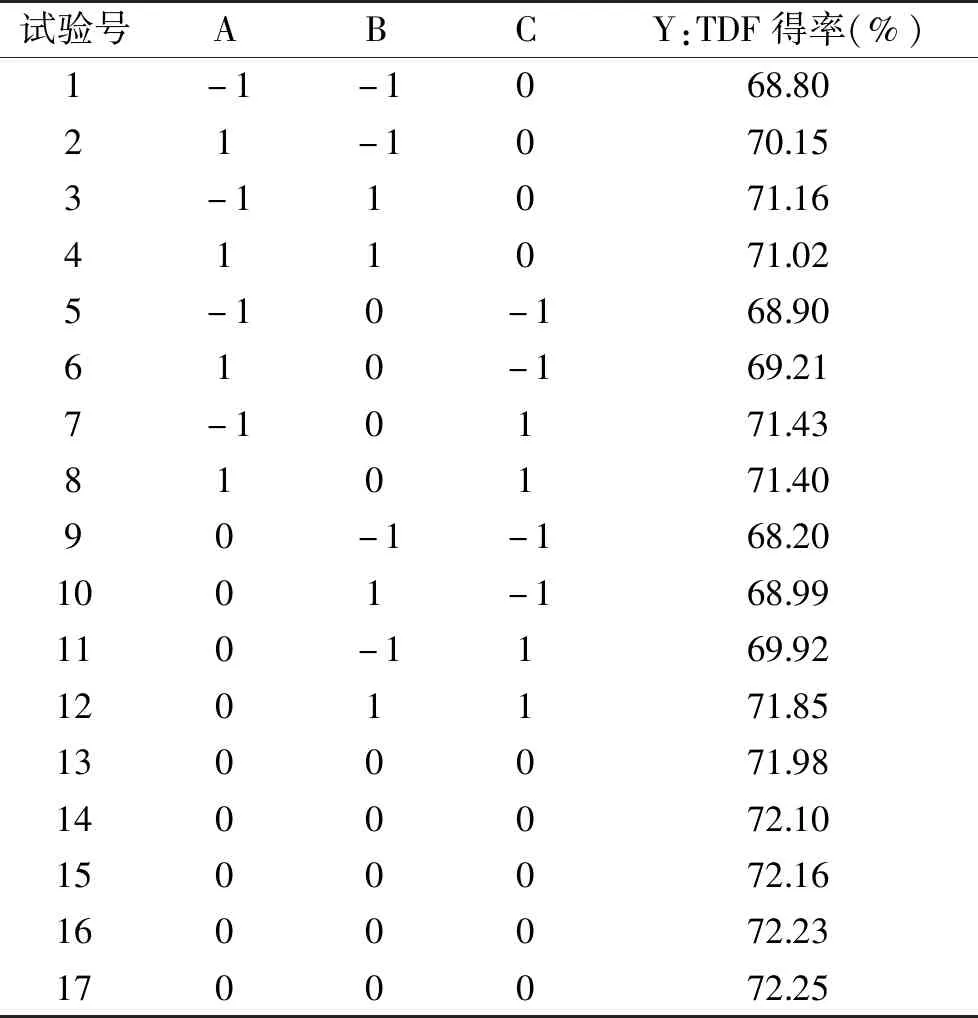
表2 响应面分析试验设计及结果
利用Design-Expert V10软件中的Box-Behnken模型,对表2中数据进行多元回归拟合和方差分析,分析结果见表3。
由表3可知,模型F值为130.84(P<0.0001),表明所得回归模型极显著,而回归方程失拟检验P>0.05,差异不显著,模型的相关系数R2=0.9865,因此所得回归模型可靠,拟合度较好,可较好地描述蒜黄根TDF提取过程中各因素与响应值之间的真实关系,可用于预测蒜黄根TDF的最佳提取工艺条件。对该回归方程系数进行显著性检验可知,一次项(B、C)、交互项AB与二次项(A2、B2、C2)对蒜黄根TDF得率影响极显著(P<0.01),一次项A和交互项BC影响显著(P<0.05),而交互项AC影响不显著(P>0.05)。去除不显著交互项后,得到蒜黄根TDF得率对各因素的回归方程:
Y=-316.14+47.57A+6.62B+15.10C-0.15AB+0.11BC-2.73A2-0.05B2-4.90C2
2.2.2 响应面分析及优化 为分析试验因素交互作用对蒜黄根TDF得率的影响,采用Design-Expert V10软件分析,得到的响应面见图4。
由图4(A)可知,在所考察的范围内,当酶解温度不变时,随酶解时间的延长,蒜黄根TDF得率呈现先升高后降低的趋势;酶解时间不变时,随酶解温度的升高,也表现为相同的变化趋势。表明酶解时间与酶解温度间存在明显的交互作用。同理,图4(B)中酶解pH和酶解温度的交互作用与图4(A)变化趋势一致。这与回归方程中AB、BC项显著性一致。
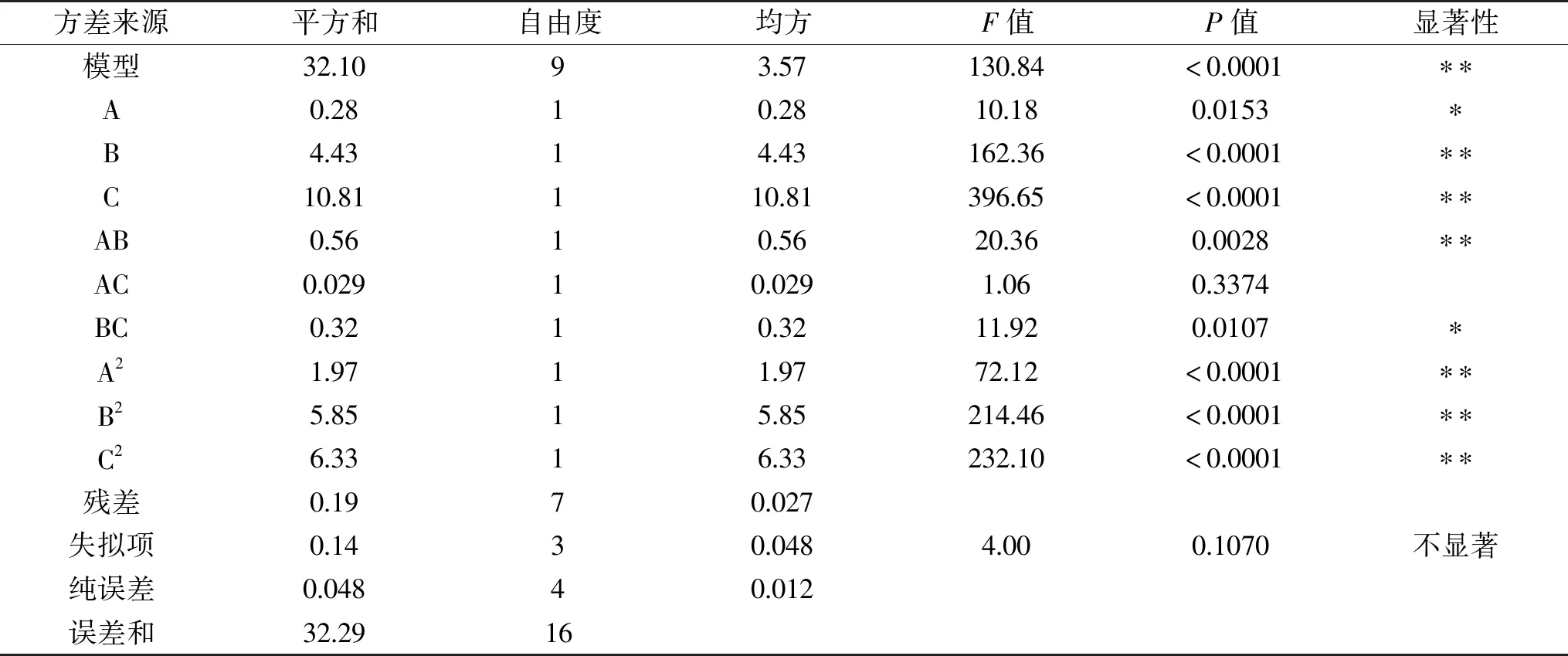
表3 响应面模型方差分析结果

图4 酶解温度与酶解时间(A)、酶解温度与酶解pH(B)交互作用对蒜黄根TDF得率的响应面图
在所选实验因素范围内,利用Design Expert V10软件,得到酶法提取蒜黄根TDF的最优条件为:酶解pH7.02、酶解温度61.87 ℃、酶解时间2.26 h。考虑到实际操作的可行性,将蒜黄根TDF提取条件调整为pH7.0、酶解温度62 ℃、酶解时间2.3 h。在该条件下的验证实验结果表明,蒜黄根TDF得率为72.47%±0.08%,与模型预测值72.59%基本一致,表明所建立的数学模型对优化蒜黄根TDF的提取工艺是可行的。
2.3 蒜黄根TDF理化性质分析
2.3.1 持水性、持油性和膨胀性 当膳食纤维进入人体胃肠道内时,其功能性主要体现在可通过吸收食物中的水分、脂肪从而体积膨胀使人产生饱腹感,还可刺激肠道的蠕动,促进粪便排出从而减轻毒素对人体的危害[20-22]。在最优条件下提取的蒜黄根TDF的持水性、持油性及膨胀性测定结果如表4所示。由表4可知,经提取后的蒜黄根TDF持水性、持油性及膨胀性均优于未提取前的蒜黄根粉(P<0.05)。已有研究表明,TDF持水能力与纤维中SDF含量呈正相关,与IDF含量呈负相关[23]。由于蒜黄根粉经酶解和热处理后,部分IDF转化为SDF。与IDF相比,SDF含有更多的亲水基团、表面积和水结合位点,从而具有更高的持水能力和溶胀能力[24]。另一方面,与香椿叶、竹笋、大蒜秸秆TDF等相比,本研究提取得到的蒜黄根TDF的持水、持油能力和体积膨胀能力与之持平或更优[5,15,24],表明提取得到的蒜黄根膳食纤维不仅有助于改善人体肠道功能,也可作为新型健康食品的优质原料。

表4 蒜黄根TDF与蒜黄根粉持水性、持油性及膨胀性比较
2.3.2 吸附能力 膳食纤维可吸附葡萄糖和胆固醇,降低小肠内葡萄糖和胆固醇的有效浓度,从而降低餐后人体血糖水平的升高和减少胆固醇的吸收[25-26]。经测定发现,提取后的蒜黄根TDF对葡萄糖吸附能力达到了8.00 mg/g,对胆固醇吸附能力为10.52 mg/g,均显著高于提取前的蒜黄根粉(P<0.05)。淀粉酶和纤维素酶在最优工艺条件下作用于蒜黄根时,可改变TDF中木质素的表面结构和疏水性,使其结构更加松散、多孔[27-28],从而更容易与葡萄糖和胆固醇发生吸附作用,这与其对持水性、持油力和膨胀性的影响结果一致,但具体的机理原因还需进一步验证。

表5 蒜黄根TDF与蒜黄根粉吸附能力比较
2.3.3 抗氧化能力 羟基自由基是一种活性氧自由基,可造成食品中脂质、蛋白质过氧化和分解,人体内羟基自由基过多可引起急性损伤、慢性疾病和衰老等现象[29-30]。由表6可知,与蒜黄根相比,经提取后的蒜黄根TDF的羟基自由基清除能力显著下降(P<0.05)。同时,由DPPH自由基清除测定结果可知,提取后的蒜黄根TDF的DPPH自由基清除率也显著降低(P<0.05)。分析原因在于,蒜黄根经酶解、高温灭活、乙醇沉淀等处理后,大蒜中含有的抗氧化物质被大量溶出和破坏,导致其抗氧化能力的降低[31]。大蒜中总酚物质是发挥其抗氧化性的重要活性成分之一[32],故本研究同时测定了蒜黄根TDF与蒜黄根粉中的总酚含量,由表6可知,未提取前蒜黄根粉中总酚含量较高(50.38 mg/100 g干粉),显著高于提取后的蒜黄根TDF(P<0.05)。这与蒜黄根TDF与蒜黄根粉抗氧化能力测定结果一致。
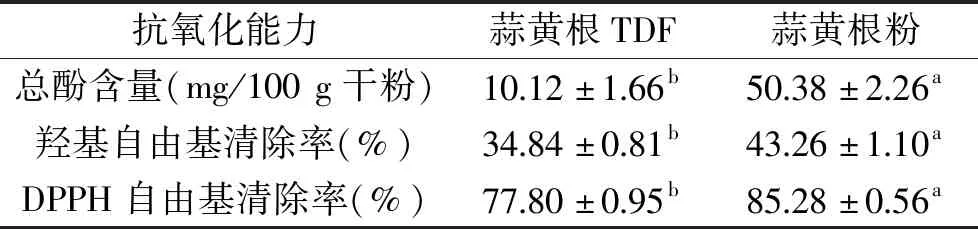
表6 蒜黄根TDF与蒜黄根粉抗氧化能力比较
3 结论
采用响应面优化酶法提取蒜黄根中TDF,结果表明:蒜黄根TDF得率的最佳提取工艺条件为酶解pH7.0、酶解温度62 ℃、酶解时间2.3 h。蒜黄根TDF得率为72.47%±0.08%,与模型预测值72.59%基本一致,表明所建立的数学模型可用于优化蒜黄根TDF的提取工艺。对提取后的蒜黄根TDF理化性质分析可知,提取后的TDF持水性、持油性、膨胀性以及对葡萄糖和胆固醇的吸附能力均显著高于蒜黄根粉。然而蒜黄根TDF的抗氧化能力较蒜黄根粉显著降低,后续研究中可采用超声波、超高压均质或微生物发酵法等技术进行改善。因此总体来看,可将蒜黄根TDF作为肉类和粮油类食品原料加以利用,开发新型健康食品,进一步提高资源利用率与产品附加值。
