响应面优化可溶态和膜结合态马铃薯多酚氧化酶提取工艺
2020-12-09章洁琼刘永翔
李 俊,章洁琼,刘 辉,刘永翔,3,王 辉,卢 扬,*
(1.贵州省农业科学院食品加工研究所,贵州贵阳 550006;2.贵州省农作物技术推广总站,贵州贵阳 550001;3.贵州省生物技术重点实验室,贵州贵阳 550006)
作为继小麦、水稻、玉米之后的世界第四大粮食作物,马铃薯具有产量高、适应性强、营养全面及综合加工用途广泛等优点[1]。马铃薯去皮以后易发生褐变,导致产品品质、色泽和风味下降,这是马铃薯加工面临的一大难题[2]。同时,有研究表明,全世界每年因褐变造成的果蔬损失占总损失的一半以上,且以多酚氧化酶(Polyphenol Oxidase,PPO)引起的酶促褐变为主,有关酶促褐变的研究也一直是果蔬采后加工研究的热点问题[3]。酶促褐变是指果蔬组织中的酚类物质在PPO等的作用下氧化成醌,醌再经聚合形成褐色物质的过程[4]。
PPO在植物细胞内有两种存在形式:可溶态(sPPO)存在于细胞质或质体中,膜结合形态(mPPO)存在于质体、线粒体等细胞器膜上[5]。研究表明,PPO在大多数水果中主要以膜结合态存在,如苹果中sPPO只占8%~15%[6]。但是有研究发现,sPPO在褐变过程中起主要作用,通常情况下,细胞内mPPO活性较低,在外界环境或人为处理下,可激发其活性,如利用非热加工技术,在某一范围压力作用下,导致细胞膜被损坏或膜的通透性发生改变,使细胞内部的PPO泄露出来,或者使被束缚在细胞碎片上的酶释放出来,使PPO酶活提高[7],表明mPPO与sPPO在酶促褐变机理研究中的同等重要性。由于mPPO的存在,使PPO结构、性质、褐变机理的问题研究起来十分复杂。
现阶段国内外关于sPPO的提取分离报道较多,而关于mPPO的研究报道较少。PPO的提取方法主要有丙酮提取、丙酮粉提取、超声波辅助浸提、超高压提取、缓冲溶液浸提等[8],这些方法提取出的主要是sPPO,而mPPO与植物细胞结合更加紧密,所以提取方法不同于sPPO。李晓丽等[9]对比了丙酮提取法、超声波辅助浸提法和缓冲溶液浸提法对无核白葡萄PPO的提取效果,发现缓冲溶液提取法的效果最佳。刘芳[10]对富士苹果sPPO和mPPO特性进行对比,采用磷酸氢二钠-柠檬酸缓冲溶提取sPPO,采用Tris-HCl缓冲溶液提取mPPO,对比发现mPPO活性是sPPO的34.12倍。缓冲液浸提法是一种液-固萃取方法,因此缓冲液对提取效果影响很大[11]。常用的缓冲溶液以磷酸盐为基底,采用聚乙烯吡咯烷酮(PVP)结合吐温-80(Tween-80)、聚乙二醇辛基苯基醚(TritonX-100)、抗坏血酸(VC)中的一种或几种配制而成[12-13]。由于mPPO和sPPO性质的差异,提取方法会直接影响到提取效果,且将马铃薯sPPO和mPPO区分提取的研究报道极少。
因此,本实验通过缓冲溶液浸提法对sPPO进行提取,通过超声波辅助缓冲溶液提取法对mPPO进行提取,并通过响应面法对两种PPO的提取工艺进行优化,为有效解决马铃薯加工过程中的酶促褐变提供理论基础和数据支撑。
1 材料与方法
1.1 材料与仪器
大西洋马铃薯(SolanumtuberosumL.) 由贵州省马铃薯研究所提供;牛血清蛋白(BSA)标准品(≥98%) 北京索莱宝科技有限公司;磷酸氢二钠、三羟甲基氨基甲烷(Tris)、盐酸、聚乙烯吡咯烷酮(PVP)、聚乙二醇辛基苯基醚(Triton X-100)、考马斯亮兰G-250、邻苯二酚等均为分析纯 国药集团化学试剂有限公司。
UV-2102C型紫外可见分光光度计 尤尼科上海仪器有限公司;G-040s型超声波清洗机 深圳市歌能清洗设备有限公司;CR21G III型高速冷冻离心机 日本日立公司;HHS型数显恒温水浴锅 上海博迅实业有限公司医疗设备厂。
1.2 可溶态多酚氧化酶(sPPO)提取实验
1.2.1 提取工艺 取新鲜马铃薯20 g,依次加入3 g PVP、预冷的柠檬酸-磷酸盐缓冲液(0.1 mol/L),冰浴研磨均匀,置于4 ℃冰箱中浸提。浸提液于4 ℃、12000 r/min离心30 min后,取上清液,得sPPO粗酶液。
1.2.2 sPPO提取的单因素实验 基于sPPO提取方法,设定提取的单因素实验条件为:固定浸提时间为6 h,缓冲液pH为7.0,料液比分别(质量体积比,w/v)为1∶1、1∶2、1∶3、1∶4、1∶5、1∶6;固定料液比为1∶4,缓冲液pH为7.0,浸提时间分别为2、4、6、8、10、12、14、16、18 h;固定料液比为1∶4,浸提时间为6 h,缓冲液pH分别为4.0、5.0、6.0、7.0、8.0、9.0。考察料液比、浸提时间、缓冲液pH对sPPO提取效果的影响。
1.2.3 sPPO提取的响应面优化试验 在单因素实验的基础上,对sPPO比活力有影响的三个因素料液比、浸提时间、缓冲液pH进行响应面优化试验,优化sPPO的提取工艺。

表1 Box-Behnken中心组合设计因素水平
1.3 膜结合态多酚氧化酶(mPPO)提取实验
1.3.1 提取工艺 在sPPO提取后的残渣中加入Tris-HCl缓冲液和0.25% Triton X-100,匀浆后在4 ℃冰箱中静置4 h。在功率80 W、温度4 ℃条件下超声提取,然后4 ℃下11000 r/min离心15 min。在4 ℃冰箱中静置30 min,然后35 ℃水浴保温15 min。25 ℃下11000 r/min离心15 min,取上清液,得mPPO粗酶液。
1.3.2 mPPO提取的单因素实验 基于mPPO提取方法,设定提取的单因素实验条件为:固定超声提取时间为5 h,缓冲液pH为6.0,料液比(质量体积比,w/v)分别为1∶1、1∶2、1∶3、1∶4、1∶5、1∶6;固定料液比为1∶4,缓冲液pH为6.0,超声提取时间分别为1、2、3、4、5、6、7、8 h,超声提取过程中实时监测水浴温度,通过不断添加冰水的方式控制水浴温度在4±0.5 ℃;固定料液比为1∶4,超声提取时间为5 h,Tris-HCl缓冲液pH分别为4.0、5.0、6.0、7.0、8.0、9.0。考察料液比、超声时间、缓冲液pH对mPPO提取的影响。
1.3.3 mPPO提取的响应面优化试验 在单因素实验的基础上,对mPPO比活力有影响的三个因素料液比、超声时间、缓冲液pH进行响应面优化试验,优化mPPO的提取工艺。

表2 Box-Behnken中心组合设计因素水平
1.4 多酚氧化酶活力与比活力测定
取0.05 mol/L磷酸盐缓冲溶液(pH6.5)2.5 mL于1 cm比色皿中,加入0.1 mol/L邻苯二酚溶液0.2 mL,PPO粗酶液0.3 mL,混匀后在416 nm处比色,酶液加入后开始记时,每40 s记录1次OD随时间的变化值,以最初直线段的斜率(ΔOD/t)计算酶活力。一个酶活力单位定义为:在测定条件下,每分钟催化1 μmol/L邻苯二酚为醌所需要的酶量定义为1个酶活力单位。产物的摩尔吸光系数按ε=3700 L·mol-1·cm-1计算[10,14]。按公式(1)计算粗酶液PPO活力:
式(1)
其中:M代表酶活力(U/mL);N代表酶液稀释倍数;V总代表PPO酶活测定反应体系的终体积(mL);V酶代表反应添加的酶液体积(mL);ΔOD416代表t时间内反应液在416 nm处吸光度的增加值;ε代表416 nm处邻苯二酚转化为邻苯二醌的摩尔吸光系数(L/mol·cm);t代表反应时间(min);L代表比色皿的直径(cm)。
提取出的sPPO和mPPO粗酶液中酶蛋白浓度不同,酶活性差别受样品酶蛋白浓度影响较大,所以采用酶比活力表示样品间酶活性差别。酶比活力为每毫克蛋白质所具有的酶活力数,按公式(2)计算粗酶液PPO比活力:
式(2)
其中:H代表酶比活力(U/mg);M代表酶活力(U/mL);C代表酶蛋白浓度(mg/mL)。
1.5 PPO粗酶液中蛋白浓度测定
参照Bradford[15]的方法测定粗酶液蛋白浓度。取不同浓度牛血清蛋白标准溶液2 mL,加入10 mL考马斯亮蓝G-250溶液,摇匀后室温放置5 min,以空白溶液作为对照,用1 cm比色皿在595 nm处测定吸光值。以酶蛋白溶液浓度为横坐标X,吸光值为纵坐标Y,绘制标准曲线为:Y=1.8385X+0.1611,R2=0.9990。样品测定按照上述步骤操作,平行测定3次,取平均值。
1.6 数据处理
采用Origin(Version 8.6)作图,Design-Expert(Version 8.0)进行响应面分析,SPSS(Version 17.0)进行统计学分析,P<0.05认为有统计学显著性差异,P<0.01认为有统计学极显著性差异。
2 结果与分析
2.1 sPPO提取的单因素实验结果
由图1A可知,随着料液比比例增加,sPPO的比活力显著升高(P<0.05),当料液比达到1∶3时,sPPO比活力达到最大值,继续增加料液比,会使sPPO比活力缓慢降低。原因可能是料液比过低,使马铃薯中sPPO无法充分溶出,提取不充分,导致sPPO比活力会随着料液比增加而升高,但当料液比比例过高后,sPPO酶溶解量不再增加,提取液被稀释,会对比活力造成一定的影响[16]。由图1B可知,浸提时间会显著影响sPPO的比活力(P<0.05),当浸提时间达到12 h,sPPO的比活力达到最大值,之后随着浸提时间增加基本保持恒定。不同于李晓丽等[9]的报道,浸提时间的延长,酶蛋白在溶液中构象不稳定会导致无核白葡萄中PPO活力降低,马铃薯PPO性质相对稳定。由图1C可知,缓冲液pH在7.0时sPPO比活力达到最大值,过高或过低的缓冲液pH均使sPPO比活力显著降低(P<0.05)。可能原因如下:sPPO的辅基是铜离子,铜离子在酸性条件下会被解离出来,从而使酶失去活性,而铜离子在碱性条件下会转化为氢氧化铜沉淀,脱离酶蛋白,使酶失去活性;反应体系的pH影响底物,从而减弱催化反应效率[17]。
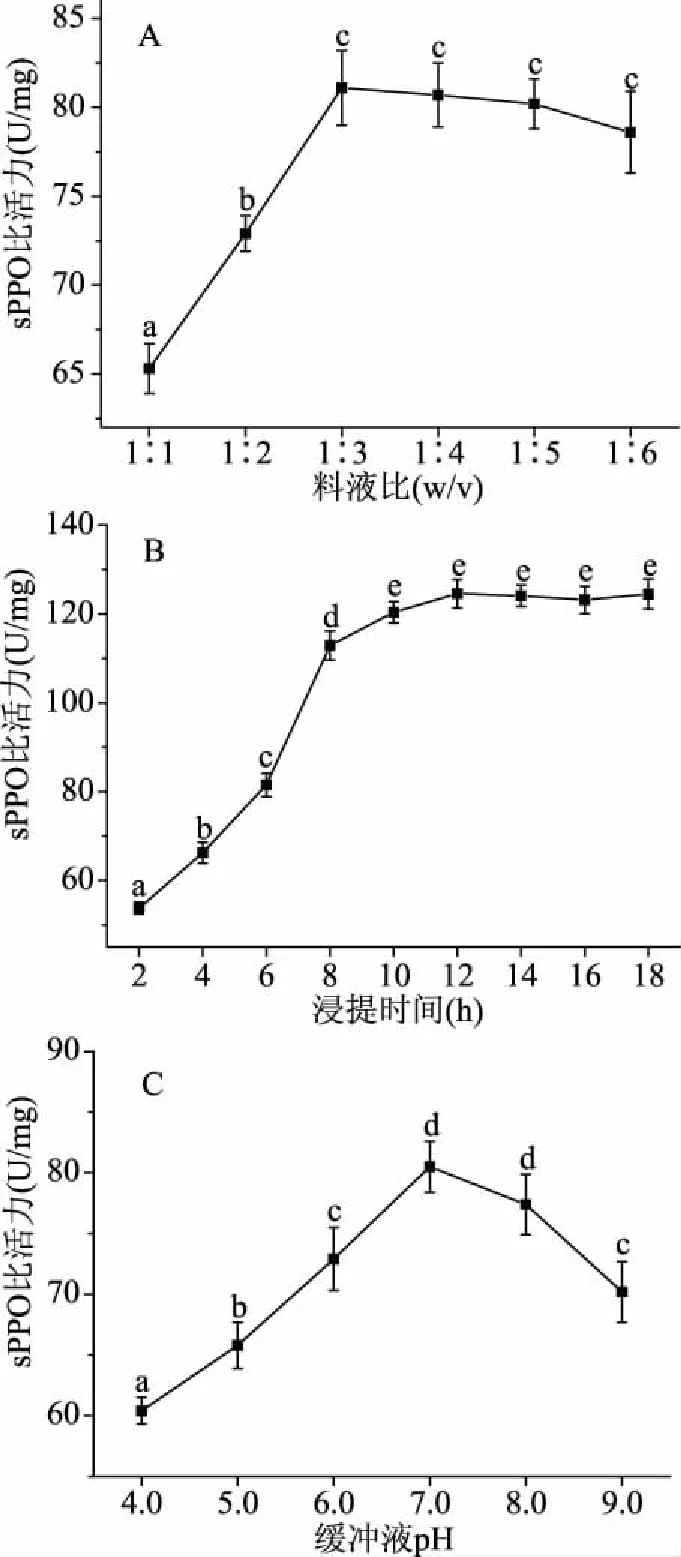
图1 料液比(A)、浸提时间(B)、缓冲液pH(C)对sPPO比活力的影响
2.2 sPPO提取的响应面优化试验结果
2.2.1 Box-Behnken设计与结果 根据单因素实验结果,以Box-Behnken中心组合设计原则,选取料液比(A)、浸提时间(B)、缓冲液pH(C)为自变量,以sPPO比活力为响应值,设计三因素三水平响应面试验对sPPO提取工艺进行优化,实验方案及实验结果如表3所示。
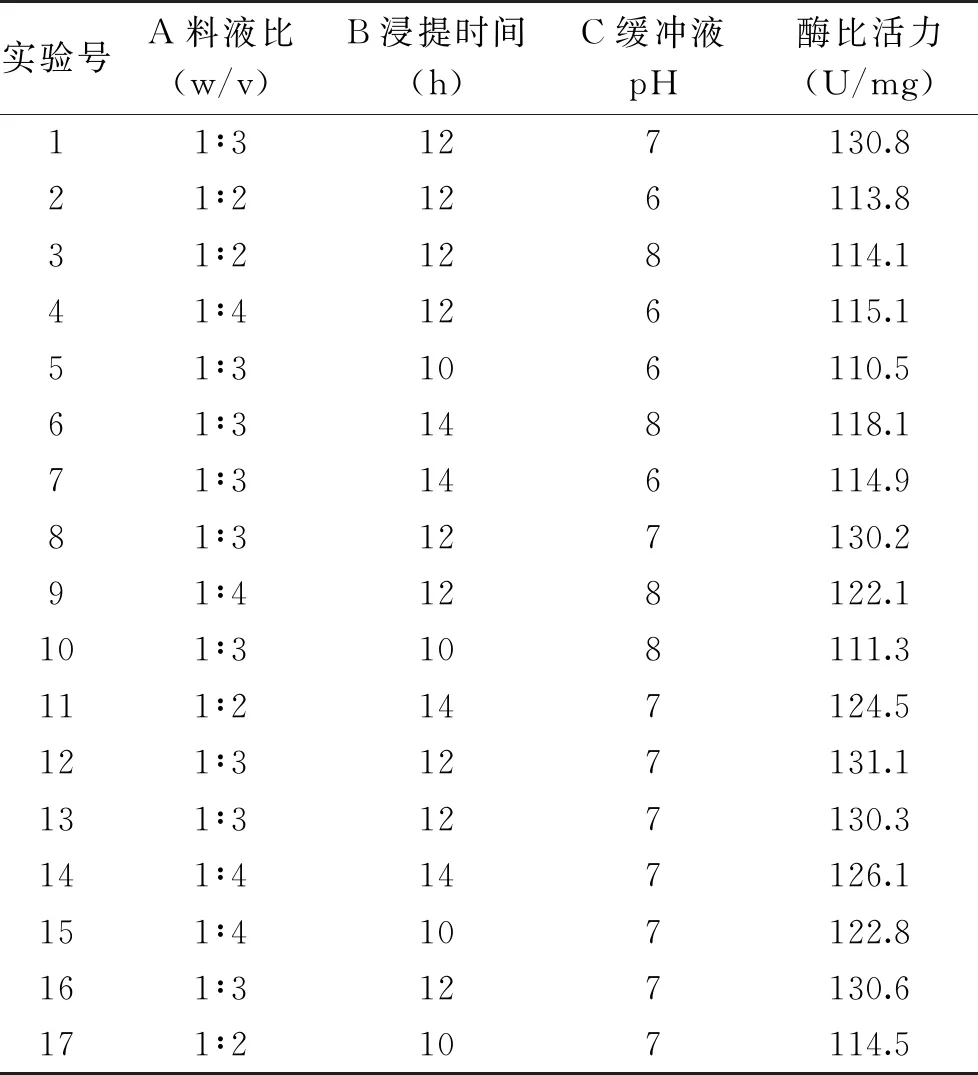
表3 响应面优化实验方案及实验结果
2.2.2 回归方程与显著性分析 将表3的实验数据,利用Design-Expert 8.0软件进行二次多项式逐步回归拟合,得回归模型方程为:
Y=130.60+2.40A+3.06B+1.41C-1.68AB+1.68AC+0.60BC-3.03A2-5.60B2-11.30C2
模型的可靠性可以从方差分析及相关系数来考察,结果见表4。
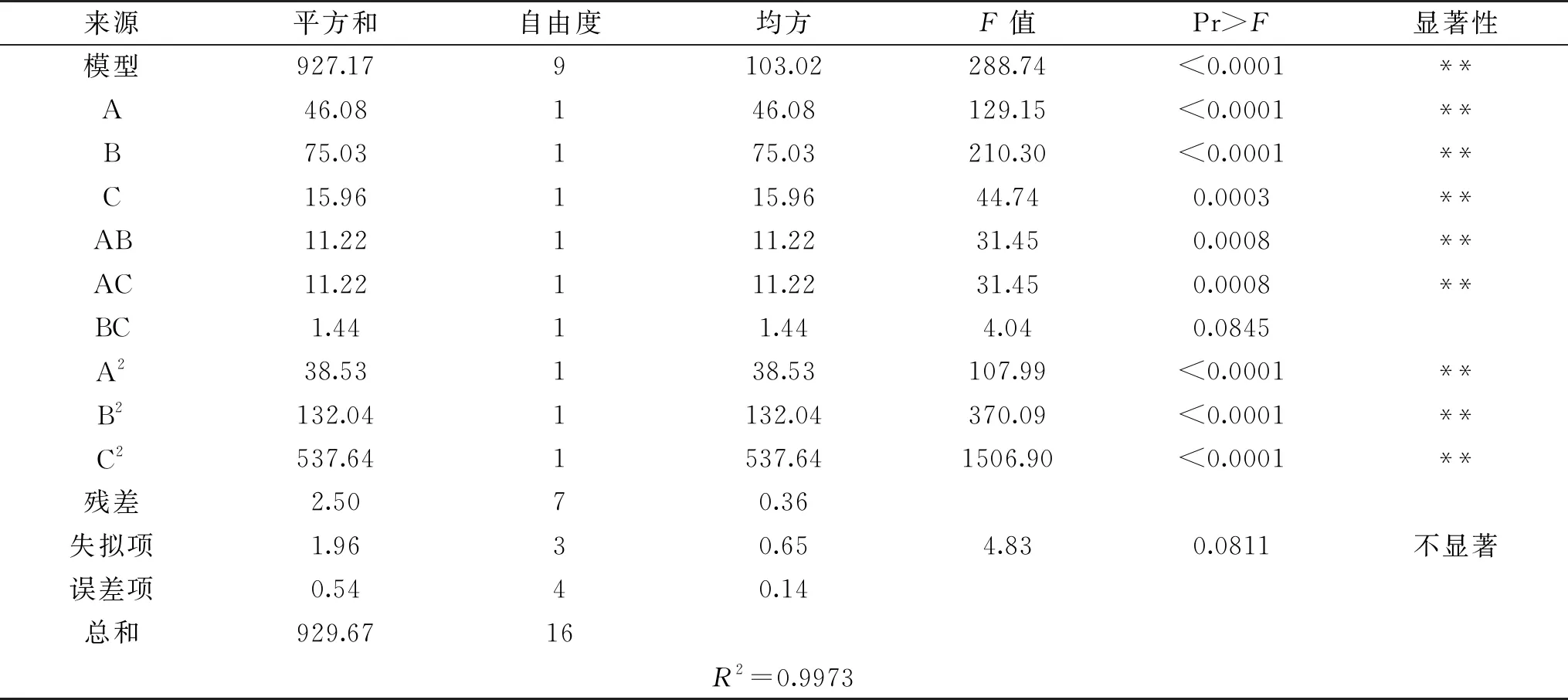
表4 回归模型方差分析
由表4可知,模型F=288.74,所得sPPO提取条件的回归方程极显著(P<0.0001);F失拟=4.83,失拟项不显著(P>0.05),从而该模型可以对sPPO提取工艺条件进行准确的预测和分析。R2=99.73%,说明sPPO比活力的变化有99.73%来源于料液比、浸提时间和缓冲液pH的影响。方差分析结果表明:一次项和二次项都有显著性因素,其中A、B、C、AB、AC、A2、B2、C2对响应值均有极显著性影响(P<0.01),三个因素对sPPO提取的影响大小依次为:浸提时间(B)>料液比(A)>缓冲液pH(C)。
2.2.3 响应面分析 图2表示料液比分别与浸提时间和缓冲液pH的交互作用对sPPO比活力的影响。由图2可知,固定浸提时间,随着料液比升高sPPO比活力均呈先升高后降低趋势;固定料液比,sPPO比活力均随缓冲液pH的升高呈现先升高后降低趋势,与单因素实验结果变化趋势一致。由方差分析可知,不同因素交互作用对sPPO比活力影响显著,与其相对应的等高线形状为椭圆形,表明料液比和浸提时间、料液比和缓冲溶液pH的交互作用对响应值的影响显著。
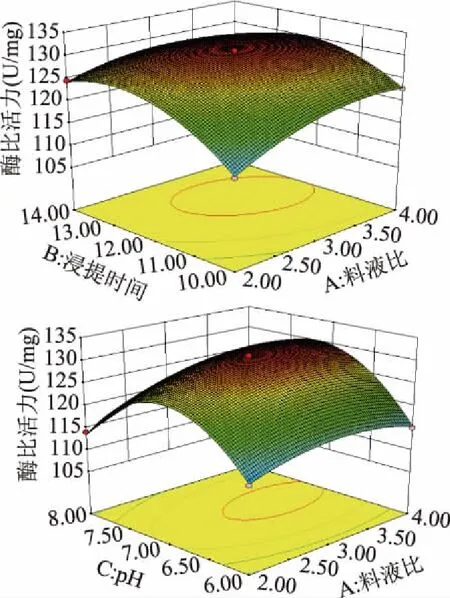
图2 料液比、浸提时间和缓冲液pH的交互作用
根据回归模拟方程,得到最优sPPO提取工艺条件为:料液比为1∶3.16,浸提时间12.31 h,缓冲液pH为7.07。在此条件下sPPO比活力的预测值为131.3 U/mg,考虑到实际操作的可行性,将最优提取工艺修正为:料液比为1∶3.2,浸提时间12 h,缓冲液pH为7.1,在该条件下测定sPPO比活力平均值达(130.5±2.4) U/mg,与预测值基本一致。因此该模型可以很好的反映最优的sPPO提取工艺条件。
2.3 mPPO提取的单因素实验结果
由图3A可知,随着料液比比例增加,mPPO的比活力显著升高(P<0.05),当料液比达到1∶5时,mPPO比活力达到最大值,随后mPPO比活力缓慢降低。由图3B可知,当浸提时间达到6 h,mPPO的比活力达到最大值,之后随着浸提时间增加基本保持恒定。由图3C可知,缓冲液pH在7.0时mPPO比活力达到最大值,过高或过低的缓冲液pH均使mPPO比活力显著降低(P<0.05)。料液比、超声时间和缓冲液pH对mPPO比活力的影响趋势与sPPO相同,但是mPPO比活力显著高于sPPO比活力,mPPO很容易被激活,且mPPO被激活后性质比sPPO活跃,是导致马铃薯加工过程中褐变的主要影响因素[18]。
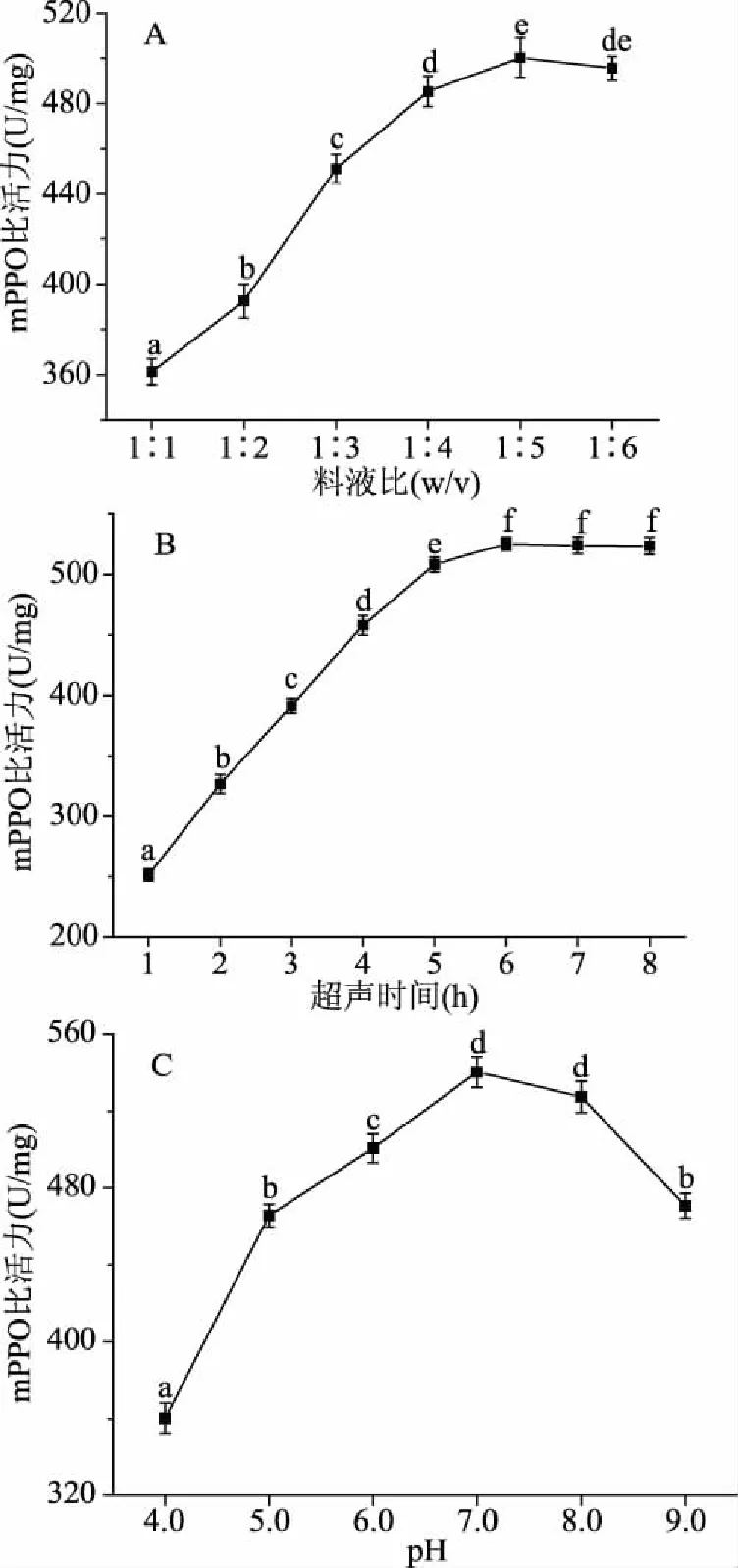
图3 料液比(A)、超声时间(B)、缓冲液pH(C)对mPPO比活力的影响
2.4 mPPO提取的响应面优化实验结果
2.4.1 Box-Behnken设计与结果 根据单因素实验结果,以Box-Behnken中心组合设计原则,选取料液比(A)、超声时间(B)、缓冲液pH(C)为自变量,以mPPO比活力为响应值,设计三因素三水平响应面试验对mPPO提取工艺进行优化,实验方案及实验结果如表5所示。
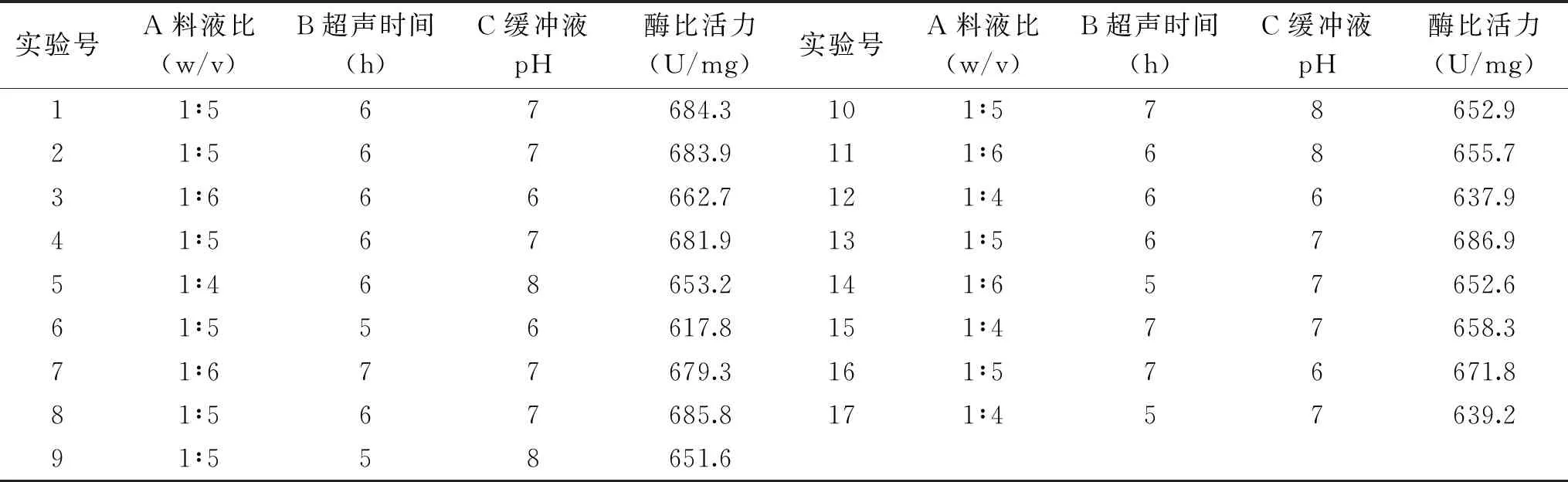
表5 响应面优化试验方案及实验结果 Table 5 Experimental scheme and results of response surface optimization
2.4.2 回归方程与显著性分析 将表5的实验数据,利用Design-Expert 8.0软件进行二次多项式逐步回归拟合,得回归模型方程为:
Y=684.56+7.71A+12.64B+2.90C+1.90AB-5.58AC-13.18BC-11.68A2-15.53B2-20.50C2
模型的可靠性可以从方差分析及相关系数来考察,结果见表6。
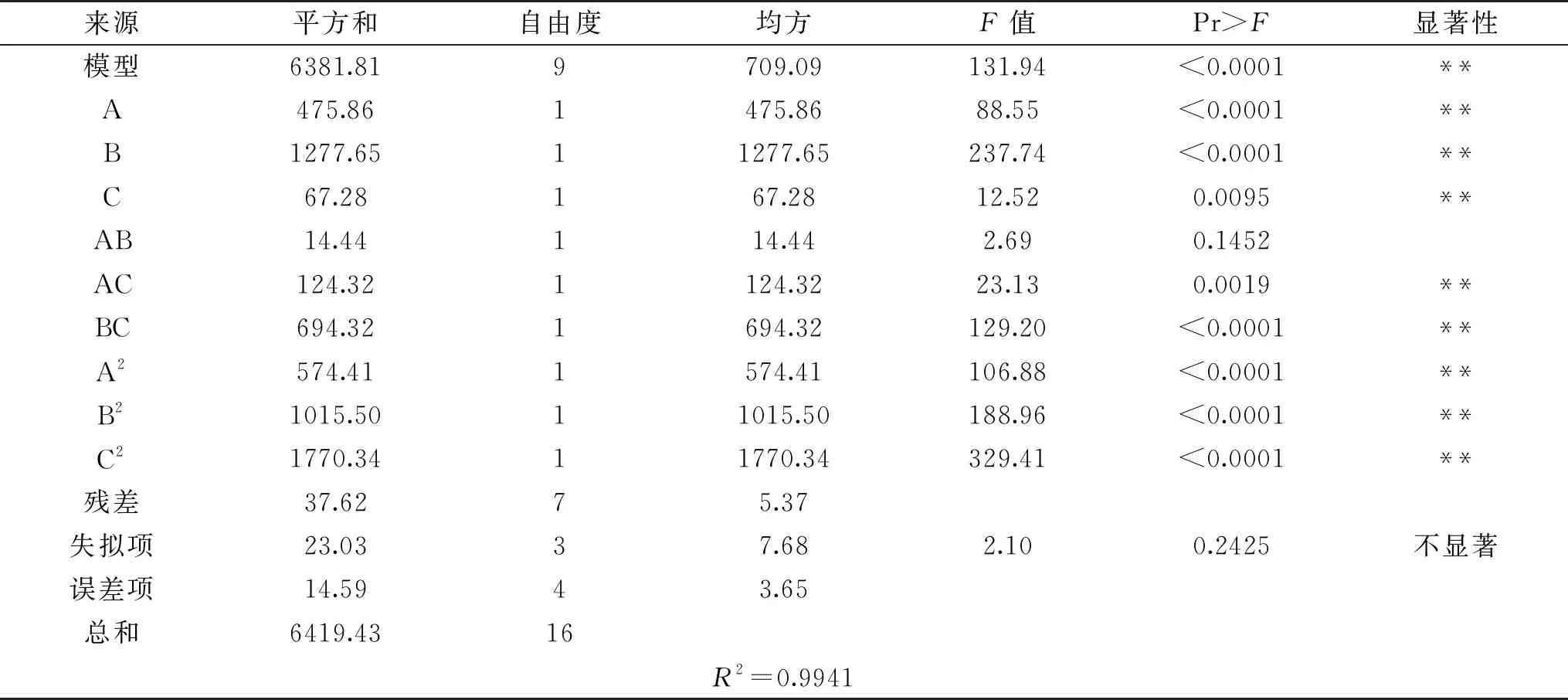
表6 回归模型方差分析
由表6可知,模型F=131.94,所得mPPO提取条件的回归方程极显著(P<0.0001);F失拟=2.10,失拟项不显著(P>0.05),从而该模型可以对mPPO提取工艺条件进行准确的预测和分析。R2=99.41%,说明mPPO比活力的变化有99.41%来源于料液比、超声时间和缓冲液pH的影响。方差分析结果表明:一次项和二次项都有显著性因素,其中A、B、C、AC、BC、A2、B2、C2均显著,各因素对mPPO比活力具有交互影响的非线性关系,三个因素对mPPO提取的影响大小依次为:超声时间(B)>料液比(A)>缓冲液pH(C)。
2.4.3 响应面分析 图4表示缓冲液pH分别与超声时间和料液比对mPPO比活力的交互影响。由图4可知,无论缓冲液pH处于何种水平,mPPO比活力随着料液比升高均呈先升高后基本维持稳定,随超声时间的增加呈现先升高后保持恒定的趋势,与单因素实验结果变化趋势一致。由方差分析可知,不同因素交互作用对mPPO比活力影响显著,与其相对应的等高线形状为椭圆形,表明缓冲溶液pH和超声时间、缓冲溶液pH和料液比交互作用显著。
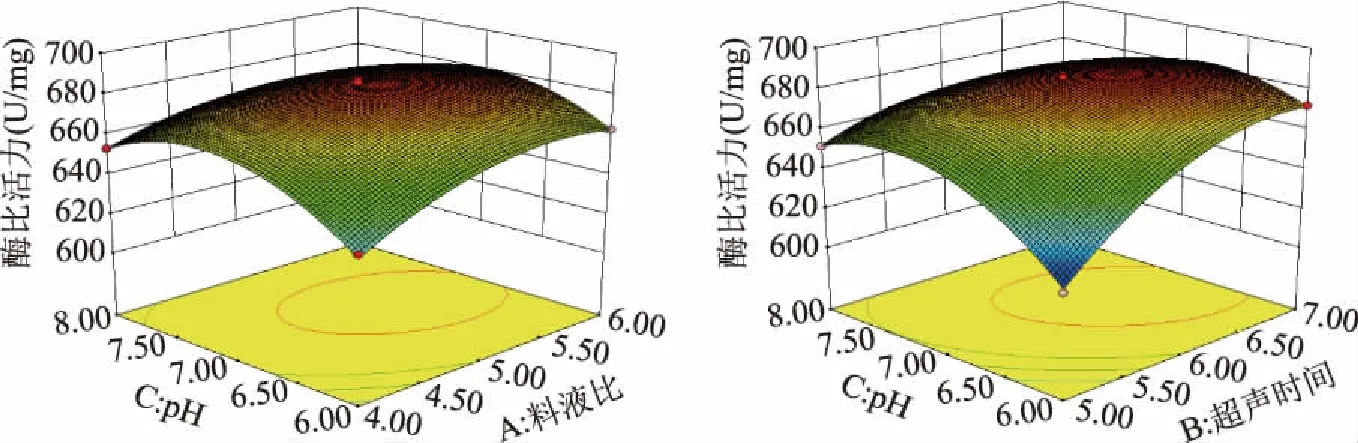
图4 料液比、超声时间和缓冲液pH的交互作用
根据回归模拟方程,得到最优mPPO提取工艺条件为:料液比为1∶5.20,超声时间6.64 h,缓冲液pH为6.71。在此条件下mPPO比活力的预测值为687.7 U/mg,考虑到实际操作的可行性,将最优提取工艺修正为:料液比为1∶5.2,浸提时间7 h,缓冲液pH为6.7,在该条件下测定mPPO比活力平均值达(686.4±7.9) U/mg,与预测值基本一致。因此该模型可以很好的反映最优的mPPO提取工艺条件。
3 结论
本实验以大西洋马铃薯为原料,通过超声波辅助-缓冲溶液浸提法提取马铃薯中sPPO和mPPO,并通过响应面法对提取过程中料液比、提取时间、缓冲液pH等因素进行优化,以酶比活力为评价指标,确定最优的sPPO和mPPO提取工艺。优化后的sPPO提取工艺为:料液比为1∶3.2,浸提时间12 h,缓冲液pH为7.1,在该条件下测定sPPO比活力平均值达(130.5±2.4) U/mg,三个因素对sPPO提取的影响大小依次为:浸提时间>料液比>缓冲液pH。优化后的mPPO提取工艺为:料液比为1∶5.2,浸提时间7 h,缓冲液pH为6.7,在该条件下测定mPPO比活力平均值达(686.4±7.9) U/mg,三个因素对mPPO提取的影响大小依次为:超声时间>料液比>缓冲液pH。通过实验所得响应面模型可以对sPPO和mPPO提取工艺进行准确的预测和分析。
