大囊型涎腺分泌性癌1例并文献复习
2020-12-09谢乐斯韩志江王炜周虹项晶晶
谢乐斯 韩志江 王炜 周虹 项晶晶
涎腺分泌性癌(secretory carcinoma of salivary gland,SCSG)是一类少见的涎腺低度恶性肿瘤,目前全球仅报道数百例,国内仅有数篇个案或小宗病例报道。大囊型SCSG在临床上更加罕见[1],国内亦极少报道。笔者发现1例大囊型SCSG,其病理形态特征不典型,临床和病理诊断难度较大,经检测ETV6基因重排确诊,现报道如下。
患者男,27岁。因“发现右侧腮腺区无痛性肿物6月余”于2016年10月6日入本院。专科检查:患者右侧面部肿胀,无畸形缺损,开口度、开口型正常,无闭眼鼓气障碍,额纹存在。右侧腮腺区可扪及一大小约2.5 cm×2.5 cm×1.0 cm肿块,表面光滑,质地较硬,边界清,与周缘组织无粘连,活动度可,无触痛、麻木或红肿,表面皮肤无破溃,腮腺导管口无红肿,唾液分泌清亮。MRI显示右侧腮腺上极区域囊性肿物(图1)。于全麻下行右侧腮腺浅叶切除术。
病理检查大体检查:涎腺组织一块,大小4 cm×2 cm×0.6 cm,切面灰黄,分叶状,质地软,未见明显肿块或结节,局灶见囊壁样组织,未见内容物,壁厚0.1~0.2 cm,此区域全部取材。涎腺组织旁触及6枚淋巴结,全取材。

图1 腮腺MRI平扫+增强所见(a:T1W1平扫序列显示右侧腮腺上极椭圆形囊性灶,大小约1.5 cm×2.3 cm,边界清晰,囊壁呈高信号,内部呈稍高信号;b:T1W1增强序列显示囊壁前后缘轻-中度强化,上下缘强化不明显,囊内部无强化)
镜下检查:HE染色切片见厚的纤维囊壁组织,囊壁外侧有正常涎腺组织。囊内壁未见完整的内衬上皮,见少量松散的细胞团附于囊内壁。纤维囊壁组织内散在不规则上皮细胞团巢,少数细胞巢内形成腺管或筛孔,在少数腺样腔隙内可见强嗜酸性分泌物聚集。瘤细胞中等大小,圆形,异型性不明显,细胞核圆形或椭圆形,染色质细,有小而清楚的中位核仁,胞质空淡或粉染颗粒状,部分细胞胞质内有圆形空泡(图2a-d)。未见核分裂象或肿瘤性坏死,未见囊壁外侵犯,未见神经周或脉管侵犯。囊壁组织内有散在陷入的正常涎腺腺泡和导管,伴随灶性淋巴细胞浸润及陈旧性出血。6枚区域淋巴结均未见肿瘤转移。
免疫组化检查:结果显示瘤细胞广谱细胞角蛋白(CK)、S-100蛋白和乳腺球蛋白弥漫强阳性,GATA结合蛋白 3(GATA3)弥漫弱阳性,部分细胞a1-抗胰蛋白酶阳性,肿瘤细胞巢周边细胞p63阳性,但DOG1、癌胚抗原、雌激素受体或CD117均为阴性。Ki-67增殖指数为5%~10%(图2e-g)。
分子检测:使用ETV6基因断裂探针,采用荧光原位杂交法(flourescence in situ hybdridization,FISH)检测 ETV6基因状态,计数200个肿瘤细胞核,>40%肿瘤细胞核内出现红绿分离信号,提示ETV6基因重排阳性(图2h)。
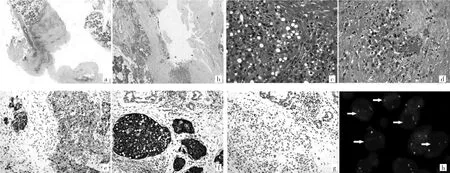
图2 肿瘤组织HE染色、免疫组化及分子检测结果(a:病变为厚薄不一的囊壁组织,无明显内衬上皮;HE染色,×10;b:囊壁为纤维组织,内见散在肿瘤细胞巢团,囊壁外见正常涎腺组织;HE染色,×40;c:瘤细胞为圆形、多边形,胞质嗜酸性颗粒状,部分细胞胞质内见空泡;细胞核圆形或卵圆形,居中,有小核仁;细胞比较一致,未见核分裂象;HE染色,×400;d:个别区域可见瘤细胞略呈腺样排列,细胞形态与图c相似,腔内有强嗜酸性分泌物;HE染色,×400;e:瘤细胞S-100蛋白弥漫阳性;免疫组化染色,×200;f:瘤细胞乳腺球蛋白弥漫强阳性;免疫组化染色,×200;g:瘤细胞DOG1一致阴性表达;免疫组化染色,×200;h:ETV6荧光原位杂交法检测,箭头所示细胞内可见红绿分离信号)
病理诊断:SCSG。
讨论SCSG既往被称为乳腺样分泌性癌(mammaryanaloguesecretorycarcinoma,MASC),由 Skalova 等[2]于 2010 年首次报道,2017年第4版WHO头颈部肿瘤病理学和遗传学分类将其更名为SCSG[3]。其发病年龄广泛,男女发病率差别不大,最大径可达5.5 cm,临床上主要表现为无痛性缓慢生长的肿块,最常见发病部位为腮腺,也可发生于颌下腺、口腔或其他部位小涎腺[4],新近发现在肺[5]、甲状腺[6-7]、皮肤[8-9]和鼻腔鼻窦[10-11]等部位也可发生。
组织学上,经典SCSG通常呈浸润性、分叶结节状生长,可表现为实性-微囊状、腺管状、滤泡状、囊性-乳头状、筛状等多种组织构型,微囊及腺腔内伴有显著的腔内分泌物,瘤细胞异型性低,胞质丰富嗜酸性颗粒状或空泡状,核分裂象罕见,通常无坏死,淋巴管、血管侵犯罕见。少见情况下,SCSG可以呈高级别形态或者伴有高级别转化[7,12]。罕见情况下SCSG可以完全呈囊性形态,Hernandez-Prera等[1]总结了15例此种亚型SCSG的病理特征。此型SCSG多呈非浸润性生长,仅个别病例侵犯周围涎腺组织。单囊或多囊状,囊内壁衬覆单层立方上皮或多层上皮,上皮常向囊内增生形成乳头状突起或鞋钉状生长,多囊型患者部分囊腔可无明显内衬上皮,囊腔内分泌物可有可无,瘤细胞形态与经典型类似,具有嗜酸性颗粒状胞浆及胞质内空泡。个别患者可以出现显著的淋巴组织增生或胆固醇结晶沉积。本例即呈大的单囊状生长,缺乏经典型SCSG组织构型,也缺乏已报道的大囊型SCSG中囊性-乳头状或鞋钉样生长方式,但是瘤细胞形态呈嗜酸性颗粒状并含有胞质内空泡,且部分腔内有嗜酸性分泌物,有诊断提示意义。大囊型SCSG具有与经典型相似的免疫表型,瘤细胞S-100蛋白和乳腺球蛋白弥漫强阳性,且通常不表达DOG1,p63表达于囊腔周边部基底样细胞区[1]。本例患者免疫组化表型与此报道相似。
ETV6相关融合基因是SCSG特异的分子遗传改变,目前尚未在涎腺其他肿瘤中发现有这一基因改变。最常见的是ETV6-NTRK3融合基因,新近还发现ETV6-RET[13-14]、ETV6-MET[15]、ETV6-NTRKMAML3[14]等少见融合基因,个别大囊型SCSG还存在CTNNA1-ALK融合基因[16]。采用ETV6分离探针进行FISH检测具有较高的阳性检出率,但仍有少数病例FISH检测为阴性,必要时可采用RT-PCR或二代测序等方法检测ETV6基因状态帮助确诊并明确伙伴基因或发现新的基因改变[17]。
SCSG最需要鉴别的是腺泡细胞癌,尤其是酶原颗粒缺乏型腺泡细胞癌。本例患者病理初诊考虑为腺泡细胞癌,后查阅文献并补充免疫组化和ETV6 FISH检测才修改诊断为SCSG。两者在组织构型上有相似性,尤其是酶原颗粒缺乏型腺泡细胞癌的瘤细胞与SCSG相似,容易混淆。免疫表型上,腺泡细胞癌与SCSG相反,通常不表达S-100蛋白和乳腺球蛋白,而DOG1弥漫强阳性。联合检测这3个标志物基本可以区分SCSG和腺泡细胞癌。因腺泡细胞癌不具有ETV6-NTRK3融合基因,鉴别仍然困难的病例,可以检测ETV6基因重排状态来确诊[18]。大囊型SCSG还需与主要呈囊性形态的低级别涎腺导管内癌(又名低度恶性筛状囊性癌)鉴别。两者在组织构型上非常相似,低级别涎腺导管内癌也可弥漫表达S-100蛋白和乳腺球蛋白,但其通常癌巢周围表达p63等肌上皮标记,且没有ETV6相关基因改变[19]。少见情况下,某些涎腺良性肿瘤,如Warthin瘤或嗜酸细胞腺瘤囊性变也需鉴别。Warthin瘤上皮下或多或少伴有淋巴组织增生,瘤细胞为双层,外层细胞恒定表达p63,两层细胞均不表达S-100蛋白。嗜酸细胞腺瘤不表达S-100蛋白,且无ETV6基因异常。另外,非肿瘤性囊性病变不会出现明显的腔内复杂性上皮增生,更不会有弥漫的S-100蛋白和乳腺球蛋白阳性表达,可资鉴别。
SCSG是一种低度恶性肿瘤,大约25%的患者有区域淋巴结转移,局部复发风险或远处转移风险均较低,主要的预后不良因素是高临床分期和出现高级别转化。有研究提示,具有ETV6-RET融合基因的患者可能有更侵袭性的生物学行为[12]。本例SCSG患者临床分期早,术后随访至今4年半,未见复发或转移。
虽然ETV6基因FISH检测是诊断SCSG的金标准,但实际工作中,典型形态,加上S-100蛋白和乳腺球蛋白弥漫阳性、DOG1阴性的典型免疫组化表达,大部分SCSG病例诊断没有困难,不需要进一步的分子检测来证实。但遇到本例这样完全呈囊性且组织构型不典型的病例,如对SCSG认识不足或警惕性不够,很容易造成误诊,合理的免疫组化标志物组合和ETV6基因检测,可以得到正确的诊断。
