TESTIn、PTEn蛋白在子宫内膜良、恶性病变组织中的表达及其相关性研究
2020-12-09黄丹丹
刘 妍,黄丹丹
(1.内蒙古包钢医院病理科,内蒙古 包头 014010;2.内蒙古包钢医院妇产科)
子宫内膜癌是妇科三大恶性肿瘤疾病之一,其发生、发展与绝经延迟、糖尿病、高血压、肥胖、雌激素替代治疗等诸多因素有关[1]。根据肿瘤生物学特性,可以将子宫内膜癌分为子宫内膜样癌(Ⅰ型)与非子宫内膜样癌(Ⅱ型),二者的生物学特性各异,故早期临床鉴别诊断存在难度[2]。鉴别诊断子宫内膜癌的具体分型,得到患者确切的病理特征及生物学特性,是给予患者针对性治疗的关键所在,这对增强治疗效果、改善患者预后意义重大,尤其是对于部分年纪尚轻且希望保留生育功能的女性,早期准确的鉴别诊断尤为关键[3]。目前,已有研究发现,在包括子宫内膜癌等诸多恶性肿瘤组织中均存在蛋白等表达改变[4,5]。这些基因或蛋白的分子学改变在子宫内膜癌的发生发展中起到关键作用。TESTIn基因在诸多人类恶性肿瘤中发挥抑癌功能,位于人染色体FRA7G脆性位点[6];PTEn蛋白经其分子途径,可抑制细胞周期,并抑制细胞转移及血管形成,在各中恶性肿瘤中也有特异性表达[7]。二者虽均在恶性肿瘤中有表达,但其之间是否存在某种联系,来相互影响、相互作用,参与各肿瘤疾病的发生发展,尚无定论,尤其是在子宫内膜癌中的表达,未见较多报道。本研究观察了子宫内膜癌患者组织中TESTIn、PTEn蛋白表达,分析了二者之间的相关性,旨在探讨TESTIn、PTEn蛋白与子宫内膜癌的相关性。现报告如下。
1 资料与方法
1.1 纳入对象
回顾性分析,选择医院2016-10~2019-10期间接受子宫内膜癌切除治疗并经病理组织活检证实为子宫内膜癌的患者100例作为病例组,全部患者病历资料完整,并有子宫内膜组织蜡块标本保存,患者均证实为子宫内膜癌患者;患者年龄34~60岁,平均42.12±5.51岁;体重43~71kg,平均53.12±5.21kg,包括内膜样腺癌49例、透明细胞癌7例、鳞状细胞癌25例、未分化癌9例、小细胞癌10例。纳入同期在医院经分段诊刮术刮出子宫内膜组织蜡块标本,并证实为良性病变的患者33例作为良性对照组,全部良性对照患者病历资料完整,均有标本保存。患者年龄35~61岁,平均41.96±5.47岁;体重43~70kg,平均53.24±5.19kg,包括子宫内膜炎8例、子宫内膜异位症7例、子宫内膜囊肿11例、子宫内膜增厚7例。排除合并其他恶性肿瘤疾病的患者、合并严重且无法控制的高血压或糖尿病的患者、合并其他重要脏器功能衰竭的患者。两组患者年龄、体重等一般资料比较差异无统计学意义(P>0.05),有可比性。
1.2 方法
1.2.1 一般资料采集 设计子宫内膜癌一般资料调查问卷,调查并记录纳入的100例子宫内膜癌患者一般资料,包括年龄、分期(符合国际妇产科联盟制定的子宫内膜癌分期标准)[8]:Ⅰ期、Ⅱ期、Ⅲ期;记录患者肿瘤肌层浸润深度:<1/2,1/2;记录患者淋巴结转移发生情况。
1.2.2 TESTIn、PTEn蛋白表达检测方法(1)主要实验试剂:上海基因科技有限公司提供的单克隆鼠抗人PTEn、鼠抗人TESTIn一抗、抗体稀释液、PBS缓冲液,上海化工流畅提供的琼脂糖,上海宝枫生物科技有限公司提供的DnA marker,北京天根生化科技有限公司提供的基因组DnA提取试剂盒,美国Zymo Research公司提供的DnA修饰试剂盒,大连Takara公司提供的10×360PCR Mix,美国Ivitrogen生命科技公司提供的Trizol,福建省福州迈新生物技术开发有限公司提供的免疫组化试剂盒、免疫组化显色试剂盒及中性树胶,上海第一化工厂提供的苏木素;(2)主要实验仪器:德国EPPEnDORF公司提供的室温离心机、高速离心机、微量移液器,美国ABI公司提供的HT-7500型PCR仪,德国LEICA公司提供的荧光倒置显微镜、石蜡切片机,北京六一电器厂提供的振荡器,美国BIO-RAD公司提供的电泳仪;(3)主要检查方法:①制作石蜡切片:全部标本均使用10%福尔马林液体固定,24h后冲洗,脱水-透明-浸蜡-修块-切片,连续切片,取无皱痕、完整组织行常规HE染色,染色后中性树胶封片,经免疫组化染色测定各蛋白相对表达量;②组织切片脱蜡与水化、PBS冲洗、抗原修复、取出切片、PBS冲洗、滴加抗体过夜后常温放置30min,后使用PBS冲洗,将切片取出之后擦干组织周围的液体,滴加二抗之后孵育,PBS冲洗,工作液制备后切片,将切片置于显微镜下观察染色情况,判断其阳性表达情况;(4)判读染色结果:不同的抗体细胞其定位不同,观察胞质与(或)核膜内有棕黄色颗粒或橘黄色颗粒出现则判定为阳性,细胞阳性颗粒结构清晰、定位好,且着色与背景对比清楚则定义为阳性;反之若背景与显色强度无差别则判定为阴性。
1.3 统计学方法
应用SPSS20.0统计学软件处理数据,全部数据均经正态分布检验,符合正态分布,以表示计量资料,组间比较采用独立样本t检验;以百分比表示计数资料,用χ2检验,等级相关采用Spearman相关性检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 TESTIn、PTEn蛋白在子宫内膜组织中的表达
TESTIn、PTEn蛋白在子宫内膜癌组织中阳性表达减弱(见图1,2);在子宫内膜良性病变组织中呈强阳性表达,在子宫内膜良性病变中几乎无表达(见图3,4)。
2.2 TESTIn、PTEn蛋白在良、恶性子宫内膜组织中阳性检出率的比较
较良性对照组,病例组子宫内膜组织中检出的TESTIn、PTEn蛋白阳性率低,组间比较差异有统计学意义(P<0.05)(见表1)。
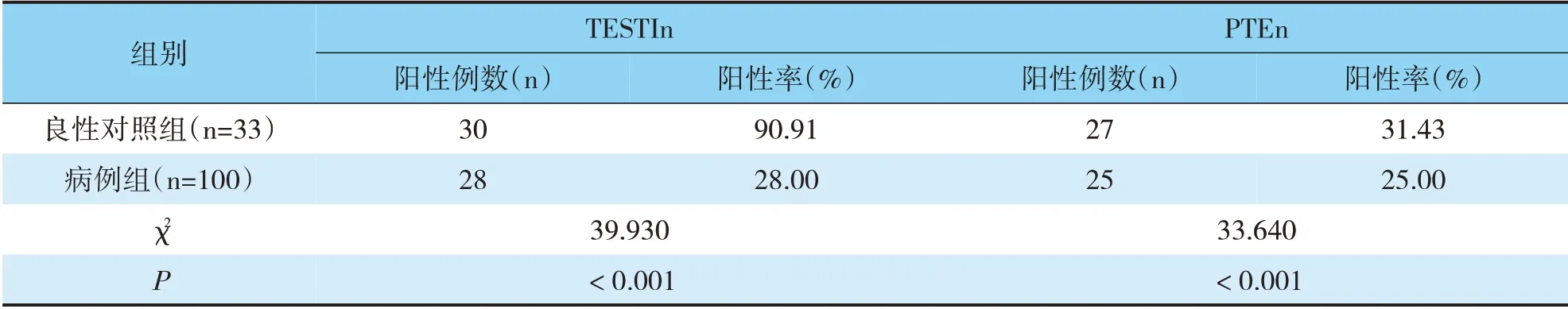
表1 TESTIn、PTEn蛋白在良、恶性子宫内膜组织中阳性检出率的比较
2.3 子宫内膜组织中TESTIn、PTEn蛋白表达的相关性
经等级Spearman相关性检验结果显示,子宫内膜组织中TESTIn、PTEn蛋白间呈正相关(r=0.867,P<0.001)。
2.4 子宫内膜癌组织不同临床病理特征
TESTIn、PTEn蛋白阳性检出率比较不同年龄段子宫内膜癌组织TESTIn、PTEn蛋白阳性检出率比较差异无统计学意义(P>0.05);高临床分期、肌层浸润严重、有淋巴结转移者阳性检出率较其他患者更低,不同病理类型患者阳性检出率的差异也有统计学意义(P<0.05)(见表2,3)。
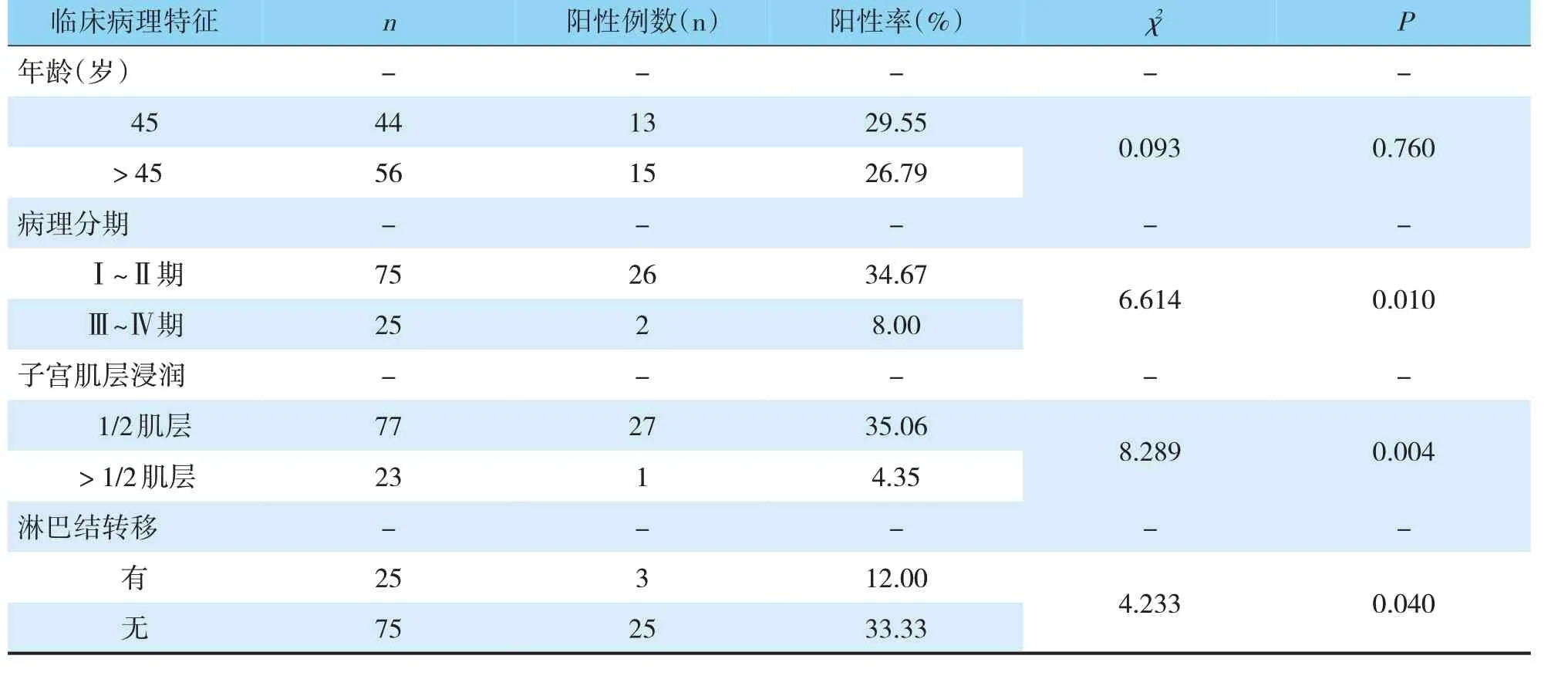
表2 子宫内膜癌组织不同临床病理特征TESTIn蛋白阳性检出率比较
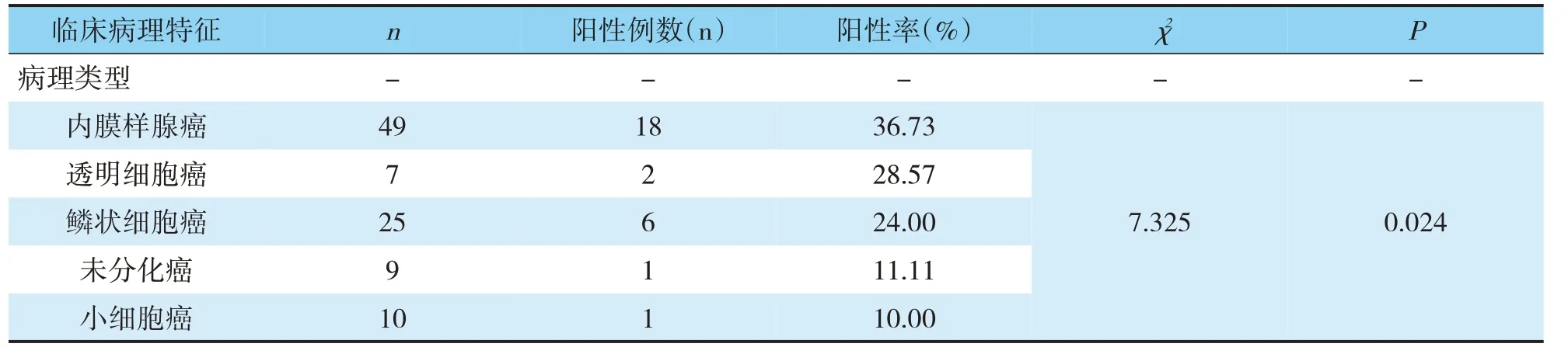
χ2 -P-n-4临床病理特征病理类型内膜样腺癌透明细胞癌鳞状细胞癌未分化癌小细胞癌9 7 2阳性例数(n)-18 7.325 0.024 5 9 10 2 6 1 1阳性率(%)-36.73 28.57 24.00 11.11 10.00
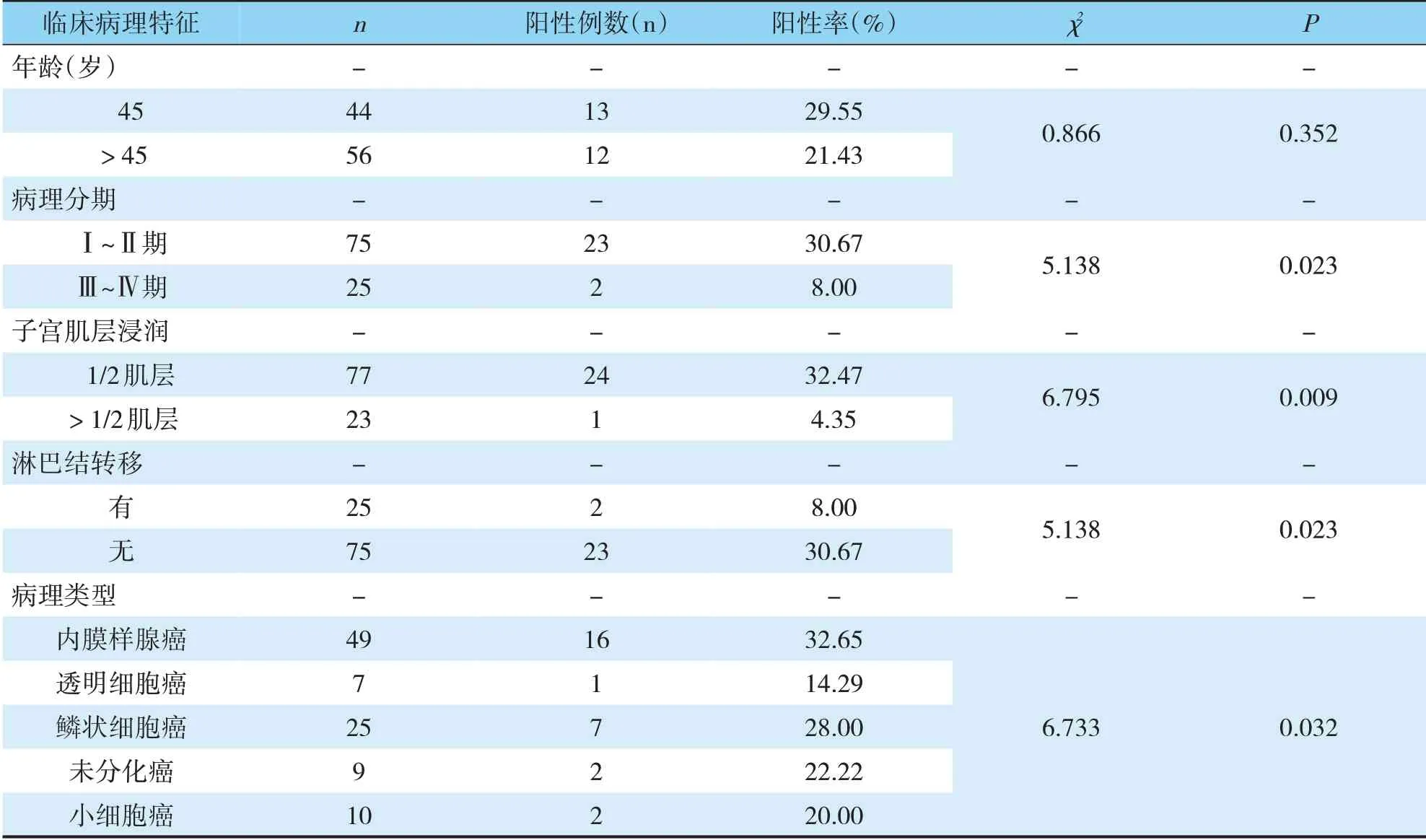
表3 子宫内膜癌组织不同临床病理特征PTEn蛋白阳性检出率比较(n,%)
3 讨论
目前,对于子宫内膜癌的分子遗传机制已有较多研究报道,结果均表明了不同分型子宫内膜有其独特的分子变化,可见不同分型子宫内膜癌的发生与发展遵循不同路径[9]。正常情况下,子宫内膜细胞经β-catenin、PTEn、TSETIn等基因突变与微卫星不稳定性等改变来介导子宫内膜癌的发生,且多为子宫内膜样子宫内膜癌[10]。可见基因突变在子宫内膜癌发生发展中的关键作用。
子宫内膜在发生癌变的一系列过程中,伴随着各类癌基因与抑癌基因的不断变化,已有研究发现,子宫内膜癌的进展与直肠癌的进展模式类似,且前者存在更为复杂的基因改变[11]。研究发现,随着子宫内膜癌组织学分级升高,其遗传学改变也越明显,基因突变情况也越多[12]。早年对子宫内膜组织进行的相关研究中已经发现,在子宫内膜非典型增生组织中,存在PTEn、TESTIn等基因突变情况,且有接近50%的组织出现PTEn、TESTIn基因失活,即表达缺失,这种表达缺失情况在疾病发展至子宫内膜癌后更为常见[13,14]。PTEn、TESTIn等基因突变在子宫内膜早期阶段便有发生,尤其是部分伴单克隆性增生的内膜组织,这种基因的突变情况更为明显。但Lax等[15]在2004年的研究中指出,正常子宫内膜组织中也发现轻微的PTEn、TESTIn基因失活。然而这种失活的意义尚不清楚,仍需进一步探究。
PTEn、TESTIn二者均是抑癌基因,前者定位在10q23,主要构成包括8个内含子与9个外显子,编码mRnA长度为5.5kb,由403个氨基酸组成该基因的编码蛋白质,具有蛋白磷酸酶与脂质磷酸酶的活性;PTEn的晶体结构由2个主要功能区构成,同时还有其他3个结构区,这些结构区构成的催化单元,是抑制肿瘤活性、维持结构稳定性的关键。在非活性的状态下,PTEn C末端的苏氨酸、丝氨酸残基均处于磷酸化的状态,该基因功能活性区保持关闭以稳定PTEn蛋白活性,一旦PTEn激活,将导致苏氨酸、丝氨酸残基脱磷酸化,PTEn磷酸化功能域暴露,对应的生物活性增加,使得PTEn蛋白更容易被泛素所介导的相关蛋白酶体所降解。上述机制被称作负反馈调节机制,这种负反馈调节将在缺乏刺激的前提下削弱PTEn效能,从而减弱PTEn对磷脂酰肌醇-3-三磷酸的抑制活性,细胞周期抑制作用减弱,加速细胞增殖,从而推动肿瘤恶变的发生与发展。而TESTIn则主要位于人染色体FRA7G位点,这一位点现已被证实好发DnA突变、超甲基化、缺失等情况,故极易引起包括TESTIn基因在内的诸多抑癌基因表达的缺失,因其属于抑癌基因,故当该基因表达缺失后,抑癌作用将被大大削弱,从而促进肿瘤的激活、分化与增殖,导致恶性肿瘤疾病的发生。但目前针对TESTIn基因的缺失是否参与了子宫内膜癌发生发展的相关研究并不多见,且TESTIn基因突变是否与PTEn基因突变有关也未见报道。
为深入了解子宫内膜癌发生发展的分子学特点,本研究比较了恶性病变与良性病变子宫内膜癌组织TESTIn、PTEn蛋白表达,结果显示,二者在良性病变子宫内膜组织中呈强阳性表达,而在恶性病变组织中表达大大削弱,提示TESTIn、PTEn蛋白缺失可能与肿瘤恶性病变有关,这与既往多项报道的结果一致;检验二者之间的相关性发现,在子宫内膜癌组织中二者呈正相关,即TESTIn、PTEn蛋白中任一蛋白的缺失均会导致另一蛋白的缺失,推测TESTIn、PTEn蛋白的缺失在子宫内膜组织中相互作用、相互影响,共同参加了肿瘤细胞的增殖、分化,但近年来关于两种蛋白关系的研究尚且少见,故尚无明确的循证依据支持上述推测,该推测的真实性和可靠性仍需进一步验证,此外关于两种蛋白相互作用的具体机制也尚不清晰,仍需通过进一步研究证实;本研究还对比了不同临床病理特征的子宫内膜癌患者的TESTIn、PTEn蛋白表达,结果显示,随着病理分期升高、转移的发生及肌层浸润深度增加,二者的表达逐渐被削弱,提示TESTIn、PTEn蛋白表达缺失可能与子宫内膜癌病程、病情等相关,但其具体机制仍待探究。
综上所述,TESTIn、PTEn蛋白在子宫内膜癌中表达缺失,二者相互影响、相互作用,可能参与了疾病的进展、浸润与转移。今后关于TESTIn、PTEn蛋白的研究重点应放在明确其在子宫内膜癌发生发展过程中的确切生物学功能、作用机制和相互作用关系上,以观察TESTIn、PTEn蛋白是否能够成为未来临床生物学标记位点或基因治疗的作用靶点。
