两亲性壳聚糖载药纳米胶束的制备及其对灰葡萄孢菌的抗菌性能研究*
2020-12-08何祖宇李普旺杨子明刘运浩姚金胜宋书会
何祖宇,李普旺,杨子明,王 超,刘运浩,姚金胜,宋书会,周 闯
(1. 中国热带农业科学院南亚热带作物研究所,海南省热带园艺产品承后生理与保障重点实验室,广东 湛江 524091; 2. 中国热带农业科学院农产品加工研究所,广东 湛江 524001)
0 引 言
丁香精油具有抑菌成分丁香酚,是一种天然、高效的抑菌剂[1]。据报道,丁香精油具有抗细菌、抗真菌和抗氧化等作用,作为广谱杀菌剂,因其作用高效性和长效性,已逐渐应用于食品保鲜中[2-3]。研究发现,丁香精油对引起蓝莓腐烂的灰葡萄孢菌具有较好的抗菌性[4-5],但由于其水溶性差,稳定性低,限制了其实际应用。纳米微胶囊化技术是指采用壁材将芯材活性成分包埋起来,避免芯材受到外界环境的不良影响而对其起到保护作用,具有靶向递送以及控制释放等优点,而逐渐受到广泛关注[6-8]。采用天然高分子材料作为基材,对丁香精油进行包埋,制备具有智能响应型的丁香精油载药纳米微胶囊,可以解决克服丁香精油固有的确定,提高其抑菌性能,扩大其应用范围。
壳聚糖是甲壳素脱乙酰的产物,具有生物可降解、生物相容性好等优点,是目前纳米微胶囊壁材的研究热点[9-10]。由于壳聚糖是刚性直链分子结构,导致其溶解性低,但是可通过引入一些官能团对齐进行修饰,以提高其水溶性。具有亲水链和疏水链的两亲性壳聚糖可作为疏水性药物的载体,在水中自组装成为纳米胶束的研究也引起了广泛的关注[11-12]。壳聚糖的疏水链与药物接触形成疏水内核,亲水链与外部水接触形成稳定的核壳结构。例如,Zhou等[13]通过在壳聚糖链上接枝聚乙二醇和桐油酸,合成了两亲性壳聚糖衍生物,接着以两亲性壳聚糖衍生物作为壁材,采用超声自组装的方法制备了多杀菌素纳米胶束,该纳米胶束具有优秀的持效性和pH响应性,并极大地提高了多杀菌素的光稳定性。
本研究采用化学偶联法,将软脂酸(PA)和N-乙酰-L-半胱氨酸(NAC)分别接枝到壳聚糖链上,以合成两亲性壳聚糖衍生物,并通过傅里叶红外光谱和核磁共振氢谱对其结构进行了表征。同时采用超声自组装法,制备了丁香精油-壳聚糖载药纳米胶束,并对纳米胶束的理化特性进行了表征,并研究了其对灰葡萄孢菌的抑菌性能。
1 实 验
1.1 材 料
1.1.1 实验试剂
壳聚糖(CS,粘度>200 mPa·s,脱乙酰度>98%),软脂酸(PA),N-乙酰-L-半胱氨酸(NAC),1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC),N-羟基琥珀酰亚胺(NHS)购自阿拉丁公司。丁香精油从上海源叶生物科技有限公司购买。灰葡萄孢菌由中国农业微生物菌种保藏管理中心提供。实验用常规化学试剂购自国药集团化学试剂有限公司,均为分析纯。
1.1.2 仪器与设备
傅里叶红外光谱仪,Tensor 27,Bruker公司;核磁共振仪,DPX300,Bruker公司;荧光分光光度计,F7000,日本日立公司;动态光散射仪,Zetasizer Nano ZS,英国马尔文仪器有限公司;高效液相色谱仪,1260 infinity II,美国安捷伦公司。
1.2 实验步骤
1.2.1 软脂酸接枝壳聚糖(PA-CS)
壳聚糖的溶解:准确称取1 g壳聚糖加入三口烧瓶中,接着加入70 mL 1%的乙酸溶液,在加热搅拌的条件下至壳聚糖完全溶解。
软脂酸的溶解:称取0.5 g软脂酸,1 g EDC,0.5 g NHS,并溶解在30 mL无水乙醇中,室温下避光反应30 min,以活化软脂酸的羧基。
将装有壳聚糖溶液的三口烧瓶移入到80 ℃的水浴锅中,然后逐滴滴加软脂酸溶液,在避光条件下加热搅拌反应24 h。反应产物用乙醇离心洗涤,接着装入透析袋中用乙醇和水交替透析2次,最后冷冻干燥得到软脂酸接枝的壳聚糖,记作PA-CS。
1.2.2 合成N-乙酰-L-半胱氨酸接枝PA-CS(PA-CS-NAC)
PA-CS的溶解:称取1 g的PA-CS加入三口烧瓶中,接着加入70 mL 1%的乙酸溶液中,加热搅拌至其完全溶解。
NAC的溶解:称取0.2 g NAC,0.6 g EDC,0.3 g NHS溶解在30mL水中,并在室温下避光反应30 min,以活化NAC中的羧基。
将装有PA-CS溶液的三口烧瓶移入到50 ℃的水浴锅中,然后逐滴滴加NAC溶液,在避光条件下加热搅拌反应24 h。反应完成后,产物用无水乙醇离心洗涤。将溶解在水中的产物装入透析袋中透析三天,第一天的透析液为1 mmol/L盐酸和含有1%氯化钠水溶液,其后两天用含有 0.2 mmol/L盐酸水溶液透析。最后经冷冻干燥得到两亲性壳聚糖,记作PA-CS-NAC-0.2。
其中,通过调节NAC的用量为0.4,0.6 g,按照以上实验步骤合成PA-CS-NAC-0.4和PA-CS-NAC-0.6,以进一步考察NAC对两亲性壳聚糖衍生物的影响。PA-CS-NAC的合成机理如图1所示。
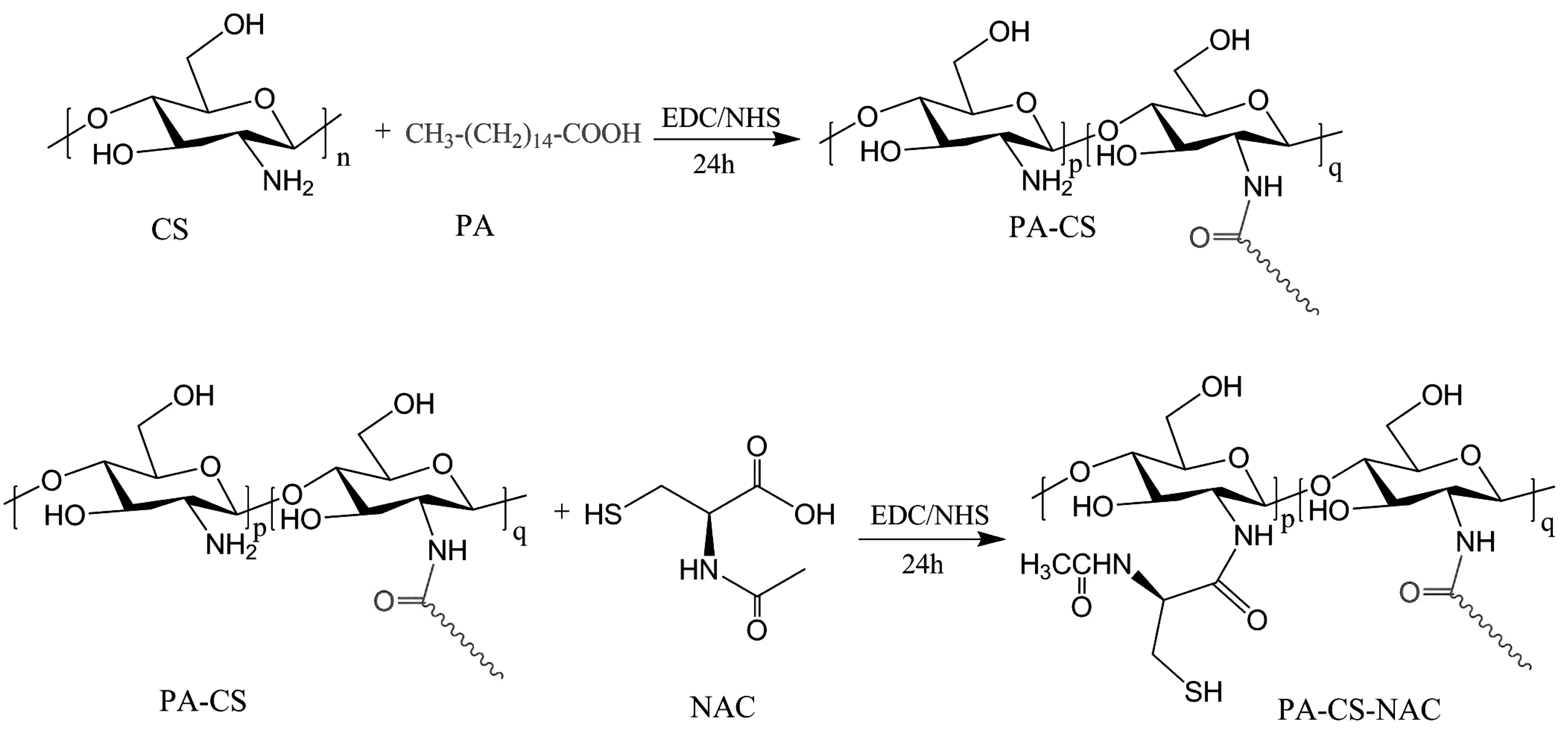
图1 PA-CS-NAC的合成机理图Fig 1 Schematic image for the synthesis of PA-CS-NAC
1.2.3 茚三酮法测定PA的接枝率
本文采用茚三酮法测定PA的接枝率[14-15]。首先配制浓度为0.1,0.08,0.06,0.04,0.02 mg/mL的壳聚糖溶液,各取上述溶液0.5 mL分别加入0.5 mL的醋酸缓冲溶液和2 mL 0.05 mg/mL的茚三酮乙醇溶液,接着将混合液放置在90 ℃水浴锅中并磁力搅拌15 min,最后采用紫外分光光度计测定混合液在570 nm处的吸光度A,根据壳聚糖浓度C和吸光度A进行线性拟合回归方程。同理,按照上述茚三酮法测定PA-CS中氨基的含量,并拟合线性回归方程。最后由两线性回归方程的斜率计算PA-CS中PA的接枝率。
1.2.4 Ellman’s method测定巯基接枝率
Ellman试剂可以与巯基反应,反应产物在420 nm处有强吸收,因此本文通过Ellman’s method测定巯基的含量推算NAC的接枝率[16-17]。首先,以NAC作为标准品,得到巯基单体浓度的拟合曲线。具体地,先用0.5 mol/L pH为8.0的PBS溶液配置浓度为0.3 mg/mL的DTNB溶液,即为Ellman’s试剂;接着配置浓度为50,100,200,300,400 μmol/L的NAC溶液,并取1.5 mL上述NAC溶液加入到1.5 mL Ellman’s 试剂中,混合均匀后反应2 h,测定420 nm处的紫外吸光度,根据吸光度与浓度的关系,得到拟合标准曲线。配置浓度为0.1 mg/mL的PA-CS-NAC溶液,根据上述Ellman’s method测定吸光度,并结合曲线方程,计算出PA-CS-NAC-0.2,PA-CS-NAC-0.4和PA-CS-NAC-0.6中巯基的接枝率,推算NAC的接枝率。
1.2.5 临界胶束浓度测定(critical micelle concentration cmc)
以芘作为探针,测定PA-CS-NAC的临界胶束浓度[18-19]。首先配置浓度为1 mg/mL的PA-CS-NAC标准液,标记溶液A,以及浓度为0.1 mmol/L的芘丙酮溶液,标记溶液B,取一定量的溶液B加入到溶液A中,加热搅拌,除去丙酮,然后将定容,使得PA-CS-NAC的终浓度为0.1,0.07,0.05,0.03,0.01,0.005,0.003,0.001,0.0005 mg/mL, 芘的终浓度为50 μmol/L。在激发波长为338 nm,发射波长为350~450nm的条件下,用F-7000荧光光谱仪对PA-CS-NAC-0.2,PA-CS-NAC-0.4,PA-CS-NAC-0.6三个样品的荧光强度进行了测量。选取第三个峰(393 nm)和第一个峰(373 nm)处的吸收峰强度比作为纵坐标,浓度对数作为横坐标,作图得到两直线,其交点为CMC。
1.2.6 自组装法制备载药纳米胶束及其包封率和载药量测定
采用超声自组装的方法制备负载丁香精油的PA-CS-NAC载药纳米胶束。称取10 mg PA-CS-NAC溶解在20 mL去离子水中,搅拌至完全溶解,然后用超声波仪超声处理5 min,连续处理3次,制得空白纳米胶束水溶液。取一定量溶解在甲醇中的丁香精油溶液(1 mg/mL),加入上述空白纳米胶束水溶液中,超声处理5 min,连续处理3次,并搅拌5 h,然后用去离子水透析过夜,以除去甲醇,得到载药纳米胶束,记作NMs。根据巯基接枝率的不同,将3种载药纳米胶束分别记作NMs-0.6,NMs-0.4和NMs-0.2。
包封率(EE)和载药量(DL)的测定:配置浓度为0.1,0.5,1,2,4,6,8,10 mg/mL的丁香精油标准液,采用Eclipse XDB-C18型色谱柱,以甲醇-水(70:30)为流动相,检测波长为280 nm,流速为1.0 mL/min,在此条件下测定并拟合丁香精油标准液的曲线方程,其中以丁香酚峰面积A对浓度C进行线性回归,回归方程为:A=2.63×105C+0.047×105,R2=0.998。取5 mL PA-CS-NAC载药纳米胶束在10000 r/min的转速下离心20 min,取上清液,通过高效液相色谱法(HPLC)测定丁香精油的含量,并由此计算包封率(EE)和载药量(DL)。
EE和DL按下式计算:
EE(%)=(m-m0)/m×100%
(1)
DL(%)=(m-m0)/(M+m-m0)×100%
(2)
在上述方程式中,m是加入丁香精油的总量,m0是上清液中丁香精油的量,M是PA-CS-NAC的总量。
1.2.7 体外释放
取2 mL NMs至透析袋(截留分子量为3500 Da)内,并浸泡在10 mL PBS(pH分别为6.0、7.5、8.5)溶液中透析,然后取不同时间点下的透析液2 μL进行HPLC测定,累计释放量计算公式如下:
Cumulative release(%)=mt/m×100%
(3)
mt是t时刻释放的丁香精油总量,m是被包埋的丁香精油总量。其中mt的计算公式如下:
mt=CtV
(4)
Ct是t时刻测定的释放质量浓度;V=12 mL,是NMs与透析液的总体积,其中取样测试的体积忽略不计。
1.2.8 载药纳米胶束抑菌性能评价
用不同浓度的丁香精油载药纳米胶束和与马铃薯葡萄糖琼脂(PDA)培养基混合均匀,分别取直径为8 mm的灰葡萄孢菌的菌块,在温度为30 ℃和湿度为95%的条件下,分别培养5和10 d后,采用十字交叉法测量菌丝体径向生长的直径。实验重复三次,抑菌率按如下公式计算。
抑制率 (%)=[(空白对照菌落直径-8)-(实验处理菌落直径-8)]/(空白对照菌落直径-8)×100
(5)
注:菌落直径单位为mm,8为接入的菌饼直径。
2 结果与讨论
2.1 PA-CS-NAC的红外表征
采用化学偶联法制备两亲性壳聚糖衍生物,通过傅里叶变换红外光谱仪对接枝基团进行表征,以确定壳聚糖衍生物的分子结构。如图2(a)所示,1 654 和1 600 cm-1处的吸收带分别是壳聚糖酰胺I带羰基的伸缩振动吸收和氨基的弯曲振动吸收。图2(b)是软脂酸PA的红外光谱图,其特征吸收峰是1 700 cm-1处的羧基振动吸收。图2(c)是软脂酸接枝壳聚糖PA-CS的红外光谱图,对比图(a)、(b)和(c),可见隶属于壳聚糖的吸收带1 654 和1 600 cm-1和隶属于软脂酸的吸收带1 700 cm-1均在图(c)出现,因此说明PA成功接枝在CS上。图2(d)是NAC的红外光谱图,2 550 cm-1附近是归属于巯基的特征吸收带。图2(e)是的PA-CS-NAC的红外光谱图,含有巯基的特征吸收带和碳基的吸收带,因此NAC也成功接枝到壳聚糖链上。综上,两亲性壳聚糖衍生物制备成功。
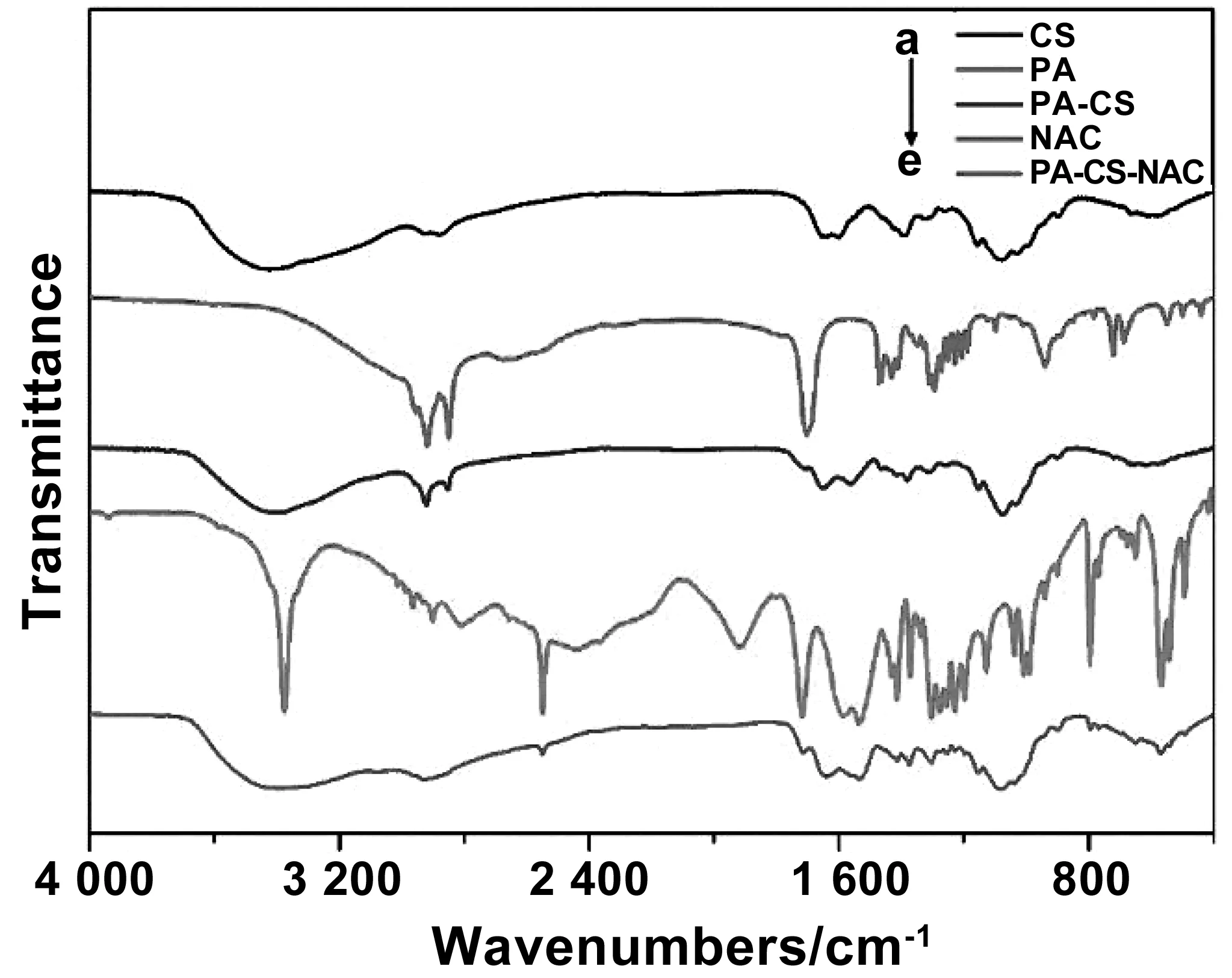
图2 红外光谱图,CS(a),PA(b),PA-CS(c),NAC(d)和PA-CS-NAC(e)Fig 2 Infrared spectra of CS, PA, PA-CS, NAC and PA-CS-NAC
2.2 PA-CS-NAC的核磁表征
为了进一步确定两亲性壳聚糖PA-CS-NAC的结构,采用核磁共振氢谱对其进行表征,结果如图3所示。相对于CS的1H-NMR谱图,PA-CS-NAC的1H-NMR谱图在δ=1.19 ppm处出现新的化学位移峰,其为甲基(—CH3)和亚甲基(—CH2—)的质子氢特征吸收峰,说明软脂酸PA接枝上壳聚糖链上;在δ=1.84 ppm处也出现新的化学位移峰,其为NAC中-SH的质子氢特征吸收峰,说明NAC也接枝上壳聚糖链上。另外,δ=4.11 ppm处也出现新的化学位移峰,其为酰胺基(-NH-CO-CH-)的质子氢特征吸收峰,以上可以证明软脂酸PA和NAC均已接枝到壳聚糖的支链上。因此,可以证明PA-CS-NAC已成功合成。
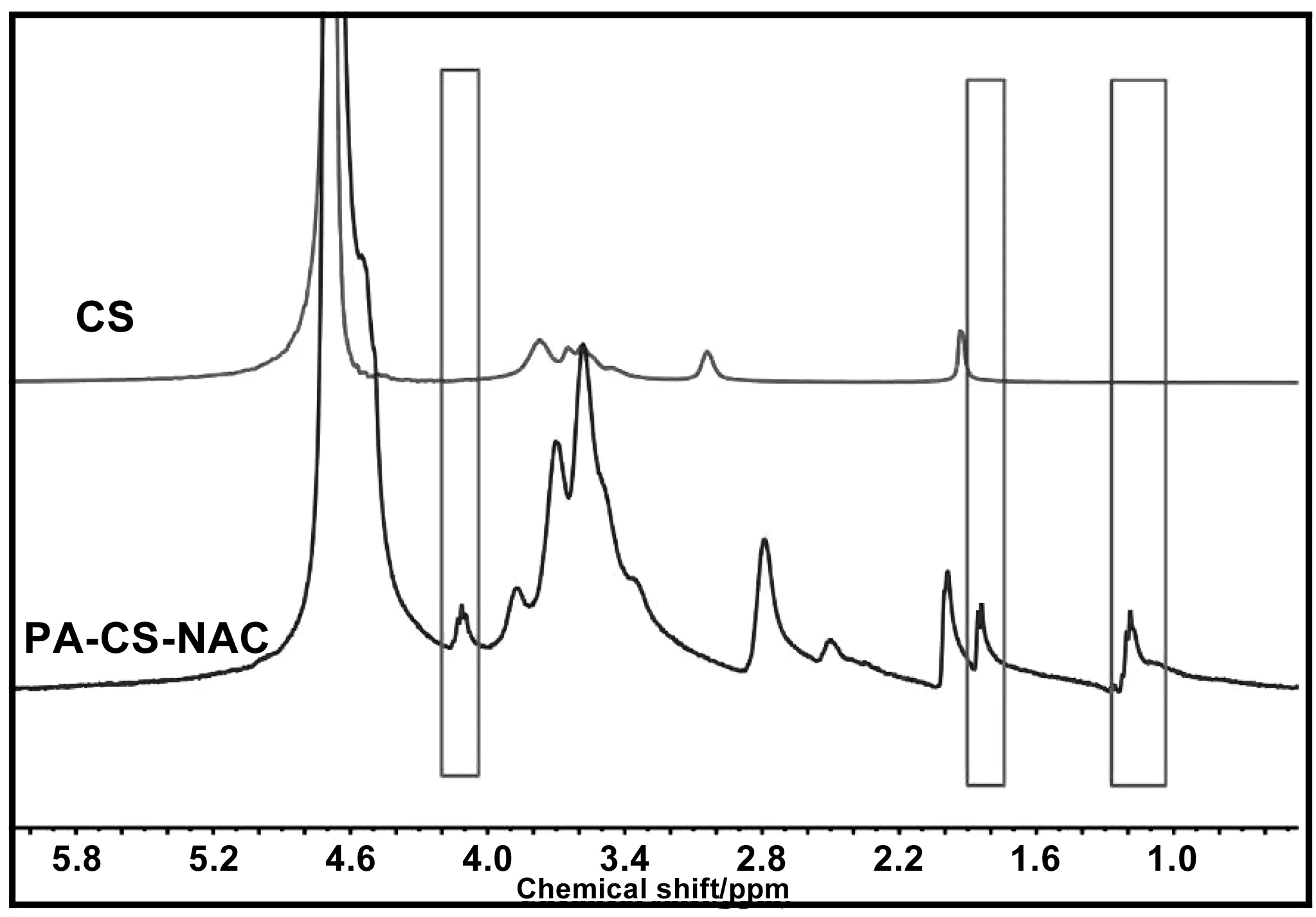
图3 壳聚糖(CS)及其衍生物(PA-CS-NAC)的核磁共振氢谱Fig 3 1HNMR spectra of CS and PA-CS-NAC
2.3 PA-CS-NAC中PA与NAC的接枝率
茚三酮试剂可以与壳聚糖链上的氨基反应,因此采用茚三酮法测定PA的接枝率。浓度为0.1,0.08,0.06,0.04,0.02 mg/mL的壳聚糖溶液,与茚三酮乙醇溶液反应,根据混合液在570 nm处的吸光度A,以及壳聚糖浓度C和吸光度A进行线性拟合得到回归方程为A=3.712C+0.0338,r2=0.997。同理,按照上述茚三酮法测定PA-CS中氨基的含量,最终得到的拟合方程为A=1.654C+0. 0281,r2=0.995。因此,由两拟合方程的斜率计算得到PA-CS中PA的接枝率为44.56%。
Ellman试剂可以与巯基反应,反应产物在420 nm处有强吸收,因此本文通过Ellman’s method测定巯基的含量推算NAC的接枝率。以浓度为50,100,200,300,400 μmol/l的NAC标准溶液与Ellman试剂反应,测定420 nm处反应物的紫外吸收强度,根据吸光度与浓度的关系,计算得到拟合标准曲线为A=9.38CSHμmol/mL-0.12,r2=0.994。配置浓度为0.1mg/mL的PA-CS-NAC溶液,通过Ellman’s method测定吸光度,并结合曲线方程,计算出PA-CS-NAC-0.2,PA-CS-NAC-0.4和PA-CS-NAC-0.6中NAC的接枝率为22.27%,38.65%,48.73%。
2.4 PA-CS-NAC的临界胶束浓度
为了表征两亲性壳聚糖PA-CS-NAC在水溶液中的自组装行为,以芘作为探针,采用荧光分光光度计法测定了两亲性壳聚糖的临界胶束浓度。芘是一种疏水性荧光探针,当其暴露于水环境时,其倾向于聚集在PA-CS-NAC的疏水结构中,当PA-CS-NAC的浓度达到一定高度,可行成包覆芘的胶束结构,引起芘的荧光发射I1峰和I3峰的变化,通过分析其变化的突变点,即可确定临界胶束浓度。不同接枝率的两亲性壳聚糖的胶束浓度与I1/I3值的关系图如图4所示,计算得到PA-CS-NAC-0.6(a),PA-CS-NAC-0.4(b), PA-CS-NAC-0.2(c)的临界胶束浓度分别为8.317,7.395,5.833 μg/ mL,表明尽管三种两亲性壳聚糖PA-CS-NAC亲水基团的接枝率不尽相同,但都能在较低的浓度下可以自聚集成胶束,而且亲水性基团接枝率越低,临界胶束浓度也越小。
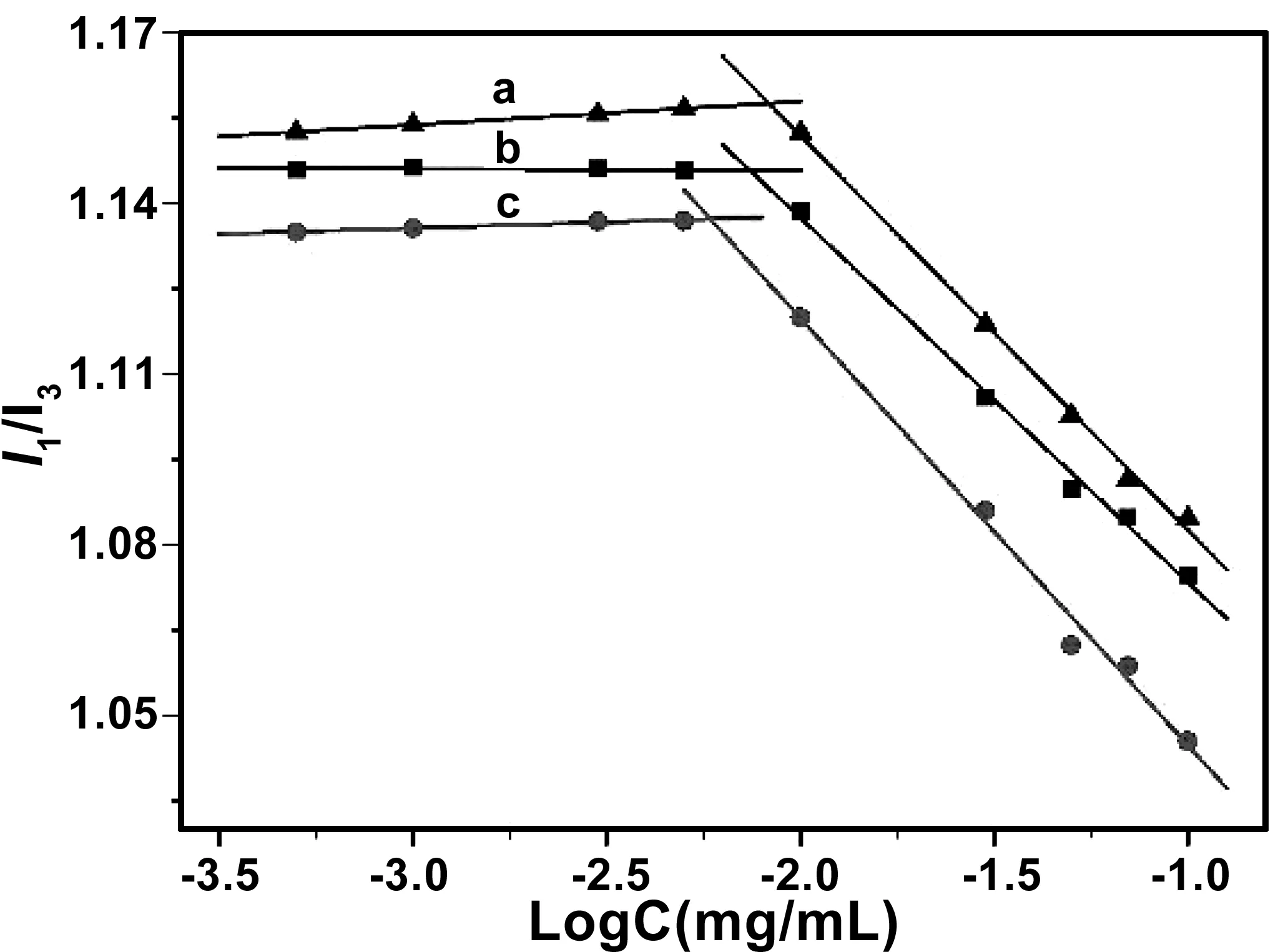
图4 PA-CS-NAC纳米胶束的浓度与I1/I3值的关系图,PA-CS-NAC-0.6(a),PA-CS-NAC-0.4(b)和 PA-CS-NAC-0.2(c)Fig 4 The relationship between the concentration of PA-CS-NAC nanomicelles and I1/I3: (a) PA-CS-NAC-0.6; (b) PA-CS-NAC-0.4; (c) PA-CS-NAC-0.2
2.5 PA-CS-NAC载药纳米胶束的粒度、zeta电位和形貌表征
采用动态光散射仪测定PA-CS-NAC载药纳米胶束的粒度和zeta电位,结果如表1所示。可以看出,NMs-0.6的粒径和zeta电位最大,分别为128.61 nm和31.57 mV;NMs-0.4的粒径和zeta电位次之,分别为96.04 nm和29. 31 mV;NMs-0.2的粒径和Zeta电位最小,分别为82.83 nm和26.08 mV。这与两亲性壳聚糖上亲水性基团的接枝率有关,亲水性基团越多,亲水基团与水充分接触的几率大,形成纳米胶束的粒径也就越大。同理,zeta电位也随着两亲性壳聚糖亲水性基团数量的增多而变高。
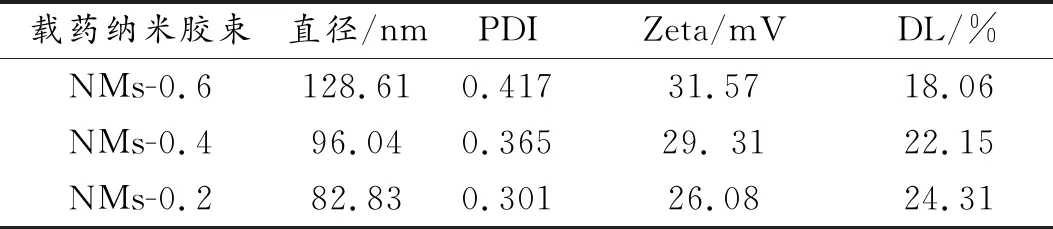
表1 PA-CS-NAC载药纳米胶束的粒度、zeta电位和载药量数据
此外,利用扫描电镜表征PA-CS-NAC载药纳米胶束的形貌,载药纳米胶束的电镜图如5所示。可见,3种载药纳米胶束均呈现球状,NMs-0.6载药纳米胶束的粒径最大,大于100 nm,而NMs-0.4和NMs-0.2的粒径均小于100 nm,扫描电镜测试结果与动态光散射的保持一致。

图5 载药纳米胶束的扫描电镜图,NMs-0.6(A),NMs-0.4(B), NMs-0.2(C)Fig 5 SEM images ofNMs-0.6, NMs-0.4 and NMs-0.2
2.6 PA-CS-NAC载药纳米胶束的包封率和载药量表征
通过高效液相色谱法研究芯材投料量对PA-CS-NAC载药纳米胶束丁香精油的包封率和载药量的影响,以NMs-0.6载药纳米胶束为例,结果如图6所示。随着丁香精油加入量的增大,NMs-0.6载药纳米胶束的载药量上升,包封率下降,当加入1,2,3,4,5 mL丁香精油时,对应的载药量分别为7.59%,10.87%,14.25%,16.84%,18.06%,相应的包封率分别为82.13%,61.15%,56.91%,50.62%,44.08%。考虑到继续加大芯材丁香精油的投入量,载药量增加不大,因此,本实验选择芯材丁香精油的投入量为5 mL。如表1所示,当丁香精油的投入量为5 mL时,NMs-0.4载药纳米胶束丁香精油的载药量为22.15%,NMs-0.2载药纳米胶束丁香精油的载药量为24.31%。
2.7 PA-CS-NAC载药纳米胶束的缓释性能
通过高效液相色谱法测定了丁香精油载药纳米胶束在不同pH环境下的缓释性能,这里以NMs-0.6载药纳米胶束为例,结果如图7A所示。从图可以看出,3种pH环境(pH=6.0,7.5,8.5)下,都存在一个突释过程,在前10h内分别累计释放32.13%,25.68%,和16.29%,然后释放速度减慢。其中,载药纳米胶束在弱酸和偏中性环境下(pH=6.0,7.5)可以释放出更多的药物,这是由于在弱酸和中性环境中,弱酸的诱导效应导致纳米胶束的外层壳聚糖结构疏松,有利于丁香精油从疏水性内核中释放出来;而在碱性条件环境,由于改性壳聚糖中的氨基与碱性环境OH-的静电作用,抑制了载药胶束中丁香精油的释放。另外,如图7B所示,在pH=6.0的环境下,NMs-0.6, NMs-0.4, NMs-0.2三种载药载药纳米胶束的缓释速度依次减慢,这是因为壳聚糖链上亲水性基团越多,越有利于载药纳米胶束的溶胀作用,因此载药纳米胶束的缓释速度越快。上述数据表明,丁香精油载药纳米胶束具有一定的pH调控释放的性能,这为载药胶束在实际应用中提供了参考依据。
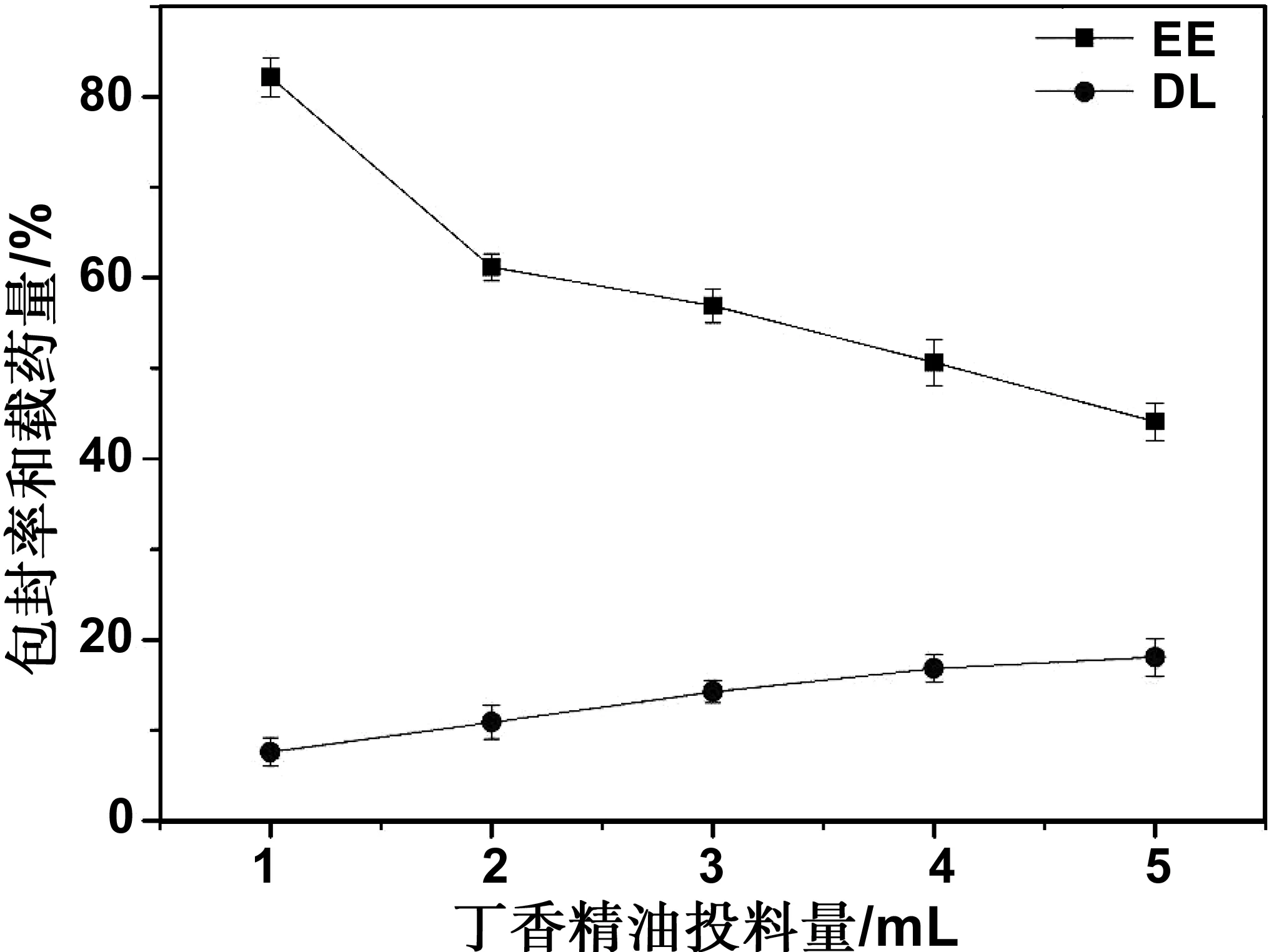
图6 丁香精油投料量对包封率和载药量的影响Fig 6 Effect of the dosage of clove essential oil on the EE and the DL
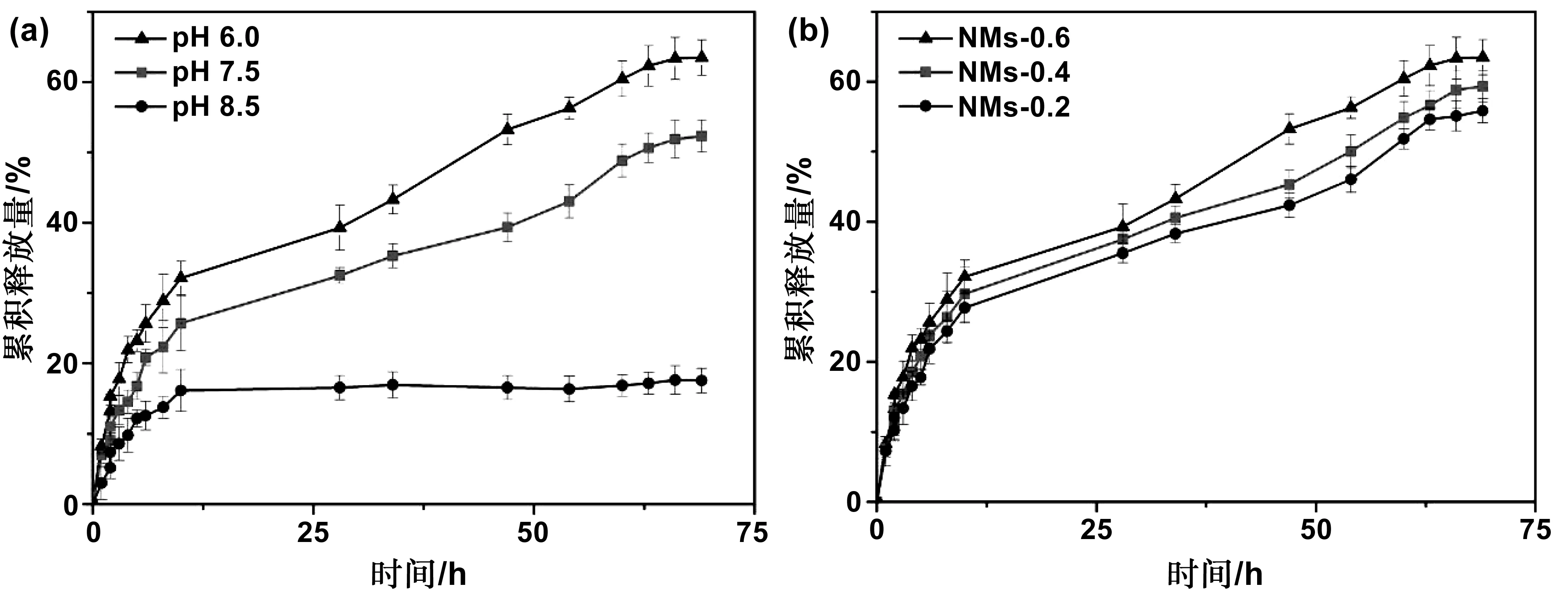
图7 (a)NMs-0.6在不同pH下的缓释曲线;(b)NMs-0.6, NMs-0.4, NMs-0.2在pH=6.0下的缓释曲线Fig 7 Slow release curves of NMs-0.6 at different pH and slow release curves of NMs-0.6, NMs-0.4 and NMs-0.2 at pH=6.0
2.8 PA-CS-NAC载药纳米胶束的抑菌性能
通过菌丝生长速率法测量了丁香精油载药纳米胶束对灰葡萄孢菌的抑真菌活性,结果如图7(a)和(b)所示。当丁香精油的药物浓度为5 mg/L时(7a),NMs-0.6的抑菌率最高,其对灰葡萄孢菌的5天和10天抑制率分别比丁香精油原药的高出13.76%和10.24%。当多丁香精油的药物浓度为10 mg/L时(7b),也是NMs-0.6的抑菌率最高,其对灰葡萄孢菌的5和10 d抑制率分别比丁香精油原药的高出14.52%和9.74%。此外,从图可知三种载药纳米胶束的抑菌率相当,但是以NMs-0.6的抑菌率最高,这可能是因为PA-CS-NAC-0.6的亲水性基团接枝率最高,有利于NMs-0.6附着于细菌的表面,使得丁香精油产生更佳的抗菌活性。抗菌实验结果说明,三种载药纳米胶束的抑真菌活性都比丁香精油原药的高,在相同剂量的丁香精油下,载药纳米胶束对灰葡萄孢菌具有更高的抗真菌活性。
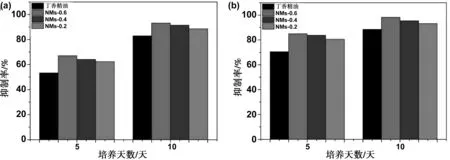
图8 丁香精油和载药纳米胶束的抑菌率,丁香精油药物浓度分别为5 mg/L(A)和10 mg/L(B)Fig 8 Antibacterial rate of clove essential oil and NMs, the concentration of clove essential oil were 5 mg/L and 10 mg/L, respectively
3 结 论
实验通过化学偶联法,在壳聚糖链上接枝了疏水基团软脂酸和亲水基团N-乙酰-L半胱氨酸,合成并表征了两亲性壳聚糖衍生物,并以此为壁材,制备了包埋丁香精油的载药纳米胶束,并探讨了载药纳米胶束对灰葡萄孢菌的抗真菌活性。主要研究结果如下:
(1)本文采用偶联反应合成了两亲性壳聚糖衍生物(PA-CS-NAC),接着采用红外光谱仪和核磁共振仪表征了PA-CS-NAC的化学结构,利用茚三酮法和Ellman’s method测定了其疏水基团和亲水基团的接枝率。
(2)以芘作为探针测定了不同接枝率PA-CS-NAC的临界胶束浓度,两亲性壳聚糖衍生物中亲水性基团的接枝率越高,其临界胶束浓度越大。
(3)通过超声自组装法制备了丁香精油载药纳米胶束,两亲性壳聚糖衍生物中亲水性基团的接枝率越高,载药纳米胶束的粒径就越大,在相同条件下的缓释速度最快。
(4)制备的载药纳米胶束具有pH响应和持效缓释性能,同一条件下,载药纳米胶束的抗菌能力较未包埋的丁香精油可提高10%以上。
