布鲁氏菌Omp2b蛋白抗原表位的生物信息学分析
2020-12-08李大伟张峰波李智伟江晓明沙桐赵骁陈志强丁剑冰
李大伟,张峰波,李智伟,江晓明,沙桐,赵骁,陈志强,丁剑冰,
1 新疆医科大学第五附属医院,乌鲁木齐830054;2 新疆医科大学第一附属医院;3 新疆医科大学
布鲁氏菌病是由布鲁氏菌感染引起的一种人畜共患传染病,全球每年约有50万新发病例[1-4]。布鲁氏菌病临床症状不典型,极易误诊或漏诊,从而造成多系统、多器官慢性损伤,严重影响患者生活质量[5-8]。因此,研发针对布鲁氏菌的疫苗能够有效降低布鲁氏菌病的发生率,但目前针对布鲁氏菌的灭活疫苗和减毒活疫苗还存在诸多不足,如效果不佳、不良反应多[9]。外膜蛋白2b(Omp2b)是布鲁氏菌重要的免疫原性蛋白,属于菌体外膜脂蛋白,存在于已知所有的菌属中。Omp2b蛋白具有良好的抗原性与免疫原性,可刺激体液免疫,对细胞免疫亦有一定刺激作用。在疫苗研制过程中,Omp2b蛋白被认为是一种较为理想的疫苗分子,近年来受到广泛关注。但目前关于Omp2b蛋白抗原特异性与表位的研究较少。2017年6月—2019年8月,本研究对布鲁氏菌Omp2b蛋白的抗原表位进行了生物信息学分析。现报告如下。
1 材料与方法
1.1 材料 氨基酸序列:羊布鲁氏菌Omp2b,GenBank:AMM72579.1,长度362 bp,蛋白氨基酸序列:MNIKSLLLGSAAALVAASGAQAADAIVAPEPEAVEY-VRVCDAYGAGYFYIPGTETCLRVHGYVRYDVKGGD-DVYSGTDRNGWDKGARFALRVSTGSETELGTLKTFT-ELRFNYAANNSGVDGKYGNETSSGTVMEFAYIQLGG-LRVGIDESEFHTFTGYLGDVINDDVISAGSYRTGKIAY-TFTGGNGFSAVIALEQGGDNDGGYTGTTNYHIDGYM-PDVVGGLKYAGGWGSIAGVVAYDSVIEEWAAKVRG-DVNITDQFSVWLQGAYSSAATPDQNYGQWGGDWAV-WGGLKYQATQKAAFNLQAAHDDWGKTAVTANVAY-ELVPGFTVTPEVSYTKFGGEWKNTVAEDNAWGGIV-RFQRSF。生物信息学分析软件:ProtParam(http://web.expasy.org/protparam/),SOMPA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html),DNAStar(http://www.dnastar.com),IEDB(http://tools.immuneepitope.org/mhci/,http://tools.immuneepitope.org/mhcii/,http://tools.immuneepitope.org/main/bcell/),SYFPEITHI(http://www.syfpeithi.de/),SWISS-MODEL(https://swissmodel.expasy.org/interactive/),RasMol2.7.2.1(http://www.openrasmol.org/),所有软件在线获取。
1.2 方法
1.2.1 Omp2b蛋白理化性质预测 利用ProtParam软件分析Omp2b蛋白的氨基酸组成、不稳定系数和疏水性等理化性质。
1.2.2 Omp2b蛋白二级结构分析 利用SOMPA在线软件分析Omp2b蛋白的二级结构特点,如α螺旋、β折叠、β转角和无规卷曲。
1.2.3 Omp2b蛋白三级结构分析 将Omp2b蛋白氨基酸序列录入SWISS-MODEL在线服务器,分析蛋白氨基酸序列并组合模板,构建Omp2b蛋白的三级结构,用RasMol2.7.2.1软件读取数据并分析其三级结构,明确Omp2b蛋白的稳定性。
1.2.4 Omp2b蛋白B、T细胞表位预测 利用IEDB、DNAStar软件预测Omp2b蛋白的B细胞抗原表位;利用SYFPEITHI、IEDB软件预测Omp2b蛋白的T细胞抗原表位。主要组织相容性复合体(MHC)Ⅰ类分子选择HLA-A*1101,MHC Ⅱ分子选择HLA-DRB1*0701,通过比较分析最终确定Omp2b蛋白的B、T细胞抗原表位。
2 结果
2.1 Omp2b蛋白的理化性质 经ProtParam软件分析,Omp2b蛋白是一种由362个氨基酸组成的蛋白质,不稳定系数为23.54,疏水性为-0.200,属于一种稳定亲水性蛋白质。
2.2 Omp2b蛋白的二级结构 SOMPA在线软件分析显示,在Omp2b蛋白的二级结构中,α螺旋占23.76%,β折叠占27.90%,β转角占5.80%,无规卷曲占42.54%。见图1。
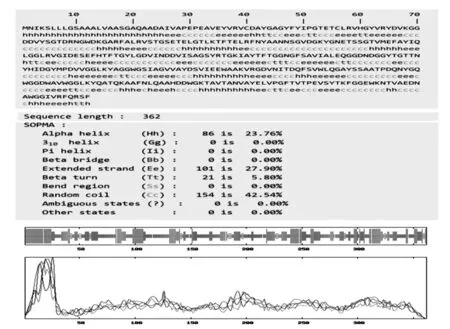
图1 Omp2b蛋白的二级结构分析结果
2.3 Omp2b蛋白的三级结构 RasMol2.7.2.1软件分析显示,Omp2b蛋白的三级结构是环状的,非常稳定,更多β折叠位于蛋白质中间;在蛋白质三级结构的上部和下部存在许多易于形成构象表位的结构。见图2。
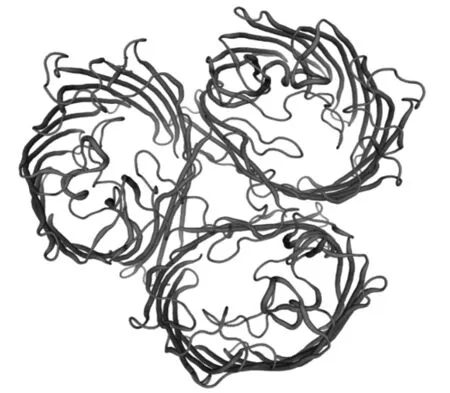
图2 Omp2b蛋白的三级结构形态
2.4 Omp2b蛋白的B、T细胞抗原表位
2.4.1 Omp2b蛋白的B细胞抗原表位 IEDB在线软件预测,在Omp2b蛋白的B细胞抗原表位中,蛋白线性表位有11个得分较高区域,其位点分别位于18~34、66~85、93~101、115~131、169~176、184~188、196~212、225~232、268~286、306~316、328~352;蛋白β转角有10个得分较高区域,其位点分别位于195~222、65~85、110~135、270~291、40~55、168~178、330~345、158~165、183~190、225~232;蛋白表面可及性有12个得分较高区域,其位点分别位于72~82、270~279、62~70、121~129、291~299、197~204、206~213、332~338、341~347、109~115、172~177、306~311;蛋白骨架区柔韧性有11个得分较高区域,其位点分别位于65~85、115~135、90~110、195~210、270~283、335~350、250~260、170~179、150~155、50~57、30~35;蛋白抗原指数有12个得分较高区域,其位点分别位于23~43、4~20、259~271、135~147、316~328、56~66、233~242、228~224、300~306、330~336、190~195、45~50;蛋白亲水性有13个得分较高区域,其位点分别位于65~85、113~133、195~215、265~282、340~350、305~315、290~300、90~100、15~22、30~38、40~45、50~55、150~157。
DNAStar在线软件综合蛋白的α螺旋、β转角、表面可及性、骨架区柔韧性和抗原指数五个方面预测Omp2b蛋白的B细胞抗原表位(见图3),结合IEDB在线软件分析的线性表位、表面可及性、β转角、骨架区柔韧性、抗原指数、亲水性六个方面,确定了Omp2b蛋白8个B细胞抗原表位,见表1。
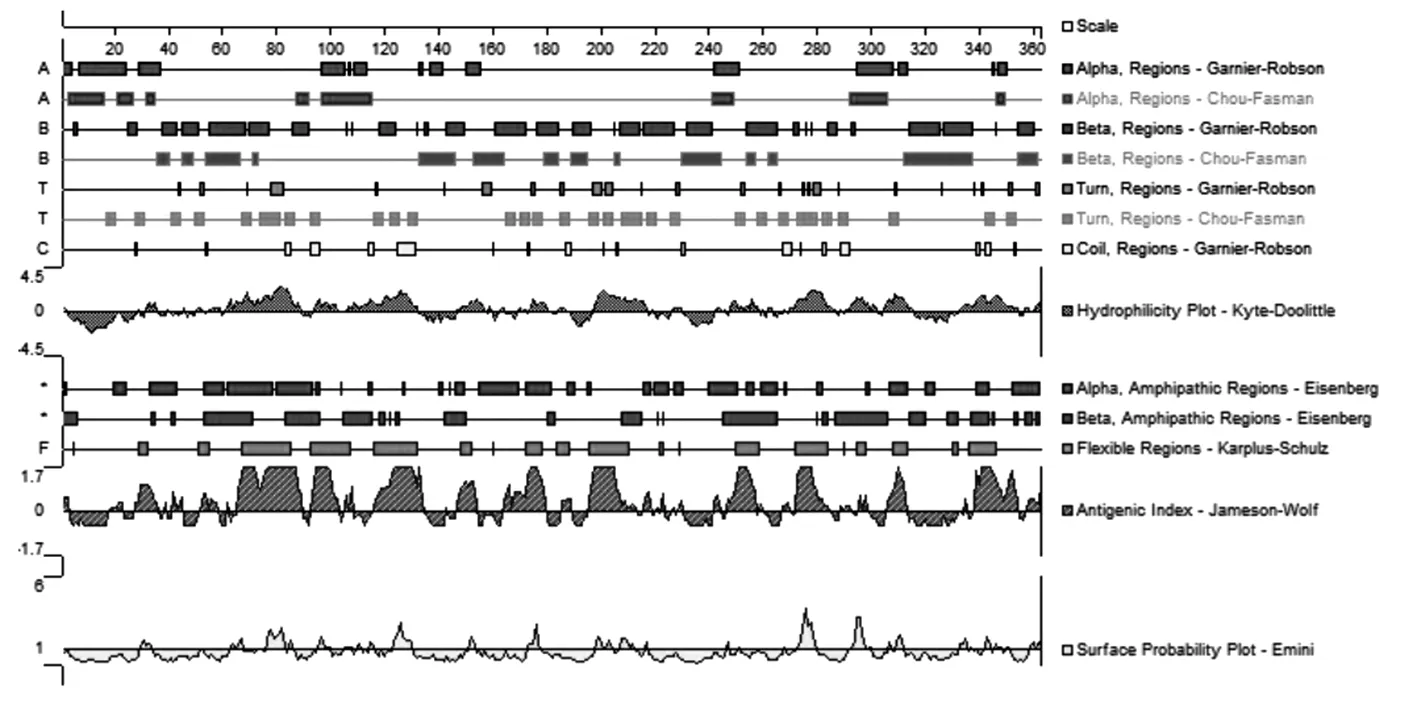
注:A为α螺旋区域,B为β折叠区域,T为β转角,C为无规卷曲区域。

表1 Omp2b蛋白的B细胞抗原表位
2.4.2 Omp2b蛋白的T细胞抗原表位 采用SYFPEITHI和IEDB在线软件预测Omp2b蛋白的T细胞抗原表位,以HLA-A*1101预测CTL细胞抗原表位,以HLA-DRB1*0701预测Th细胞抗原表位,结果见表2。经综合分析,共得到7个CTL优势表位和3个Th优势表位,见表3。
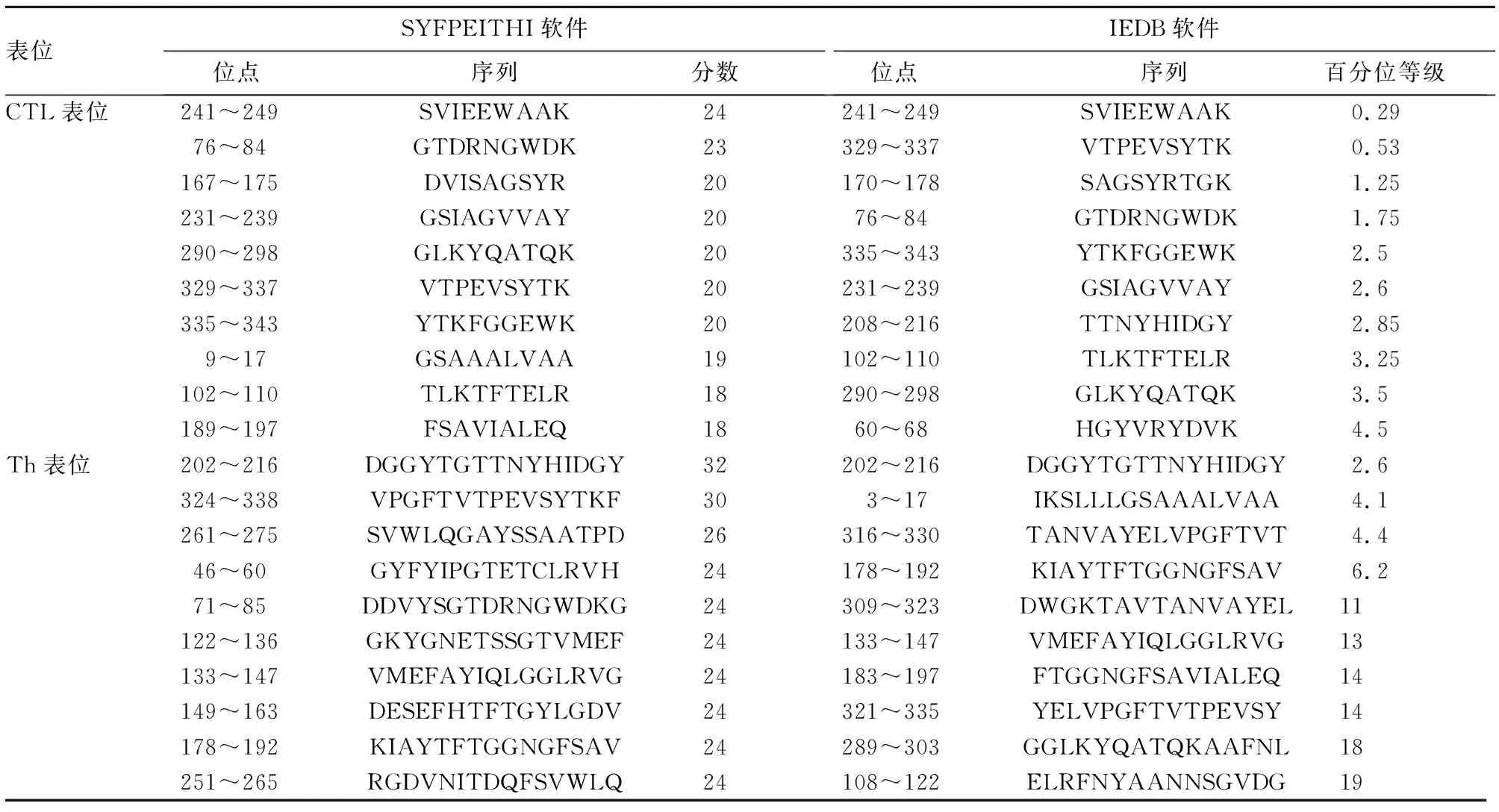
表2 SYFPEITHI和IEDB软件预测的Omp2b蛋白CTL与Th表位
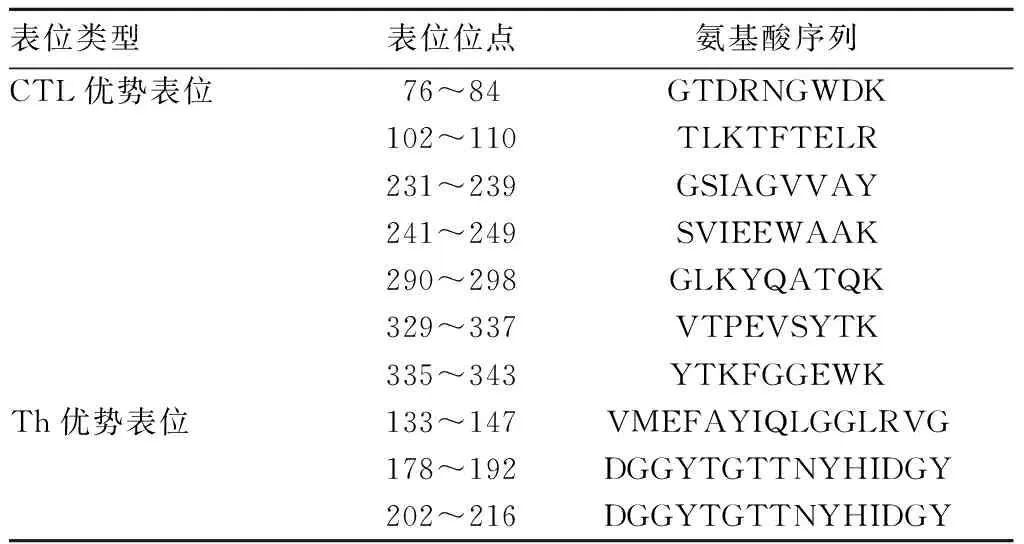
表3 Omp2b蛋白的T细胞抗原表位
3 讨论
布鲁氏菌病是由布鲁氏菌感染引起的一种人畜共患传染病。布鲁氏菌可通过多种途径传播,侵袭力和致病力强,临床症状不典型,能够引起多系统、多器官慢性损伤。近年来,全球布鲁氏菌病疫情防控形势严峻,每年大约有50万新发病例。布鲁氏菌病在我国大部分省市自治区有不同程度流行,特别是畜牧业发达地区。新疆维吾尔自治区是全国五大牧区之一,近年来布鲁氏菌病的发病率持续上升。布鲁氏菌病病情难以控制,存在较多并发症,如治疗不及时易转入慢性期,反复发作,迁延数年甚至终生不愈,严重影响患者的生活质量。因此,布鲁氏菌病的防治工作在世界范围内备受关注。研发针对布鲁氏菌的疫苗能够有效降低布鲁氏菌病的发生率,但目前针对布鲁氏菌的灭活疫苗和减毒活疫苗还存在诸多不足,如效果不佳、不良反应多[9]。
布鲁氏菌的外膜蛋白是近年来的研究热点。有研究显示,外膜蛋白属于保护性抗原,具有免疫原性,布鲁氏菌的外膜蛋白不仅是最重要的血清学诊断抗原,也是一个主要的毒力因子。外膜蛋白能够维持布鲁氏菌的正常结构和基本功能,在布鲁氏菌生存中发挥重要作用,其功能涉及侵袭、迁移和复制等与生存相关的多个环节。Omp2b蛋白是普遍存在于布鲁氏菌中的一种外膜蛋白,相对分子质量为36 kDa。蛋白质组学研究发现,Omp2b作为构成跨膜通道的膜孔蛋白,是主要的外膜蛋白之一。通过生物信息学工具对Omp2b蛋白的B、T细胞抗原表位进行预测,并经动物实验证实,Omp2b蛋白能够引起较强的Th1型免疫反应,可作为诊断布鲁氏菌病的候选抗原之一。
开发有效的抗布鲁氏菌病疫苗是当前阶段研究的重点。而疫苗受蛋白结构和功能的影响较大[10],故探索布鲁氏菌Omp2b蛋白的结构和功能对疫苗研发具有重要意义。本研究对Omp2b蛋白的一级结构分析发现,Omp2b蛋白是一种稳定亲水性蛋白质。在蛋白的二级结构中,β转角区域和无规卷曲区域有利于形成表位区域[11]。本研究发现,在Omp2b蛋白的二级结构中无规卷曲和β转角构成较多。本研究通过SWISS-MODEL软件预测并构建Omp2b蛋白的三级结构,结果发现Omp2b蛋白是环状的,非常稳定,其表位主要位于三级结构的上部和下部。以上研究表明,Omp2b蛋白的结构具有疫苗研发所需的特性。
有效的疫苗不仅应具有合理的蛋白结构,还应具有相应的T、B细胞抗原表位。T细胞抗原表位必须能够加工成与相应MHC结合的肽,然后被TCR识别[12]。T细胞抗原表位分别由CTL和Th细胞识别的MHC Ⅰ、Ⅱ类分子呈递。布鲁氏菌是一种细胞内病原体,细胞免疫在去除致病菌方面起着重要作用[13]。本研究使用SYFPEITHI、IEDB软件分析了Omp2b蛋白的T细胞抗原表位,由于HLA-A*1101、HLA-DRB1*0701在新疆人群中出现的频率较高,故以HLA-A*1101预测CTL细胞抗原表位,以HLA-DRB1*0701预测Th细胞抗原表位[14-16],最后筛选出了Omp2b蛋白7个CTL优势表位和3个Th优势表位。B细胞产生的特异性抗体可有效识别病原体并引起随后的一系列免疫应答。因此,B细胞抗原表位在疫苗研发中具有重要作用[17-18]。本研究通过DNAStar、IEDB软件确定了Omp2b蛋白的8个B细胞抗原表位。
综上所述,布鲁氏菌Omp2b蛋白具有7个CTL优势表位、3个Th优势表位和8个B细胞抗原表位,具有良好的免疫原性。这为布鲁氏菌病诊断和疫苗研发提供了一定理论依据。
