杨梅对低温胁迫的生理响应与抗寒性评价
2020-12-07任海英程龙军胡丹郑锡良张淑文俞浙萍戚行江
任海英,程龙军,胡丹,郑锡良,张淑文,俞浙萍,戚行江
(1.浙江省农业科学院 园艺研究所,浙江 杭州 310021; 2.浙江农林大学 林业与生物技术学院,浙江 杭州 311300;3.温州市农业技术推广中心,浙江 温州 325011)
杨梅(Myricarubra)是我国南方特色优势水果之一,为杨梅科(Myricaceae)杨梅属(Myrica)植物,果实甜酸适口,风味独特。截至2018年,我国杨梅种植面积约33.50万hm2,其中,浙江省栽培杨梅8.90万hm2,产量58.44万t,年产值50多亿元,杨梅是山区农民脱贫致富的重要树种。许多杨梅产区,尤其是海拔高于500 m的地区,经常持续低温数天,导致杨梅树叶片、新梢、树干等受到严重冻害。杨梅适宜生长在年平均温度15~21 ℃的地区,温度低于-9 ℃超过48 h杨梅容易受到冻伤[1]。果园调查显示,杨梅受冻的临界温度为-8~-10 ℃,幼龄树比成年树受冻害严重,迟熟品种比早熟品种受冻害严重[2-3]。筛选出适合高海拔地区栽培的杨梅耐冻品种是杨梅产业的迫切需求,但是目前未见杨梅抗低温胁迫的理论研究,无法进行不同海拔和不同地区的果园品种规划,以及低温胁迫的预测预报和防控指导。
多种作物会受到低温的胁迫伤害。低温胁迫后柑橘叶片出现卷曲、失水、冻斑[4]。甘蔗植株受低温胁迫后叶片干枯、卷曲,生长点损伤或坏死变黑,蔗茎侧芽发黑、变软,纵剖蔗茎可明显看到茎内组织呈水煮状[5]。开花期低温胁迫导致水稻花粉萌发率显著下降,颖花的不育花粉率增加[6]。低温显著降低大豆单株粒重[7]。乌菜受低温胁迫后净光合速率、气孔导度和蒸腾速率均有不同程度下降[8]。
适宜的温度是植物生存的必要条件之一,它参与调控植物的整个生长发育过程。植物在受到低温胁迫时,多种生理生化过程与酶活性受到影响[9]。低温显著影响植物的细胞膜透性、活性氧保护酶活性、渗透性物质含量等,如柑橘[4]、枇杷[10]、柚木[11]、葡萄[12]、山榄科果树[13]等在受到低温胁迫后,相对电导率(REC)、过氧化物歧化酶(SOD)活性、丙二醛(MDA)含量、可溶性蛋白(SP)含量和可溶性糖(SS)含量等发生显著变化,通过隶属函数法综合分析细胞膜透性、活性氧保护酶活性、渗透性物质含量各生化指标能较好地评价不同品种材料的抗寒能力。低温还影响植物的糖代谢、碳代谢和一些次级代谢等,会使淀粉和其他代谢物的降解延迟,进而影响糖酵解和其他过程,使糖代谢相关基因的表达显著增加[14-15];脱氢酶和金属硫蛋白、泛素蛋白、休眠相关蛋白、质膜固有蛋白和RNA结合蛋白受低温诱导表达[16],产生次级代谢产物[17-18]。
本研究选择2个生产上主栽品种东魁、荸荠种,和1个新选育早熟品种早佳,利用1年生杨梅容器苗,在人工气候室内进行低温胁迫条件的模拟处理,观察不同品种植株的表型变化,研究低温胁迫下杨梅的生理生化响应,并且采用隶属函数法对不同杨梅品种进行抗寒性综合评价,以期为杨梅的抗低温育种、果园品种规划和低温胁迫机制研究提供参考。
1 材料与方法
1.1 材料
供试材料为东魁、荸荠种、早佳等长势一致的1年生盆栽杨梅嫁接苗。
1.2 处理设计
从2018年的12月至2019年的1月底进行低温处理。每盆为1次重复,每个处理重复3次。将试验材料全株带盆放入海尔程控冰箱,分别进行6 ℃(对照组)、3 ℃、0 ℃、-3 ℃、-6 ℃、-9 ℃处理24 h;然后选择成熟叶(去除主脉)迅速放入液氮中速冻,置于-80 ℃冰箱备用,测定生理生化指标。
低温处理后将植株移出程控冰箱,置于露天(平均温度6 ℃),观察1个月,然后调查植株冻伤级数。设植株无冻害为0级,有1个枝条死亡为1级,有2~3个枝条死亡为3级,有4~5个枝条死亡为5级,有6~7个枝条死亡为7级,有8条和以上枝条死亡为9级。冻害指数(IC)(%)=各冻害级数×该级植株数/调查总植株数×100。
1.3 测定方法
参照蔡庆生[19]的方法,采用DDS-310型电导仪法测定REC。
MAD含量采用丙二醛含量测定试剂盒(MDA-2-Y)(苏州科铭生物技术有限公司,苏州),按照试剂盒使用说明测定。SOD活性采用超氧化物歧化酶试剂盒(SOD-2-Y)(苏州科铭生物技术有限公司,苏州),按照试剂盒使用说明进行测定。SS含量采用蒽酮比色法[20]测定。SP含量采用苏州科铭生物技术有限公司BCA法蛋白含量测定试剂盒(BCAP-2-Y)进行测定。
1.4 抗寒性综合评价
应用隶属函数法[21]综合评价3个品种的抗寒性。SOD、SP和SS采用的公式为X(μ)=(Xij-Xmin)/(Xmax-Xmin);REC和MDA采用的公式为X(μ)=1-(Xij-Xmin)/(Xmax-Xmin)。其中,Xij为某指标的测定值,Xmax为对应指标的最大值,Xmin为对应指标的最小值,X(μ)为隶属函数值。先根据公式分别计算出3个品种各项指标的隶属度,然后取各项指标的算术平均值作为平均隶属度,进行综合排名,平均隶属度大代表抗寒性强。
1.5 数据分析
试验数据用Microsoft Excel 2010和SPSS 17.0进行计算和方差分析,显著性分析采用LSD多重比较。
2 结果与分析
2.1 低温胁迫对杨梅幼苗外部形态的影响
3个杨梅品种低温受伤害的趋势相同,轻则叶片黄化,重则出现枯斑或者叶片边缘变红,最后是叶片彻底干枯死亡。东魁对低温最敏感,荸荠种和早佳相似。东魁在6 ℃处理时个别嫩叶发黄无冻伤现象,经3 ℃处理叶片开始大量发黄并出现冻伤现象,随温度降低发黄程度逐渐加深,叶片受冻伤越来越严重,低于-6 ℃处理的叶片冻伤指数达到63.0,-9 ℃处理的冻伤指数达到100.0(表1,图1)。荸荠种在6 ℃和3 ℃处理后叶片翠绿,0 ℃处理后少许叶片开始发黄并有冻伤,随着处理温度的降低发黄程度逐渐加深,-9 ℃处理后完全死亡,冻伤指数达到100.0。早佳在6 ℃处理下叶片翠绿,3 ℃处理后叶片有轻微泛黄,0 ℃处理后少许叶片开始发黄有冻伤,随着温度的降低受冻程度逐渐加重,但-9 ℃处理后叶片残存少许绿色,冻伤指数达到92.6。由此可见,东魁杨梅幼苗在-3 ℃处理后即受到较严重冻害,而荸荠种和早佳在-6 ℃处理后受到较严重冻害,而且是不可逆的叶片坏死。
2.2 低温胁迫对杨梅幼苗叶片相对电导率的影响
由图2可知,3个杨梅品种的REC随着处理温度降低变化趋势不同,东魁和早佳的REC在实验温度内保持持续上升;而荸荠种-6 ℃处理下REC最大,随后下降。在6 ℃至-3 ℃处理中,3个杨梅品种的REC变化趋势一致,与6 ℃对照相比,差异不显著。-6 ℃处理后,3个品种的REC差异显著,与对照相比,荸荠种REC增大45.77百分点,达到峰值。东魁和早佳在-6 ℃处理下植株REC出现小幅增加,-9 ℃处理的植株REC大幅升高,与对照相比,分别增加37.4和26.88百分点。

表1 不同低温处理后恢复培养30 d杨梅植株的冻害指数

A、B、C行分别为东魁、荸荠种、早佳品种。a、b、c、d、e、f分别为6、3、0、-3、-6、-9 ℃处理的杨梅幼苗。图1 不同低温处理后恢复培养30 d的杨梅植株冻害情况
这说明荸荠种经-6 ℃处理后胞内电解质外渗严重,而东魁和早佳经-9 ℃处理后胞内电解质外渗严重。

图2 低温胁迫对杨梅幼苗相对电导率的影响
2.3 低温胁迫对杨梅幼苗丙二醛含量的影响
随着处理温度的降低,3个杨梅品种的MDA含量变化趋势不一致,东魁和早佳呈现降—升—降的趋势,而荸荠种则呈升—降趋势,在整个实验温度范围内荸荠种和早佳MDA含量高于东魁;6~-6 ℃处理后,荸荠种MDA含量高于早佳,早佳MDA含量高于东魁(图3)。与6 ℃对照相比,东魁的MDA含量在3~-3 ℃处理后下降,0 ℃和-3 ℃处理后显著降低,分别降低15.48%和23.46%;而-6 ℃和-9 ℃处理后MDA含量与6 ℃对照相比显著升高,分别升高26.18%和15.19%。与对照相比,荸荠种的MDA含量在其他温度处理下均有升高,其中3 ℃、0 ℃和-6 ℃处理后显著升高,增加范围在14.36%~38.27%,3 ℃处理的MDA含量最高。与对照相比,早佳在3、0、-3 ℃处理后MDA含量降低,3 ℃和0 ℃处理的下降显著,分别下降12.81%、11.5%;-6 ℃和9 ℃处理的MDA含量升高,其中-6 ℃处理的MDA含量最高,与对照相比增加14.1%。这说明,荸荠种受低温胁迫时细胞膜脂过氧化程度高,而东魁和早佳在-3 ℃及以上温度时膜脂过氧化程度轻,产生较少的MDA。
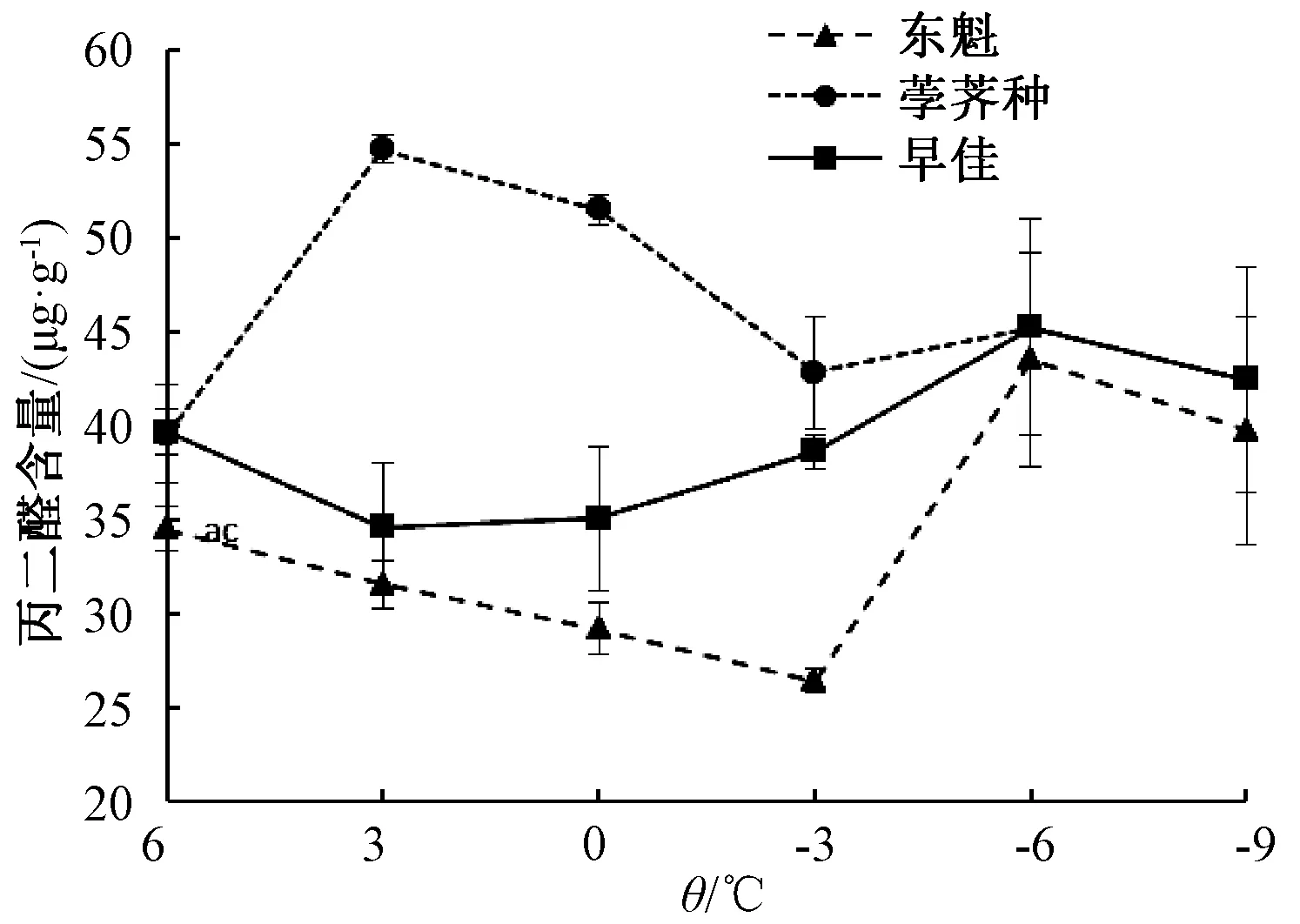
图中数据以鲜重计。图4~6同。图3 低温胁迫对杨梅幼苗丙二醛含量的影响
2.4 低温胁迫对杨梅幼苗抗氧化酶活性的影响
随着处理温度的降低,3个杨梅品种的SOD活性变化趋势不同,东魁呈升—降—升趋势,荸荠种呈降—升—降趋势,早佳总体保持下降趋势。整个试验温度内,早佳SOD活性均高于荸荠种;除-9 ℃处理外,早佳的SOD活性也均高于东魁(图4)。6 ℃对照组中,3个品种SOD活性差异显著,其中早佳SOD活性最高,显著高于荸荠种和东魁;荸荠种次之,东魁最低。东魁各处理组的SOD活性均比对照显著增加,比对照高出13.16%~37.6%,-3 ℃处理的SOD活性最大。荸荠种的SOD活性只有-6 ℃处理的植株比对照高10%,其他温度处理的SOD活性均比对照低,其中0 ℃、-3 ℃和-9 ℃处理比对照显著降低,低23%~34%。与对照相比,0 ℃和3 ℃处理的早佳植株SOD活性没有显著变化,-3 ℃时开始下降,-9 ℃处理的SOD活性最小。这说明早佳品种的SOD活性强于东魁和荸荠种,东魁品种SOD活性在低温胁迫下增强;而荸荠种SOD活性在低温胁迫下降低,受低温胁迫影响较大。

图4 低温胁迫对杨梅幼苗SOD活性的影响
2.5 低温胁迫对杨梅幼苗有机溶质质量分数的影响
随着处理温度降低,3个品种杨梅幼苗的SP含量变化趋势不一致,东魁和荸荠种呈升—降—升—降”趋势,早佳呈升—降—升—降—升趋势,且三者的峰值均不同(图5)。整个试验温度范围内荸荠种的SP含量始终高于东魁;6 ℃、3 ℃和-3 ℃处理的早佳植株SP含量高于东魁和荸荠种。经-6 ℃~3 ℃处理的东魁SP含量均显著高于对照,高11.56%~34.21%;-9 ℃处理的植株与对照无显著差异。在所有处理组中,荸荠种的SP含量均显著高于对照,高15.62%~57.73%,且0 ℃处理的植株SP含量最高。经3 ℃、0 ℃和-3 ℃处理的早佳植株SP含量高于对照,其中,-3 ℃和3 ℃处理的SP含量分别比对照组高42.63%和33.63%;-9 ℃和-6 ℃处理的SP含量显著低于对照,分别比对照组低15.61%和26.49%。这说明荸荠种的SP保护能力持续高于东魁,6 ℃、3 ℃、-3 ℃处理的早佳植株SP的保护能力强于东魁和荸荠种。
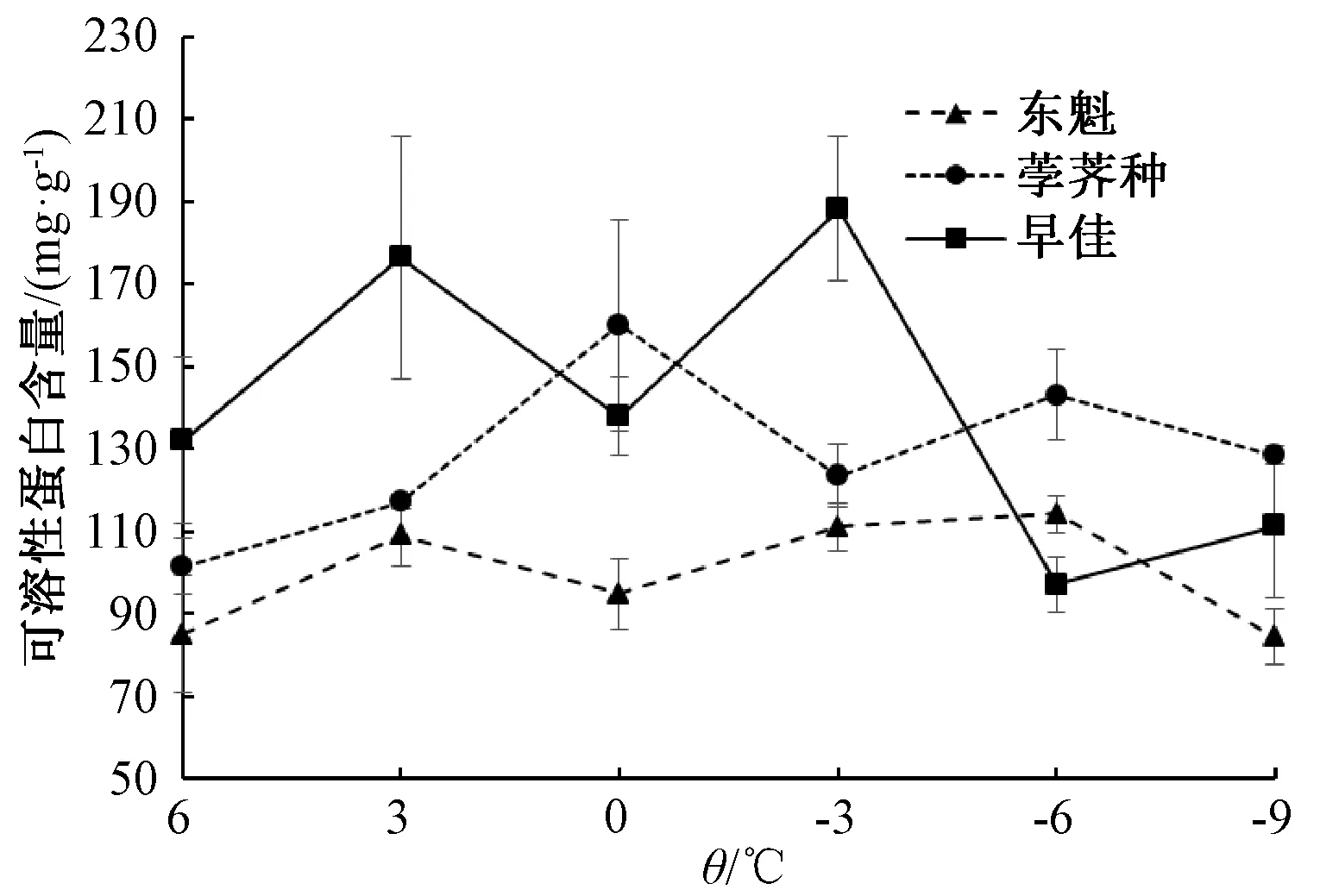
图5 低温胁迫对杨梅幼苗可溶性蛋白含量的影响
低温处理后3个品种杨梅幼苗的SS含量变化趋势基本一致,呈现先升后降趋势,但是出现峰值的时间和变化幅度不一样(图6)。东魁幼苗在3 ℃处理后SS含量出现最高,比对照组高12.8百分点,其他处理组与对照没有显著差异。荸荠种在0 ℃处理后植株SS含量最大,0 ℃和3 ℃处理SS含量显著高于对照,分别高16.57百分点和10.53百分点;温度低于-3 ℃后,各处理的SS含量与对照无显著差异。3、0、-3 ℃处理的早佳SS含量与对照差异不显著,而经-6 ℃和-9 ℃处理的SS含量显著低于对照,分别低17.94和9.10百分点。

图6 低温胁迫对杨梅幼苗可溶性糖含量的影响
2.6 杨梅幼苗抗寒性综合评价
应用隶属函数法对杨梅抗寒性生理指标进行综合分析,其中REC、MDA的隶属函数值由反隶属函数公式求得。东魁、荸荠种、早佳的平均隶属度为0.482、0.520、0.576。由表2可知,不同品种抗寒性强弱顺序为早佳>荸荠种>东魁。该结果与杨梅低温胁迫的表型数据相吻合,说明隶属函数法能客观评价不同杨梅品种的抗寒性。

表2 低温胁迫下3个品种杨梅各指标隶属函数值与抗寒性综合评价
3 小结与讨论
低温胁迫是重要的非生物胁迫之一,影响植物的生长、繁育、产量、质量与地理分布等。前人研究发现,低温胁迫对植株表型有很大影响,植物受损的直接表现有萎蔫、叶片呈水渍状、果实出现斑点、苗木变弱、生长迟缓、黄化、产量下降、品质降低和局部组织坏死等[22]。本文研究发现,杨梅幼苗受低温胁迫后,症状较轻时叶片黄化,稍微严重时叶片出现枯斑或者叶片边缘变红,严重时叶片彻底干枯死亡,与前人报道一致。
低温损害后植物体内不断积累活性氧自由基,引起膜脂过氧化。MDA是膜脂过氧化作用的主要产物之一,导致质膜透性增大,胞内电解质外渗,引起相对电导率升高,REC的高低和MDA含量表明了细胞膜受损伤的程度,与耐寒性呈负相关;SOD和过氧化氢酶(CAT)等可消除活性氧自由基,减轻植物受到的氧化胁迫损害,与耐寒性呈正相关;SP和SS降低了渗透势,减缓因低温导致的细胞失水,一定程度上减轻了植物的低温伤害,与抗寒性综合评价呈正相关[11,22-25]。东魁和早佳杨梅的REC随着温度降低保持持续上升趋势,这与其他植物相似[23,25],但是荸荠种却是先升后降,与前人报道不同。这说明不同杨梅品种在受低温伤害临界值时胞内电解质外渗不但受低温影响,还受自身生理生化等其他因素的影响。
单一抗寒指标不足以判断植物对逆境的适应能力,采用隶属函数法进行综合评价结果更为可靠[4-5,26]。在0 ℃、-2 ℃和-4 ℃处理24 h,随着处理温度降低,不同柑橘品种的MDA含量均呈现显著降低趋势,SS含量呈先升高后降低趋势[4]。在0~-25 ℃低温下胁迫2 h,6种木兰科植物叶片SP含量和SOD活性呈先升高后降低的趋势[26]。-12~-27 ℃低温处理葡萄1年生枝条24 h,随着处理温度下降,所有处理葡萄枝条SS含量先上升后下降,SOD活性呈升高—降低—升高—降低的趋势[12]。3~-5 ℃低温处理24 h,随处理温度降低,各品种枇杷幼果种胚REC呈现小—大—小的S型变化曲线,6个枇杷品种的MDA含量随低温胁迫均呈现出先升高后降低的倒V型变化趋势[10]。3个杨梅品种的MDA含量、SOD活性、SP和SS含量变化趋势表现较为复杂,与木兰、葡萄、枇杷和西番莲等个别指标类似。这些植物不同生理生化指标的趋势差异很可能是因为植物本身对温度的敏感性不同,涉及低温胁迫温度不同引起的。在3~-3 ℃处理下,早佳和东魁的SOD活性较强,清除活性氧免受伤害的能力强于荸荠种,-3 ℃及以上温度处理时膜脂过氧化程度轻,产生较少的MDA,胞内电解质外渗少,这说明SOD活性对早佳和东魁的抗寒性很重要,但是荸荠种可能有其他作用更强的活性氧清除酶。荸荠种SP的保护能力持续高于东魁,这说明SP对荸荠种的抗寒性有较为重要的作用。当温度低于-3 ℃时,3个杨梅品种的SS含量都较低,这说明温度过低SS失去了对杨梅的保护作用。采用REC、MDA、SOD、SP和SS的隶属函数法评价3个杨梅的抗寒性结果与表型结果一致,因此,这5个指标可以作为杨梅抗寒性评价的关键指标。
喷施一些抗冻物质可以调控植物受到低温胁迫后的生理生化反应,提高植物的抗寒性,如EBR(24-表油菜素内酯)[27]、防冻剂[28]、生物刺激素PVE (paecilomyces variotiiextracts)[29]、外源一氧化氮(NO)供体硝普钠(SNP)[30-31]和ABA[32]等。当环境温度低于3 ℃时,建议及时给杨梅喷施抗冻物质,可能会有效减轻杨梅尤其是高山杨梅受到的低温伤害。目前已有报道一些基因与功能蛋白参与植物的低温胁迫[33-35],但是研究尚不够深入。今后应挖掘诱导杨梅冷驯化和耐寒能力的关键基因,尤其是SS代谢相关的基因,利用现代生物技术手段,有目的地提高杨梅的抗寒性,为耐寒性强杨梅种质资源的良种选育与新品种创制提供基础,扩大杨梅的栽培范围。
本文研究结果说明杨梅的抗寒机制十分复杂,不能采用单一生理生化指标进行抗寒性评价,隶属函数法评价的抗寒性与低温受害表型一致,说明REC、MDA、SOD、SP和SS可以作为综合评价杨梅抗寒性的关键指标。本研究填补了杨梅抗寒性理论研究的空白,不足之处是未就参与低温胁迫的关键基因和功能蛋白进行研究,未就增强杨梅抗冻性的物质进行筛选。
