H2O2强化光催化处理苯胺化工废水的应用试验
2020-12-07张华张子鹏张澜澜张晓飞刘译阳
张华,张子鹏,张澜澜,张晓飞,刘译阳
(1中国石油集团安全环保技术研究院有限公司,北京102206;2中国石油天然气集团有限公司科技管理部,北京100007;3中国石油吉林石化公司电石厂,吉林吉林132022)
苯胺是多种化工产品的原料,需求量大,美国和中国每年生产苯胺量平均为80000t 和457000t,导致很多企业排放的工业废水中均含有苯胺[1]。苯胺是典型的环境污染物,具有很强的生物毒性、蓄积性和长期残留性,被美国EPA 和中国环保部列入“环境优先污染物黑名单”,要求严格控制其在工业排水中的浓度[2-3]。炼化企业苯胺生产装置排放的苯胺废水浓度高[4],呈棕黄色,色度高至1500倍(稀释倍数),化学需氧量(COD) 高达1200mg/L,带有强烈的刺激性气味。这种物质浓度为1mg/L时就能抑制自养型硝化菌生长,从而对氨氧化作用的抑制率达50%[5]。传统的活性污泥法并不能有效处理苯胺废水,当用活性污泥降解苯胺时,生成的苯胺衍生物难以生物降解,反而会抑制活性污泥对其他污染物的降解[1,5-6]。
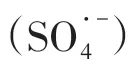
近年来,电化学废水处理技术的应用研究越来越广泛,如阳极氧化与间接电氧化常被用于有毒、难生物降解废水的处理[14]。Brillas 和Mur[15]研究发现,阳极氧化对苯胺废水的矿化率低,但利用碳/聚四氟乙烯充氧阴极(Ti/Pt/PbO2为阳极)产生的H2O2结合Fe2+溶液形成电芬顿反应,可显著提高苯胺废水的矿化率。当同时应用紫外辐射(λ=360nm)时,苯胺废水的降解速率更高[15]。但电芬顿极板材料、电能消耗等成本较高,同样限制了其工业应用[16]。光化学技术被认为是环境友好、低成本、可持续的绿色技术[17],逐渐成为废水处理领域的研究热点[18]。研究发现,自然界中微咸水中的苯胺在太阳光作用下的半衰期为27h,而微生物作用下的半衰期为173h,且光解产物更容易生物降解[19]。光催化技术中O3/UV、H2O2/UV、TiO2/UV 及其他金属催化UV 等是应用最为广泛的光催化类型[20-21]。Benito 等[13]对比了UV/H2O2与电化学氧化(硼掺杂金刚石电极)两种技术对苯胺废水的处理效果,发现苯胺的矿化率均高于85%,降解过程涉及两种途径,一是苯胺直接矿化至CO2、H2O 和硝酸盐,二是生成高分子量聚苯胺等中间产物。综合分析UV/H2O2、UV 与电化学氧化对苯胺废水的处理成本,其中UV/H2O2的单位电能消耗最低,为电氧化成本的69.6%,如表1所示[13]。
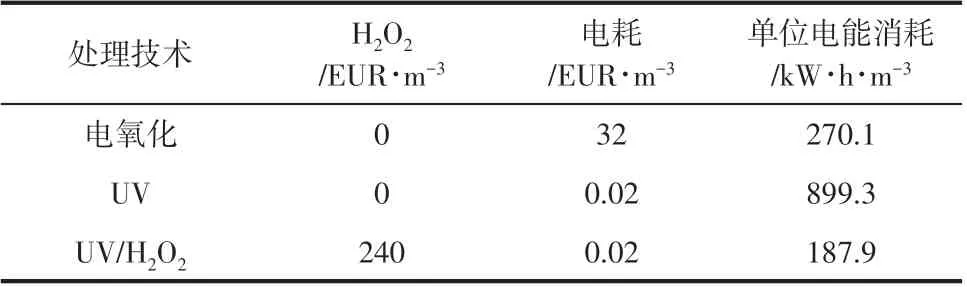
表1 电氧化、UV与UV/H2O2处理苯胺废水的能耗与成本对比[13]
虽然UV/H2O2处理苯胺废水效果显著,但目前仍停留在实验研究阶段,且主要针对苯胺模拟废水,无法预见该技术的应用前景。为了验证UV/H2O2光催化技术对含苯胺废水处理的可行性与适应性,本研究搭建了一套1~2m3/h 的光催化装置,并在典型炼化企业开展了苯胺废水处理现场试验验证。TiO2是光催化技术最常用的催化剂[17,21],本现场试验利用悬浮态TiO2(P-25),解决了紫外线利用效率低、穿透性差的问题,进一步降低反应过程的能耗。通过优化装置设计使得废水在反应器内部形成湍流,提高传质效率,并组合陶瓷膜超滤装置回收催化剂,减少催化剂流失,降低实际工程设备投资及运行成本。
本现场试验是对光催化技术研究成果的应用验证,并基于理论与实际相结合,进一步推动光催化技术在苯胺废水等难降解废水处理中的工业化应用。
1 材料和方法
1.1 试剂与材料
某炼化企业苯胺生产过程中产生的苯胺废水为20~30m3/h,COD为700~1100mg/L,色度为1000~1500倍,电导率为22~26mS/cm,pH为6~8。
H2O2[30%(体积分数)]和盐酸(HCl,30%)为化学纯,其中HCl 配制成15%使用;TiO2(P-25)为纳米级粉状,购自北京德科岛金科技有限公司,比表面积48m2/g,平均粒径25nm。
1.2 试验方法
试验装置流程如图1所示,该试验装置为一体化设备,整体布置于集装箱内。所有试验在室温(25℃±5℃)下进行,处理规模1~2m3/h,可实现工程放大。苯胺废水经提升泵输送至缓冲水箱,经聚丙烯纤维(PP)棉微滤后,进入UV催化装置,出水经超滤分离后根据水质情况可部分回流至缓冲水箱,超滤所截留催化剂经回流泵混合至出水回流管线。大部分试验在酸性条件下进行,即在进水提升泵后投加HCl 溶液调节废水pH,并在PP 棉微滤后投加H2O2。
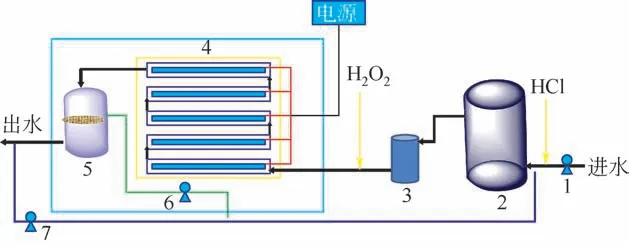
图1 工艺流程示意图
TiO2作为催化剂,带隙为3.2eV,激发TiO2催化性能所需UV波长不大于380nm[21]。Backlund[22]认为UV 波长在200~310nm 时杀菌、降解有机物作用更强。因此本装置配备紫外灯的主波长选择254nm。单个紫外反应器长1.5m,功率为150W,共有80 组紫外反应器串联,能够单独控制开启,可根据进出水水质调节紫外反应器的启用数量。超滤选用陶瓷膜,膜两侧压差为10psi (1psi=6894.76Pa)时,通量可达到2m3/h,能够实现催化剂完全回收利用。该光催化一体化装置为全自动数显控制,方便试验与维护。
本现场试验采用TiO2/UV-H2O2协同氧化处理苯胺废水,采取间歇与连续运行模式,并对比单独TiO2/UV 和单独H2O2氧化的效果,考察色度和COD去除效率。
具体实验步骤如下。①单独TiO2/UV 试验。向缓冲水箱中注入废水,投加TiO2催化剂,开启UV灯,以内循环的间歇运行模式考察处理效率。②单独H2O2试验。向缓冲水箱中注入废水,以盐酸溶液调节进水pH,并投加H2O2,运行间歇运行模式,考察不同pH 时的处理效果。③TiO2/UV-H2O2协同氧化试验。在反应系统中,以盐酸溶液调节进水pH,同时投加TiO2催化剂、H2O2,开启UV 灯,通过间接运行与连续运行模式考察处理效率。
本研究中,每组实验平行2次,检测数据取平均值进行分析。由于现场试验所处理对象为实际废水,数据偏差范围为±10%。
1.3 分析方法
现场试验不同于室内实验,由于无大型分析仪器,难以对苯胺及其衍生物、降解中间产物定性定量分析。因此选择更加快速与便捷的检测手段,跟踪现场试验的运行效果,并及时调整工艺参数。
色度的测定方法如下。
方法一:利用稀释倍数法测定实际废水的色度。
方法二:利用分光光度计(U-3010 型,日本日立公司)测定465nm 处的可见光吸收值E465。苯胺及其衍生物中含有带取代基的苯环或聚合苯环结构,其“π-π”电子跃迁在254~280nm之间有明显吸收,如254nm 的紫外吸收E254和265nm 的紫外吸收E265[22]。废水色度增加,E465随之增加,二者呈现较好的线性关系(R2=0.99),因此可以利用E465代替色度。
采用水质多参数分析仪(美国哈希公司)测定pH、电导率和氧化还原电位(ORP);采用COD测定仪(DR/2400型,美国哈希公司)测定COD。
2 结果与讨论
2.1 单独TiO2/UV与单独H2O2氧化
2.1.1 单独TiO2/UV
向缓冲水箱中注入容积为75%的苯胺废水(约50L),加入催化剂TiO2约1g/L,启动间歇循环运行模式,即出水完全回流至缓冲水箱。在1h内,COD 去除率30%,色度去除率15%,难以满足COD≤100mg/L、色度≤100 倍的处理目标。Benito等[13]对模拟苯胺废水进行UV处理4h后,苯胺和溶解性有机物的去除率分别为42.0%和27.5%。
2.1.2 单独H2O2氧化
分别调节废水初始pH=2~10,投加H2O2量0.5%(体积分数),反应1h后,取样分析废水的电导率和ORP,如图2(a)所示,其中插入图为不同初始pH 时的E254和E465变化情况。可见,较低pH 时废水的ORP 和电导率都较高,出水也具有较低的E254和E465(E254和E465变化基本一致)。ORP 降低表示氧化能力减弱,电导率降低则代表苯胺被降解生成NH4+、NO3-等离子的效率降低[13]。中性条件时,E254和E465值较高,但当初始pH升高至8后,E254和E465又会呈现降低趋势。综合来看,酸性条件时利于氧化分解苯胺废水[23],此时体系的氧化能力最强,苯胺等有机物被离子化程度也最高,这与其较低的E254和E465变化一致。
因此,调节废水pH=2~4,考察酸性条件下H2O2投加量对色度去除的影响,其中H2O2投加量为0.5%、1%、2%、3%和4%,其E465变化如图2(b)~(d)所示。一般来说,投加量低于2%时,E465随投加量的增加逐渐降低,但继续增加H2O2,E465变化不大。而反应24h后,E465反而在高于3%的投加量时呈现增加趋势。因此,单独进行H2O2氧化时H2O2最佳投加量为2%,但即使在最佳条件下反应24h时,苯胺废水的色度去除率也仅为60%。
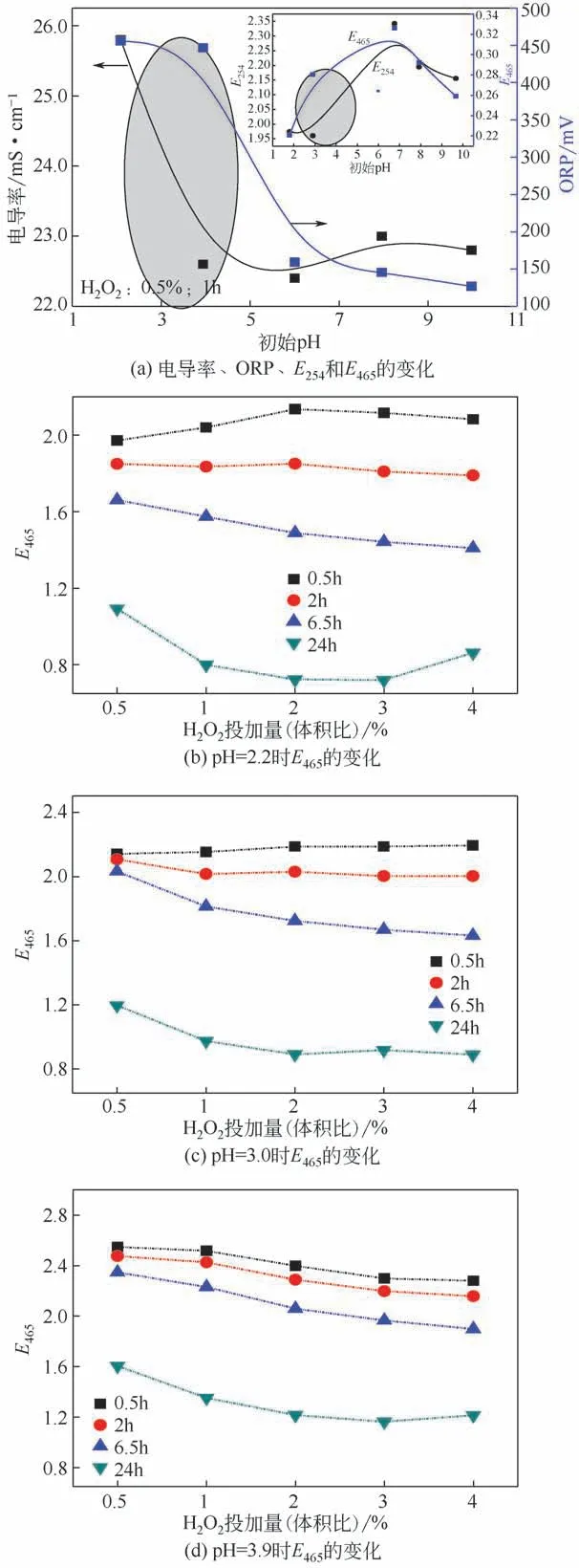
图2 不同初始pH时H2O2投加量和反应时间的影响
综上所述,单独TiO2/UV和单独H2O2氧化对苯胺废水具有一定的降解作用,酸性条件更利于H2O2氧化反应,但单独作用程度低、速度慢,因此可以考虑TiO2/UV与H2O2的协同氧化作用。
2.2 TiO2/UV-H2O2协同氧化
2.2.1 H2O2投加方式
利用自动循环模式,在250L 原水中投加2.5L H2O2(投加量1%)、80g 催化剂,未调节原水pH。考察了两种H2O2投加方式,一种为开始反应时H2O2直接投加,另一种为分段投加,开始反应时投加700mL H2O2, 20min 时 再 投 加600mL H2O2,40min 时 再 投 加600mL H2O2,60min 时 再 投 加600mL H2O2。综合分析,在保证一定的COD 与色度去除方面,直接投加方式更便于操作。
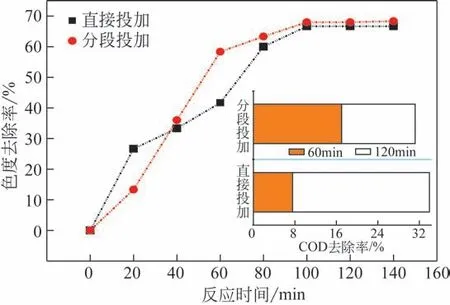
图3 直接投加与分段投加H2O2时色度与COD去除率的变化
H2O2与TiO2/UV 协同作用时,能够促进·OH 的生成,H2O2浓度越高,在反应中消耗的H2O2量也越大,因此产生的·OH浓度越高[13],使得直接投加方式在前40min脱色效率较高。但H2O2既是·OH的发生剂又是消耗剂,当H2O2饱和甚至过量时,会与·OH 生成HO2·,导致·OH 浓度降低,降解苯胺废水的能力也下降[13]。而两种投加方式对色度和COD 去除的影响并不一致,这也表明苯胺被氧化降解直至矿化经历了一系列过程:苯胺等芳香类物质的发色官能团首先被破坏,色度降低,并生成仍然具有芳香结构的中间产物,随着·OH 的继续氧化,中间产物如有机酸类被矿化生成CO2和H2O。
图4(a)为反应过程中pH 的变化,可见,H2O2与TiO2/UV 协同作用过程导致pH 降低,表明酸性中间产物及CO2酸性气体的生成[13,24],而且相较分段投加,直接投加后pH 降低更为明显,这与其较高的COD 去除率一致。图4(b)为反应过程中ORP与电导率的变化。当体系中加入H2O2后,ORP 升高,并在60min内达到最高,随后相对稳定,且直接投加H2O2后ORP 相对较高,表现出较高的氧化能力[13]。此外,苯胺废水原水电导率为22mS/cm,含盐量高,相比直接投加H2O2,分段投加后电导率升高明显,即废水中的离子浓度增加,但由于COD 矿化率低,因此可以推断电导率的增加主要为有机物离子化。
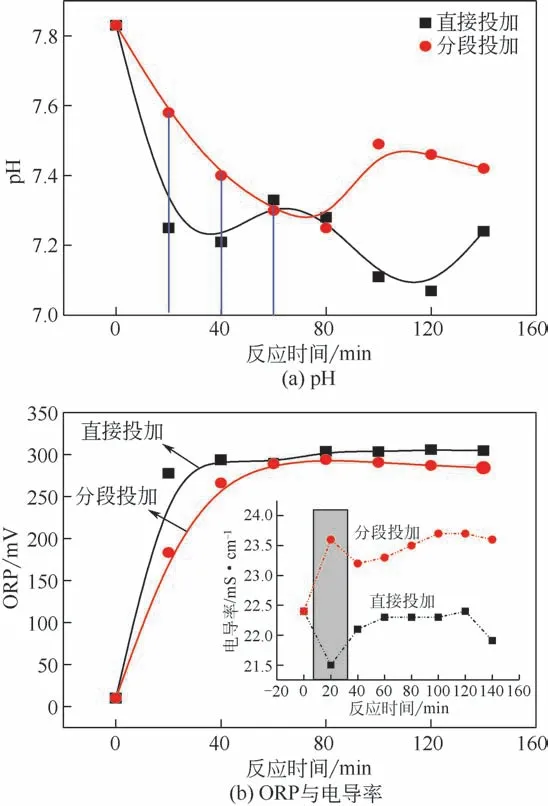
图4 直接投加与分段投加H2O2时体系指标随反应时间的变化
分段投加较直接投加时色度去除率稍高,但有机物矿化率的差异则相反,因此为方便处理工艺操作,选择直接投加的方式。
2.2.2 pH调节
单独H2O2氧化降解苯胺废水时,H2O2投加量达2%时色度的去除率仍然较低。H2O2与TiO2/UV协同作用可激发H2O2产生更高浓度的·OH。为进一步优化工艺参数,选择H2O2投加量为2%,考察酸性条件对组合工艺协同处理苯胺废水的影响。采用间歇运行的循环模式,苯胺废水60~80L,以盐酸分别调节pH 为2.2、3.08、4.16 和5.28,考察苯胺废水的降解效率,其中加入60g催化剂,H2O2投加量为1.2L(体积投加量约2%)。
图5(a)~(d)分别为不同pH时COD去除率、E254、E265和E465(色度)变化趋势。由图5(a)可见,初始pH为2.2~4.16 时,TiO2/UV-H2O2协 同 氧 化30min 后COD 去除率>90%,反应60min 时矿化率变化不大,但均高于94%;而初始pH=5.28 时的处理效果相对较差,至60min 时COD 去除率仍低于90%。代表芳香结构的不饱和度E254和E265随反应时间逐渐减弱,且变化趋势基本一致,其中初始pH=4.16时E254和E265降低最为显著。E465代表废水的色度,其去除速率较快,即20min 内脱色效率即可达到95%以上,而初始pH=5.28 时的脱色效果最差。从COD 与E465数值还可以看出,不同实验条件下,当E465<0.025时,COD<50mg/L。

图5 不同初始pH时COD与吸光度的变化趋势
据文献报道,H2O2在水溶液中发生的解离反应如式(1)和式(2)所示,酸性条件利于H2O2分解产生·OH;TiO2/UV 反应时·OH 的产生方式如式(3)~式(6)[25]所示,即碱性条件利于光催化自由基的产生。但在TiO2/UV-H2O2协同处理苯胺废水时,紫外线促进了H2O2产生·OH 的反应,H2O2的氧化降解作用显著提升,如式(7)所示[24]。可以推断,TiO2/UV-H2O2协同作用时,酸性条件更加利于有机物的降解,其中H2O2的氧化降解作用尤为显著。

TiO2/UV-H2O2协同反应后,废水的电导率升高,图6(a)为不同初始pH时电导率增加值(Δ电导率)变化趋势。可以看出,初始pH=2.2 时30min内Δ电导率明显增加,但随后回落,与pH=3.08和pH=4.16 时的变化相近。图6(b)为不同初始pH 时ORP 的变化趋势。加入H2O2后,ORP 升高,随着启动UV开始反应,ORP呈现阶段性升高与降低的趋势,这也反映出氧化体系浓度的变化,即初始阶段积累自由基等氧化剂,随之消耗氧化剂改变有机物结构直至矿化。其中,初始pH=4.16时的ORP变化幅度最大,60min 后降低最为明显,这也与其E254和E265去除程度相一致。
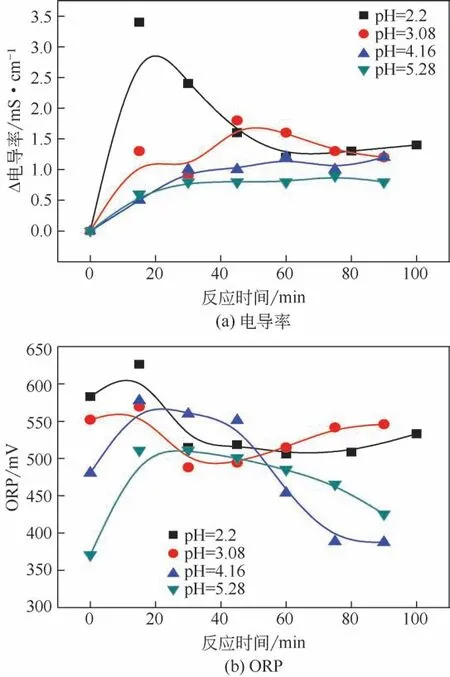
图6 不同初始pH时电导率与ORP的变化趋势
综合来看,pH=2.2 强酸条件下并未表现出比pH=3.08 和pH=4.16 时更好的处理效果,一方面,因为H+浓度过高也会抑制·OH 的产生,从而影响废水处理效率;另一方面,pH 过低,不利于TiO2/UV 降解苯胺废水。因此,对于TiO2/UV-H2O2协同作用处理苯胺废水,基于降低药剂成本、避免管道腐蚀等考虑,选择最佳pH为3.8~4.2。
图7为初始pH=4.16时反应时间对出水COD与pH 的影响,其内插图为ORP 随反应时间的变化趋势。可以看出,反应15min 时COD 降至20mg/L,随后COD 变化趋缓。废水pH 随着反应时间呈现降低趋势,在反应60min 时降至最低,随后升高,但均低于初始pH,这也表明苯胺降解过程中生成的酸性物质导致了体系pH 降低。而且反应15min时,ORP 升高,此时COD 去除率达95%,随后ORP 逐渐降低,COD 变化也趋缓。这表明反应体系的氧化剂仍被消耗,一方面体系中残留的有机物持续被降解,直至矿化;另一方面,体系中的氧化剂自身分解,导致氧化还原电位降低,如式(8)所示。

图7 pH=4.16时不同反应时间出水的COD、pH与ORP变化
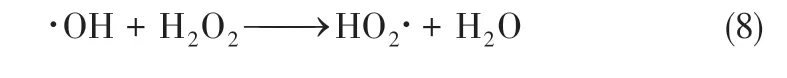
2.2.3 TiO2/UV反应时间
由以上实验分析发现,苯胺废水经过TiO2/UV-H2O2氧化后,其色度物质仍然会在残余H2O2的作用下继续分解,而单独H2O2对苯胺废水的降解作用并不显著,因此可以推断初始阶段时苯胺废水中有机物逐渐被降解为能被H2O2直接矿化的中间产物。为验证光催化及其反应时间对H2O2氧化作用的促进作用,设计了以下两组试验。
(1)苯胺废水60~80L,未调节pH,内循环后pH约7.57,催化剂60g,H2O2投加量1.2L(体积投加量约2%)。光催化0.5h 后,停用UV 灯,考察中间产物及剩余COD 在H2O2作用下的去除情况,结果如图8(a)所示。可见,未调节pH 时,TiO2/UV-H2O2氧化效果差,但UV 灯关闭后,色度仍有一定程度的去除。

图8 UV灯开启(on)与UV灯关闭(off)时各参数的变化情况
(2) 调节苯胺废水pH=4.24,体积60~80L(缓冲罐容积的55%~56%),H2O2投加量1.2L,UV 灯在25min 后停止,结果如图8(b)所示。可见,UV 灯在反应25min 时停止,出水E465为0.0579,色度去除率为97%;UV灯停止后,E465持续降低,放置1h 后,E465降为0.0127,色度较25min 时出水降低78%,与原水相比,色度<15 倍,去除率为99.3%。因此,可以适当缩短UV 灯停留时间,使用UV 间歇模式,凭借残留氧化剂与中间产物反应,进一步实现脱色降解。这再次表明TiO2/UVH2O2协同处理苯胺废水时部分物质在·OH活性物质的氧化作用下矿化,同时还生成一些中间产物,而这些中间产物能被残余的H2O2直接矿化。
鉴于现场试验条件限制,本次实验无法检测出水中H2O2浓度,难以获得H2O2实际消耗量数据。Benito 等[13]利用UV/H2O2处理苯胺模拟废水时,发现H2O2投加量分别为1g/L、2.5g/L 和5g/L 时,H2O2消耗率分别为24.98%、47.74%和87.53%,对应模拟废水的COD 去除率分别为56.26%、77.02%和83.20%。本现场试验中,H2O2理论投加量约6g/L(商品H2O2按照30%计算),有机物去除率>90%,可以推断用于有机物降解的H2O2消耗率≥88%。
2.3 TiO2/UV 和H2O2协同降解苯胺废水的机理与运行成本
2.3.1 降解途径分析
苯胺废水中有机污染物种类多,主要为苯胺和硝基苯等。苯胺和硝基苯在高级氧化处理过程中的降解基本都依赖·OH 等活性物质的氧化作用[9,13,26]。当TiO2/UV 和H2O2协同作用时,H2O2在紫外线辅助下快速产生·OH,促进了苯胺和硝基苯的降解、矿化。其可能的降解途径如图9 所示[2],苯胺和硝基苯首先被氧化取代生成苯酚,继而生成苯二酚,这需要足够的·OH,属于强氧化阶段,这也是TiO2/UV 和H2O2协同比单独反应矿化程度更高的原因,其中H2O2在紫外线激发下产生的·OH 是主要的活性物质;随后在·OH 的作用下,生成醌类、羧酸类等中间产物,最后矿化为CO2和H2O。因此,在TiO2/UV 和H2O2协同作用一段时间后,停止UV 而凭借残余H2O2或者O2可以将体系中的中间产物继续降解直至矿化,大大节约能耗。
2.3.2 优化工艺与经济性分析
当利用TiO2/UV-H2O2协同处理该石化企业苯胺废水时,为进一步实现出水COD≤60mg/L、色度≤20 倍,可设计以下方案:以15%的盐酸调节pH=3.8~4.2;TiO2/UV-H2O2协 同 反 应 区 停 留 时 间 约20min,装置回流比约50%,一方面提高反应效率,另一方面在管内形成湍流,提高传质、降低结垢;H2O2总投加量体积比约2%,最初投加量约5L/h,随着回流,投加量可降低至2L/h;出水置于缓冲罐中,其最小停留时间为30min,可充分利用体系中残余的H2O2。
本工艺的运行成本CT包括盐酸、H2O2试剂费用Cagent,TiO2催化剂费用Ccat,电耗Cenergy,基于COD 去除的单位电耗EEO 用于不同处理技术的对比与评价[13],见式(9)、式(10)。
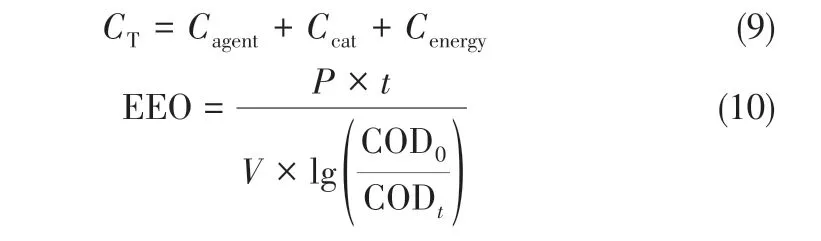
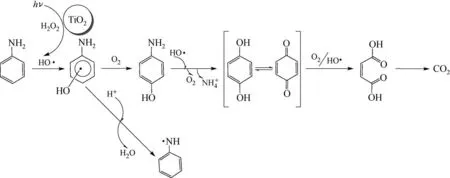
图9 TiO2/UV-H2O2协同氧化时苯胺废水中主要污染物可能的降解途径
式中,P 为输入功率,kW;t 为反应时间,h;V 为废水体积,m3;COD0为废水初始COD;CODt为反应t 时间后的COD。处理规模1m3/h,回流比50%,实际处理量0.5m3/h,COD去除率95%;P根据UV 灯管150W×80 根计算,盐酸(15%)3L/h,H2O2平均为3L/h,催化剂可回收利用,平均每24h补充100g。按市场价格计算,盐酸(15%) 约75CNY/t,H2O2(30%)约1400CNY/t,催化剂约32CNY/kg,工 业 用 电 约1.0CNY/(kW·h),计 算如下:
(1)Cagent=0.45CNY/m3废水(盐酸)+8.4CNY/m3废水(H2O2)=8.85CNY/m3废水;
(2)Ccat=0.27CNY/m3废水;
(3)Cenergy=24CNY/m3废水;
(4)CT=Cagent+Ccat+Cenergy=33.12CNY/m3废水;
(5)EEO=18.44kW·h/m3。
本TiO2/UV-H2O2工艺协同处理苯胺生产废水的总成本为33.12CNY/m3废水,主要为电能消耗与H2O2试剂费用。相对于COD 去除的单位电耗EEO为18.44kW·h/m3,远远低于Benito 等[13]对模拟苯胺废水UV/H2O2处理时的187.9kW·h/m3。
3 结论
目前,研究者大多以苯胺模拟废水为对象开展相关高级氧化处理技术研究,但针对炼化企业苯胺装置产生的实际废水研究较少,更鲜少开展工程应用。本研究搭建了1~2m3/h 光催化中试装置,通过现场试验并基于理论与实际相结合,进一步推动光催化技术在苯胺废水等难降解废水处理中的应用。
(1)炼化企业苯胺废水色度高、含盐量高,难以生物降解,单独TiO2/UV和H2O2氧化对苯胺废水的处理效果较差,而两者协同氧化苯胺废水时其脱色率与矿化率分别达到99%与95%以上,酸性条件特别是pH=3.8~4.2 有助于TiO2/UV-H2O2的协同作用。
(2)TiO2/UV-H2O2协同作用时,·OH 产生量大,属于强氧化阶段,为降低能耗,可适当降低H2O2的投加量和缩短光催化时间,利用残余的H2O2继续将中间产物矿化。最佳工艺条件为:初始pH=3.8~4.2;TiO2/UV-H2O2协同反应区停留时间约20min,装置回流比约50%;H2O2总投加量体积比约2%,最初投加量约5L/h,随着回流,投加量可降低至2L/h;出水置于缓冲罐中,其最小停留时间为30min,可充分利用体系中残余的H2O2。
(3)TiO2/UV-H2O2协同氧化降解炼化企业苯胺废水,可实现COD≤60mg/L、色度≤20 倍的达标外排要求,技术可行。现场试验总运行成本约33.12CNY/m3废水,主要为电能消耗与H2O2试剂费用,可通过工艺优化进一步降低运行成本,相比其他技术具有经济优势。
