hBD-3在口腔黏膜下纤维性变癌变过程中的表达研究
2020-12-07杨琴杜永秀翦新春杨晨希徐普
杨琴 杜永秀 翦新春 杨晨希 徐普
口腔黏膜下纤维性变(oral submucosal fibrosis,OSF)是一种慢性进行性具有癌变倾向的黏膜炎性疾病,其病因不明,可能与咀嚼槟榔、免疫失调、胶原代谢紊乱、细胞自噬水平异常等有关[1-2]。Pindborg等[3]报道OSF癌变率约为7% ~13%,并提出OSF与口腔癌共存时实际上是OSF癌变所致。目前关于OSF癌变机制尚不明确。人β-防御素-3(human β-defensin-3,hBD-3)是先天性免疫系统的重要组成部分,具有多种生物学活性,在炎症性疾病、损伤修复、局部免疫调节以及肿瘤形成和转移中均发挥重要的作用[4]。已有学者证明hBD-3在多种口腔黏膜癌前病变及口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)中呈高表达,认为其可能参加这些病变的发生及转归[5-7]。但有关其在OSF中的研究未见报道。本实验试图通过免疫组织化学及实时荧光定量PCR的方法从基因和蛋白水平上检测正常口腔黏膜、OSF及伴OSF口腔鳞癌组织中hBD-3的表达水平,探讨hBD-3在OSF的发生及其癌变过程中的作用。
1 材料与方法
1.1 研究对象
选取2017 年9 月~2018 年12月在中南大学湘雅医学院附属海口医院口腔医学中心就诊及住院的OSF患者22 例,伴OSF的口腔鳞癌患者13 例。对照组选取10 例正常的口腔黏膜,取自该院口腔外科拔除埋伏阻生牙的健康口腔黏膜,患者无咀嚼槟榔史。所有的新鲜组织用生理盐水冲洗后分为2 份:一份置于-80 ℃低温冰箱保存,另一份送往病理科石蜡包埋行HE染色确诊。所有病例术前未经激光、放疗、化疗和局部药物注射等治疗,无其他系统性疾病。本研究已通过医学伦理审查。
1.2 主要实验试剂
兔抗人hBD-3多克隆抗体(NOVUS,美国);即用型快捷免疫组化Max VisionTM试剂盒(福州迈新生物技术有限公司);RNA抽提试剂(Invitrogen,美国);Prime ScriptTMRT reagent Kit with gDNA Eraser、TB GreenTMPremix Ex TaqTMII(TB.Ⅱ,Takara,日本);GAPDH内参、hBD-3引物(上海生工生物技术有限公司)。hBD-3引物序列(上游5'-TTCTGTTTGCTTTGCTCTTCCTG-3',下游5'-ACTTGCCGATCTGTTCCTCCTT-3')。
1.3 检测方法
1.3.1 免疫组织化学 石蜡包埋的待测组织切片脱蜡水化,3%的过氧化氢甲醇中孵育10 min,柠檬酸钠高压锅修复,山羊血清封闭10 min,滴加hBD-3一抗(1∶400)后4 ℃过夜,二抗孵育15 min,DAB显色,复染,脱水,透明,封片,显微镜下观察并拍照。用银屑病石蜡块做阳性对照,PBS代替一抗作空白对照,根据参考文献[8]对标本进行评分:①阳性细胞比例打分:<5%记为0 分,5%~24%记为1 分,25%~49%记为2 分,50%~75%记为3 分,>75%记为4 分;②染色强度评分:无(-),弱(+),中等(++),强(+++),分别记为0~3 分;③标本免疫组化评分为上述2 项得分之和,得分0~1 分记为阴性(-),2~3 分为弱阳性(+),4~5 分为阳性(++),6~7 分为强阳性为(+++)。
1.3.2 实时荧光定量PCR 将冻存的新鲜组织称重后用玻璃研磨器进行研磨,按Trizol说明书提取总RNA,检测RNA浓度及纯度,使用Prime ScriptTMRT reagent Kit with gDNA Eraser 试剂盒逆转录成 cDNA(-80 ℃储存备用)。以GAPDH为内参,按TB Ⅱ说明书在冰上操作,配制20 μl反应体系,TB Ⅱ 10 μl,上下游引物各0.8 μl,灭菌水6.4 μl , 模板2 μl。循环时间为:95 ℃ 30 s 1 个循环,95 ℃ 5 s、60 ℃ 30 s 40 个循环,95 ℃ 5 s、60 ℃ 1 h 1 个循环。每个样本3 个复孔取平均值,采用2-ΔΔCT法进行分析。
1.4 统计学处理
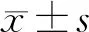
2 结 果
2.1 hBD-3蛋白表达
图 1为3 组的HE染色,图 2为hBD-3的免疫组化染色,结果示:hBD-3主要定位于上皮细胞胞质及胞核中,呈黄色或深黄色染色颗粒。正常口腔黏膜中hBD-3主要分布于基底层和附近的棘层,主要表达在胞浆中;OSF组织中hBD-3染色范围扩大,阳性细胞分布于基底层、棘层和颗粒层,染色加深,胞浆、胞核及胞膜均有表达,胞核更强;OSCC中hBD-3染色较强,其高表达的部位主要在癌变的区域,胞浆和胞核均有表达,尤以胞核更强。hBD-3在正常口腔黏膜、OSF、伴OSF口腔鳞癌组织中阳性表达率为40.00%(4/10)、86.36%(19/22)、100.00%(13/13),差异具有统计学意义(P<0.05)。具体表达情况见表 1。
2.2 hBD-3mRNA的相对表达量
10 例正常口腔黏膜、22 例OSF及13 例伴OSF口腔鳞癌组织中hBD-3 mRNA相对表达量分别为1.06±0.37,1.73±0.21,7.07±0. 88。其中伴OSF口腔鳞癌组织中hBD-3 mRNA表达水平明显高于正常对照组及OSF组,差异均具有统计学意义(P<0. 05),OSF组中hBD-3 mRNA表达水平高于正常对照组,差异具有统计学意义(P<0.05)(图 3)。
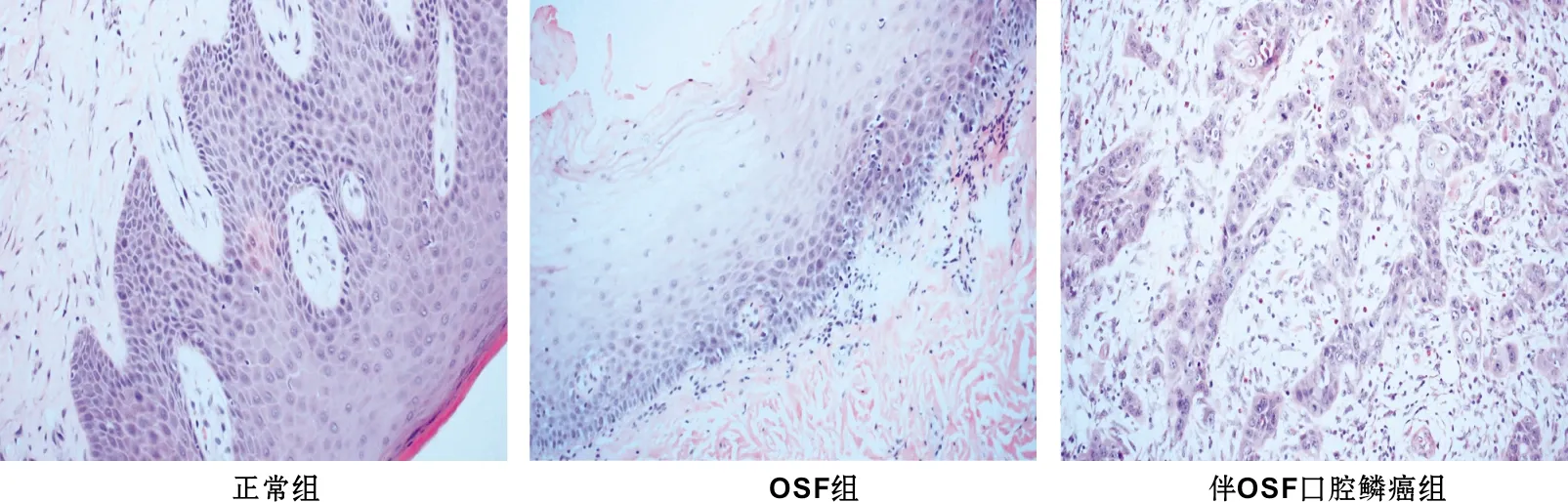
图 1 3 组的HE染色图片(×200)
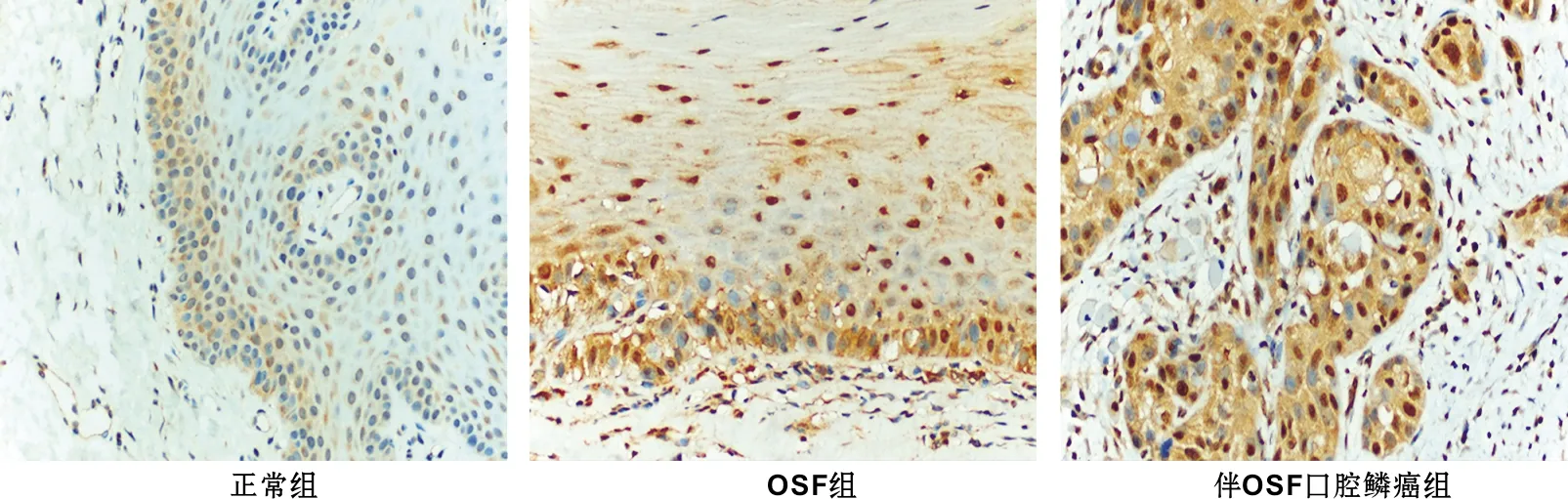
图 2 hBD-3的免疫组化染色结果(×400)

表 1 3 组hBD-3表达强度的比较
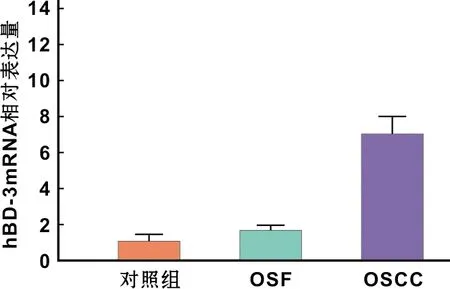
图 3 3 组样本中hBD-3相对表达量
3 讨 论
hBD-3是人先天免疫屏障的重要组成部分,定位于人第8号染色体的p22~23区域内,于2001年首先在银屑病患者皮损中发现,正常情况下hBD-3呈低表达,当机体处于感染或炎症时,其表达水平会显著增加,进而通过直接杀灭病原微生物以及激活或趋化免疫细胞至炎症部位来发挥其免疫防御作用[9]。研究表明,hBD-3在多种肿瘤组织中存在高表达,如外阴部恶性肿瘤,宫颈癌,头颈部鳞状细胞癌等,过表达的hBD-3能够影响肿瘤细胞的增殖、凋亡、侵袭迁移等生理过程从而促进肿瘤的发生发展[10-12]。目前有关hBD-3促癌作用的分子机制尚不明确。有学者发现过表达的hBD-3能够与趋化因子受体结合募集肿瘤相关巨噬细胞至黏膜下、诱导促肿瘤因子和炎症因子的释放,构建肿瘤相关炎症微环境从而促使细胞异常增殖[6,13]。亦有学者报道过表达的hBD-3能通过激活ERK1/2、PI3K/AKT及NF-KB等肿瘤相关信号通路从而影响肿瘤发生发展[12,14]。
OSF是一种与咀嚼槟榔有关的具有癌变倾向的疾病,其主要病理特征为近上皮端炎症反应、进行性黏膜下胶原沉积变性及上皮萎缩,从而引起黏膜硬化、形成条索,最终出现张口受限等临床症状。长期咀嚼槟榔所导致的黏膜慢性炎症以及成纤维细胞过度增殖和功能活化是OSF形成的重要原因。本文通过免疫组化及实时荧光定量PCR技术对hBD-3在OSF中的表达情况做了初步探讨,结果表明OSF组织中hBD-3基因和蛋白表达水平显著高于正常口腔黏膜(P<0.05),提示hBD-3可能参与了OSF发生。槟榔体积较大,质地较硬,长期嚼食槟榔势必会损伤口腔黏膜,导致上皮屏障受损,机体会分泌大量的炎症细胞因子以及炎性介质从而诱导hBD-3表达上调。过表达的hBD-3可能对OSF发生也有一定影响。研究表明,hBD-3具有双向免疫调节功能,低浓度时抑制炎症因子的表达,高浓度时倾向于促进炎症因子的释放[4]。此外,hBD-3能够促进肥大细胞活化和脱颗粒,而肥大细胞的功能活化可以干扰组织胶原代谢而促进OSF形成[15-16]。体外实验进一步表明hBD-3能促进成纤维细胞的增殖[17]。
OSF作为一种癌前状态,可发展为口腔鳞状细胞癌。Kesting等[7]通过对45 例口腔鳞癌患者与健康人hBD-3 mRNA及其蛋白表达的检测,发现在鳞癌组织中hBD-3 mRNA与蛋白的表达量明显高于健康人。体外实验表明过表达的hBD-3能促进口腔鳞状细胞癌株的增殖及迁移,扮演着原癌基因的作用[18]。本研究显示:正常口腔黏膜、OSF组织以及伴OSF口腔鳞癌组织3 组中hBD-3基因和蛋白表达水平呈逐渐增高的趋势(P<0. 05),hBD-3在伴OSF口腔鳞癌组织较OSF组织中的表达水平明显升高,提示hBD-3可能与OSF癌变有关。其可能的致癌机制为:在槟榔等长期刺激下,导致口腔黏膜屏障受损以及黏膜下炎性渗出,机体通过多条信号转导途径上调hBD-3表达,过表达的hBD-3能通过激活NF-KB等肿瘤相关信号通路以及构建肿瘤相关炎症微环境参与OSF癌变。
炎症与肿瘤的发生密切相关,因此寻找炎症环境下特异性的生物标志物也非常重要,因其可能有助于识别早期癌前病变,预测疾病的发展、评估疾病的预后。hBD-3作为一种炎症因子,已被认为是潜在的口腔癌生物标志物[19]。本研究以hBD-3作为实验指标,观察其在OSF癌变中的表达情况,对hBD-3在OSF癌变中的作用做初步的探讨,以期为OSF发生及癌变的机制及早期诊断和治疗方面提供更多的理论依据。
