干扰素α对乙型肝炎小鼠病理形态学及TGF-β1、ACT-A表达影响
2020-12-05刘晓倩
刘晓倩 乔 珺 张 蕾 张 新*
由乙型肝炎病毒(hepatitis B virus,HBV)引起的乙型肝炎(简称乙肝)在世界范围内具有极高的发病率,我国是乙肝发病大国,且一直是突出的公共卫生问题[1]。干扰素α(interferon alpha,IFN-α)具有抗病毒及抗肿瘤的调节作用,在乙肝治疗中应用较为广泛[2]。此外有研究发现,IFN-α的其他机制也可能具有治疗乙肝及肝纤维化的作用。刘娜等[3]研究结果显示,IFN-α可通过调节免疫提高对乙肝的疗效。同时免疫炎性水平异常也是影响肝纤维化的重要因素,提示IFN-α也可能具有抑制乙肝纤维化的作用[4]。
转化生长因子β1(transforming growth factor β1,TGF-β1)及活化素A(activins A,ACT-A)均属于TGF-β超家族,具有调节细胞生长和分化的作用。有研究显示,TGF-β1可通过调节肝星状细胞促进肝纤维化,并且TGF-β1可能预示着更严重的肝组织损伤和纤维化程度[5-6]。ACT-A是一种由性腺分泌的肽类激素,具有调节纤维化的作用[7]。本研究主要分析IFN-α对乙肝小鼠肝组织病变及纤维化的影响,并检测TGF-β1及ACT-A的变化,为将IFN-α更好应用于治疗乙肝提供依据。
1 材料与方法
1.1 实验动物
选择无特定病原体(specific pathogen free,SPF)级饲养条件下BALB/c雌性小鼠共30只,鼠龄为8周,均购自中国动物实验中心(Laboratory Animal Center);将生理状况一致的健康30只小鼠分为3组,每组10只,分别为对照组、模型组和IFN-α组。
1.2 仪器与试剂
(1)仪器设备:采用ARCHITECT i2000SR酶标仪(美国雅培公司);ABI 7500 qPCR检测系统(美国Life technologies公司);BX63电动荧光显微镜(日本Olympus公司)。
(2)试剂:HBV及Hank调试剂(北京动物传染病实验研究中心);pKCMvint.IFN-α-2a及阴性对照质粒pKCMvint(德国埃森医院病毒研究所);血清谷氨酸转移酶(alanine aminotransferase,ALT)、门冬氨酸转移酶(aspartate transferase,AST)、HBV血清标志物HBeAg、HBsAg及IFN-α酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒均购自北京乐博公司;苏木素-伊红(hematoxylin eosin,HE)染色和Masson染色试剂盒均购自武汉华美公司;Trizol试剂(美国Invitrogen公司);逆转录cDNA试剂盒及SYBR Green PCR Master Mix qPCR(定量PCR,quantitative qPCR)试剂盒(瑞士Roche公司);抗体(美国Abcam公司);膜聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Bio-Rad公司)。
1.3 干预方法
模型组和IFN-α组根据参考文献[8]建立HBV感染模型,使用Hank调试剂将HBV稀释至1×106个/ml,然后经小鼠尾静脉注射HBV溶液,注射剂量为10 ml/kg。对照组注射等剂量溶剂。IFN-α组[9]通过高压尾静脉注射pKCMvint.IFN-α-2a,每只10 μg,每2周一次,其中模型组注射等剂量的阴性对照。注射后第28 d检测各指标。
1.4 实验方法
1.4.1 ELISA检测
注射后第28 d,采用ELISA检测AST、ALT、HBeAg、HbsAg、IFN-α、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及白细胞介素6(interleukin-6,IL-6)的水平。对小鼠进行眼眶取血,利用离心设备,以6000 r/min的速度离心10 min,收集上层血清,通过磷酸缓冲液将其稀释20倍后,根据ELISA试剂盒说明书加入试剂,检测血清中HBV标志物HBeAg、HBsAg及IFN-α水平。
1.4.2 染色
注射后28 d将小鼠麻醉后处死,取出肝组织,室温固定并包埋。将样品切成4 μm厚的均匀薄片,进行脱蜡及水合,分别通过HE及Masson试剂进行染色,显微镜下观察肝组织形态和纤维化程度。
1.4.3 RT-qPCR检测
使用Trizol 试剂获得肝组织中总核糖核酸(Ribonucleic Acid,RNA),并检测RNA浓度和纯度。使用逆转录cDNA试剂盒逆转录1 μg RNA用于合成cDNA(42 ℃下60 min,70 ℃下5 min,然后4 ℃保存)。使用SYBR Green PCR Master Mix试剂盒和RTqPCR检测系统。进行qPCR实验(在95 ℃/10 min,40个循环,94 ℃/15 s,60 ℃/1 min,60 ℃/1 min,4 ℃保存)。比较循环阈值(ΔΔCt)用于分析RNA的表达。磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和序列(U6)用于标准化。
1.4.4 蛋白印迹方法(Western blot)
采用Western Blot检测肝组织中TGF-β1和ACT-A蛋白水平。在液氮的保护下裂解肝组织,在12000 rpm,4 ℃下离心15 min收集上清液,使用蛋白检测方法(bicinchoninic acid,BCA)确定蛋白质浓度。十二烷基磺酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)(10%)电泳后进行PVDF膜转及封闭。加入一抗后在室温下振荡2 h,后在4 ℃环境下孵育过夜,加入二抗。使用GAPDH作为内参。
1.5 统计学方法
使用SPSS19软件对数据进行统计分析,单因素方差分析(analysis of variance,ANOVA)评估组间差异,计量资料采用均值标准差()表示,两两比较使用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 小鼠一般情况比较
对照组小鼠饮食、活动及排泄正常,皮毛有光泽且精神状态正常。模型组小鼠出现明显的精神萎靡,活动及饮食减少,部分出现腹水。IFN-α组的小鼠饮食和活动基本正常,皮毛较柔顺,无腹水出现。
2.2 小鼠血清HBV标志物及IFN-α水平比较
模型组及IFN-α组小鼠血清中可检测出明显的HBV标志物HBeAg和HBsAg,并且IFN-α组血清HBeAg和HBsAg水平显著低于模型组(t=6.132,t=5.986;P<0.05)。模型组和对照组IFN-α水平比较差异无统计学意义,IFN-α组的IFN-α水平显著高于模型组(t=4.812,P<0.05),见表1。
2.3 小鼠肝功能水平比较
模型组小鼠血清肝功能指标ALT和AST显著高于对照组(t=6.115,t=6.548;P<0.05),IFN-α组的ALT和AST水平显著低于对照组(t=4.661,t=5.018;P<0.05),见表2。
2.4 小鼠肝组织病理学形态变化
对照组小鼠的肝组织中细胞形态完整,排列紧密,细胞以中央静脉为中心呈放射状排列,肝小叶结构完整且清晰。模型组小鼠的肝细胞出现显著形变,细胞排列异常,出现假肝小叶,并且出现炎症反应。IFN-α组小鼠的肝组织损伤程度较模型组显著缓解,炎症反应较轻,细胞排列基本紧密。各组小鼠肝组织病理学形态见图1。
2.5 小鼠肝组织纤维化情况比较
Masson染色检测中灰蓝色为纤维组织,结果显示对照组小鼠肝组织未发现明显的纤维化现象,而模型组小鼠的肝组织出现大量的纤维化染色,IFN-α组小鼠的肝组织基本正常,并且仅有少量的纤维化染色,见图2。
2.6 小鼠炎性因子比较
模型组小鼠血清TNF-α和IL-6水平显著高于对照组(t=5.771,t=6.238;P<0.05),IFN-α组的TNF-α和IL-6水平显著低于模型组(t=5.823,t=5.339;P<0.05),见表3。
表1 各组小鼠血清HBV标志物和IFN-α水平比较()
注:表中IFN-α为干扰素α;HBeAg、HBsAg均为乙肝病毒血清标志物
表2 各组小鼠血清ALT和AST水平比较(U/L,)
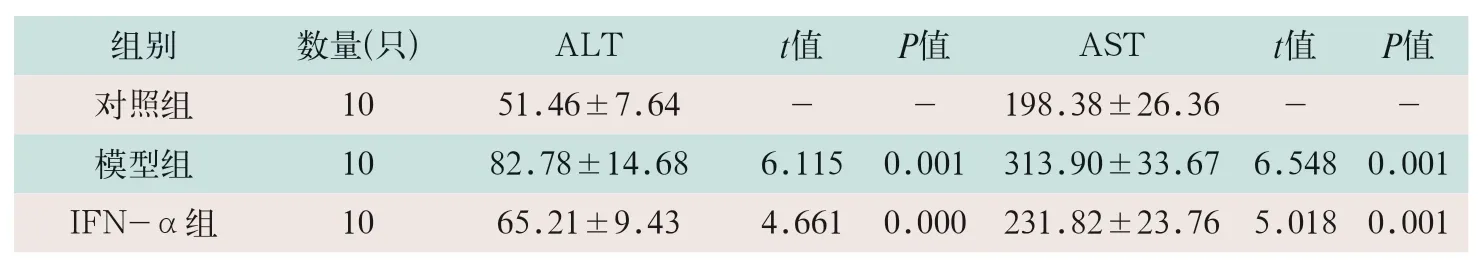
表2 各组小鼠血清ALT和AST水平比较(U/L,)
注:表中IFN-α为干扰素α;ALT为血清谷氨酸转移酶;AST为门冬氨酸转移酶
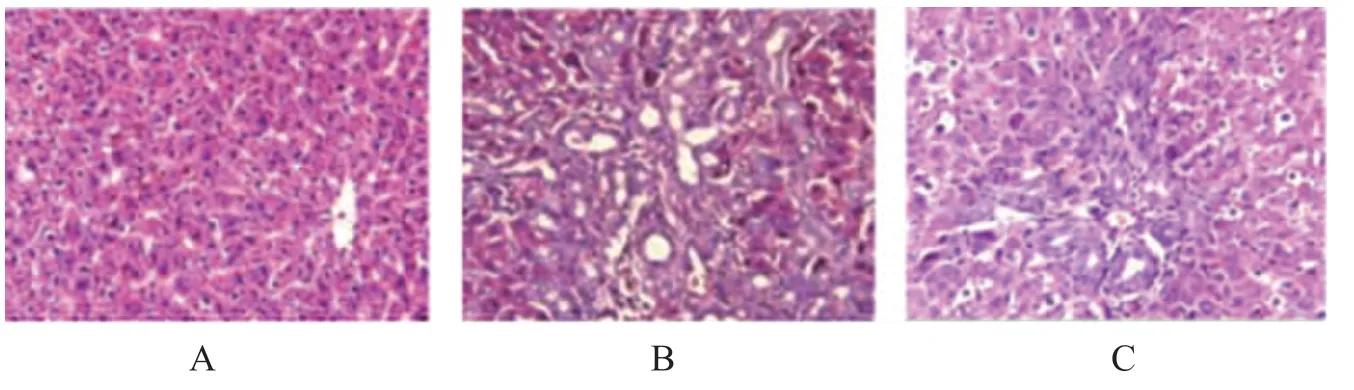
图1 HE染色检测各组小鼠肝组织病理学形态(×400)
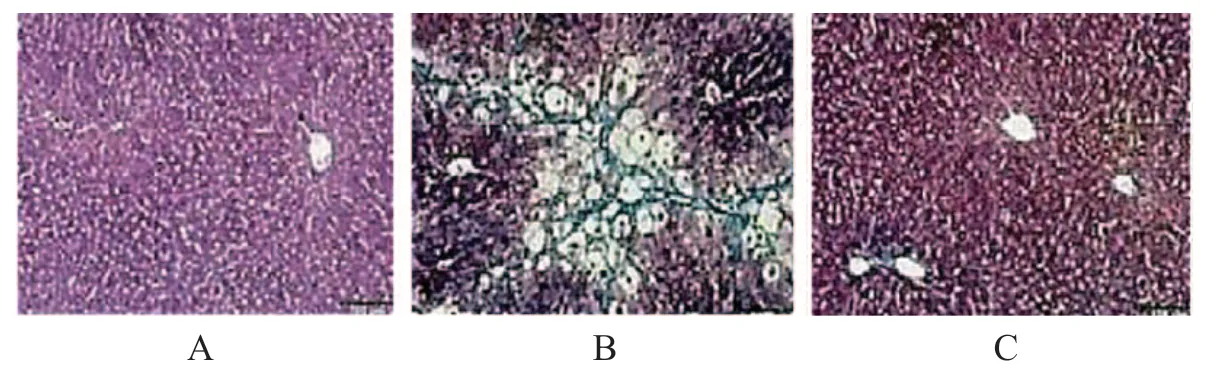
图2 Masson染色检测各组小鼠肝组织纤维化情况(×400)
表3 各组小鼠血清TNF-α和IL-6水平比较(μg/L,)
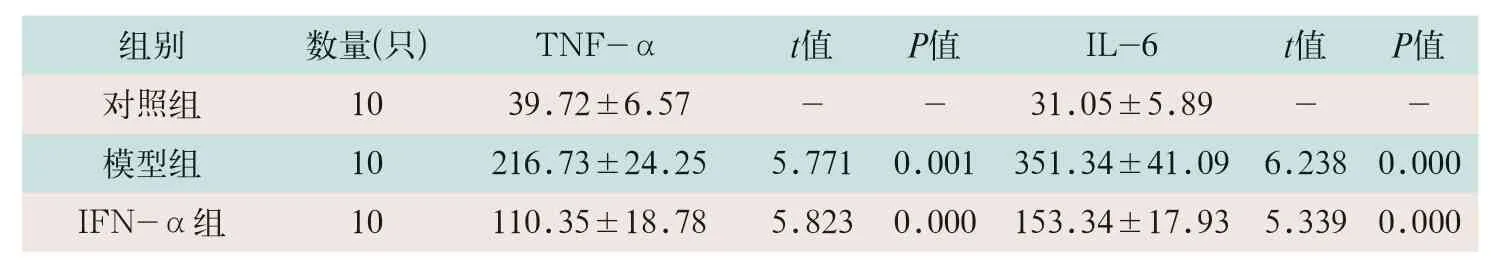
表3 各组小鼠血清TNF-α和IL-6水平比较(μg/L,)
注:表中IFN-α为干扰素α;TNF-α为肿瘤坏死因子α;IL-6为白细胞介素6
表4 各组小鼠肝组织中TGF-β1、ACT-A的mRNA和蛋白水平比较()
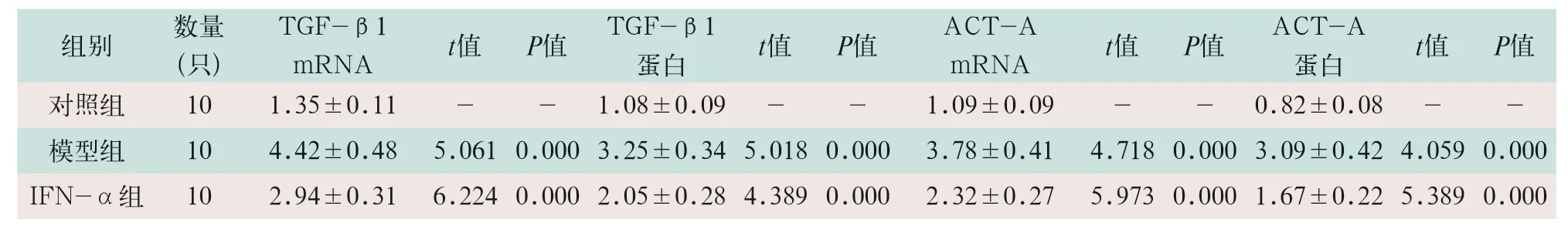
表4 各组小鼠肝组织中TGF-β1、ACT-A的mRNA和蛋白水平比较()
注:表中IFN-α为干扰素α;TGF-β1为转化生长因子β1;ACT-A mRNA为活化素A信使核糖核酸
2.7 小鼠肝组织TGF-β1及ACT-A表达水平比较
模型组小鼠肝组织中TGF-β1、ACT-A的mRNA和蛋白水平显著高于对照组(tTGF-β1=5.061,t=5.018;tACT-A=4.718,t=4.059;P<0.05),IFN-α组的TGF-β1、ACT-A的mRNA和蛋白水平显著低于模型组(tTGF-β1=6.224,t=4.389;tACT-A=5.973,t=5.389;P<0.05),见表4及图3。

图3 各组小鼠肝组织中TGF-β1和ACT-A蛋白水平蛋白印迹电泳图
3 讨论
我国是乙肝发病大国,该疾病为患者、家庭和社会带来了极大的负面影响。有研究发现,慢性HBV可持续的损伤患者肝细胞,长期可能造成肝纤维化甚至肝硬化。有效清除病毒缓解肝损伤是治疗乙肝的重要途径。
IFN-α最初在60年前被发现,具有干扰病毒复制的能力,有研究已证明IFN-α可通过干扰素刺激基因影响HBV生命周期的多个步骤以抑制HBV复制[10]。此外,IFN-α还具有免疫调节活性,可调节对HBV感染的免疫反应促进HBV的清除[11]。临床研究已发现IFN-α可用于治疗HBV感染,但仍有部分患者对IFN-α反应不佳,在治疗48周后,只有20~40%的患者出现HBeAg血清转化,可能与不同的HBV基因型有关[12]。但也有研究显示IFN-α具有治疗乙肝的作用,并且具有一定的安全性[13]。Li等[14]的研究显示对基线HBsAg水平较低的乙肝患者在早期使用聚乙二醇-IFN-α-2a治疗可能会在96周后出现HBsAg降低。本研究中,根据参考文献[8]通过经小鼠尾静脉注射HBV的方式建立乙肝模型,后根据参考文献的常用方法尾静脉注射pKCMvint.IFN-α-2a质粒以提高IFN-α的表达水平[9]。建模后通过检测小鼠血清中HBV标志物和IFN-α的水平发现模型组和IFN-α组的HBeAg和HbsAg显著高于对照组,并且IFN-α组的IFN-α显著高于模型组,而HBeAg和HbsAg显著低于对照组。结合过往研究,本研究结果显示了IFN-α对于感染HBV的小鼠具有显著的抑制病毒复制的作用。
为进一步研究IFN-α对乙肝小鼠肝损伤的影响,进一步分析了IFN-α对HBV感染小鼠模型病理形态学、血清炎性因子、TGF-β1和ACT-A水平的影响。结果显示模型组的肝功能指标AST、ALT和炎性因子TNF-α及IL-6显著高于对照组。IFN-α组的肝功能损伤程度和炎性因子水平显著低于对照组。对于模型组,HE染色也可观察到明显的组织损伤和炎性反应,Masson染色可观察到肝组织纤维化的加重,而IFN-α组的肝组织损伤程度和纤维化程度显著低于对照组。有临床研究显示,IFN-α具有调节HPV感染的宫颈癌患者的免疫应答和抑制炎性反应[15]。刘萍等[16]的研究显示,腺病毒肺炎婴幼儿外周血中促炎细胞因子的水平与IFN-α负相关。此外,李学艳等[17]发现,IFN-α可有效抑制疱疹性咽峡炎患者的炎性细胞因子的表达。而炎性因子也是诱发肝纤维化和肝硬化的主要因素。HBV感染可通过剪接特异性蛋白促进TGF-β1的表达并诱发肝癌的发生,而控制TGF-β1可延缓乙肝纤维化进展[18-19]。ACT-A是TGF-β超家族中的成员,感染引起的炎性反应也会引起ACT-a的升高,但关于ACT-A在乙肝肝损伤和肝纤维化中的机制尚不清楚。有研究发现,控制ACT-A的水平有助于缓解炎性反应保护肝组织[20-21]。
4 结论
本研究提示IFN-α可控制炎性因子及ACT-A和TGF-β1的水平,缓解肝组织损伤和纤维化。IFN-α不但可抑制HBV的复制,还可通过控制ACT-A及TGF-β1的表达缓解炎性反应,并减少HBV感染引起的肝组织损伤和纤维化。但关于IFN-α在乙肝肝纤维化中的作用机制仍需深入探究。