超声三维斑点追踪成像技术在风湿性心脏病诊断及预测评估中的应用
2020-12-05王心宇苏茂龙
王心宇 陈 旭* 苏茂龙
风湿性心脏病(rheumatic heart disease,RHD)是由于风湿热活动累及心脏的心内膜、心肌及心包等而造成的心脏瓣膜病变,普遍认为是甲组乙型溶血性链球菌感染引起的变态反应的部分表现,属于自身免疫性疾病[1]。二尖瓣狭窄(mitral valve stenosis,MS)是风湿性心脏病中最常见的类型,临床常出现呼吸困难、咯血、咳嗽、声音嘶哑、体循环栓塞、心衰及房颤等相关症状,早期患者病症隐匿,不易引起重视,但随着病症的发展,长期的心脏代偿对导致左心房负荷过重,左心房结构及功能出现不同程度的改变,影响患者生活质量,甚至危及生命[2-3]。因此,分析患者左心房结构及功能变化,对患者的治疗及改善预后有重要的指导价值[4]。
超声三维斑点追踪成像技术(3-dimensional speckle tracking imaging,3D-STI)是近年新兴的超声技术,可以同时测量多个纵向、径向、圆周及面积等相关应变参数的变化,准确的反应心肌整体及局部的变形情况[5-6]。本研究旨在分析3D-STI在MS诊断及预测评估中的应用。
1 资料与方法
1.1 一般资料
选取2019年1月至2020年1月厦门大学附属心血管病医院收治的86例风湿性二尖瓣狭窄患者,并将其纳入观察组,其中男性45例,女性41例;平均年龄为(45.15±5.10)岁;平均身体质量指数(body mass index,BMI)为(21.12±1.45)kg/m2。同期选择40名于医院查体的健康人为对照组,其中男性22名,女性18名;平均年龄(45.24±5.15)岁;平均BMI为(21.10±1.06)kg/m2。两组受检者在年龄、性别及BMI方面比较无差异,具有可比性。本研究经医院伦理委员会审核通过,所有受检者均签署知情同意书。
1.2 纳入与排除标准
(1)纳入标准:①所有患者进行常规超声心动图符合下列标准,二尖瓣口面积(mitral valve orifice area,MVA)低于1.5 cm2,平均压差在5 mmHg以上,二尖瓣返流面积在6 cm2以下,返流程度均在轻中度以下,其他瓣膜返流程度在轻中度以下;②患者均为窦性心律,且心率在60~100次/min;③经超声心动图检查无左室收缩功能减退者,且左室射血分数在50%以上;④患者及家属知情并签署知情同意书。
(2)排除标准:①患有高血压、心肌病及先天性心脏病等导致左心房功能受损的心脏疾病;②患者存在肝肾等重要器官严重衰竭情况或恶性肿瘤;③患者拒绝本研究或因其他原因终止本研究。
1.3 仪器设备
采用PST-30SBT二维超声(日本Toshiba公司);PST-25SX三维矩阵超声(日本Toshiba公司)。
1.4 检查方法与观察指标
(1)常规超声:采用PST-30SBT二维超声探头(2.5 MHz),检查期间同步心电图。测量左心房前后径(anterior and posterior diameter of left atrium,LAD)、MVA及二尖瓣舒张期峰值流速(peak diastolic velocity of mitral valve,MVVmax),连续采集3个心动周期并保存数据。
(2)3D-STI:采用PST-25SX三维矩阵超声探头(3.0 MHz),检查期间同步心电图,连续采集3次动态图像。脱机分析并进入3D-STI程序,获得左心房最大容积指数(left atrial maximum volume index,LAVImax)、左心室最小容积(left ventricular minimum volume,LAVImin)及左心室收缩前容积(anterior systolic volume of left ventricle,LAVpreA),计算得出左心房总排空分数(total left atrial emptying fraction,LATEF)、左心房被动排空容积(left atrial passive emptying volume,LAVIp)、左心房被动排空分数(left atrial passive emptying fraction,LAPEF)、左心房主动排空容积(left atrial active emptying volume,LAVIa)及左心房主动排空分数(left atrial active emptying score,LAAEF)。同时追踪至左心房16节段,即基底段和中间段的前壁、前侧壁、后侧壁、下壁、后间壁及前间壁12个节段,房顶段的前壁、间壁、下壁及侧壁4个节段,获得各个阶段及整体的应变率,即径向峰值应变(radial peak strain,RPS)、纵向峰值应变(longitudinal peak strain,LPS)、圆周峰值应变(circular peak strain,CPS)、面积峰值应变(area strain peak strain,APS)、整体径向峰值应变(global radial peak strain,GRPS)、整体纵向峰值应变(global longitudinal peak strain,GLPS)、整体圆周峰值应变(global circumferential peak strain,GCPS)及整体面积峰值应变(global area peak strain,GAPS)。所得参数采集3次后取平均值。
1.5 统计学方法
数据均采用SPSS20.0软件进行统计学数据分析。所有计量资料符合正态分布以均值±标准差()表示,组间比较采用t检验;采用Spearman分析GRPS、GCPS、GLPS及GAPS与LAAEF的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 两组受检者常规超声心动图指标比较
观察组患者的LAD及MVVmax明显高于对照组,MVA明显低于对照组,差异有统计学意义(t=18.785,t=19.082,t=61.844;P<0.01),见表1。
表1 两组受检者常规超声心动图指标比较()
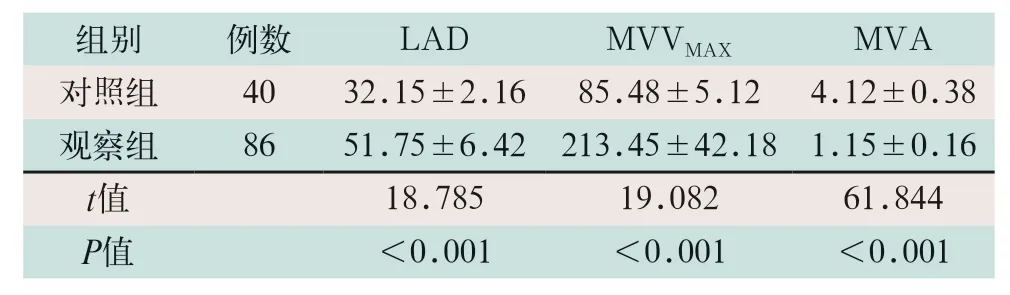
表1 两组受检者常规超声心动图指标比较()
注:表中LAD为左心房前后径;MVVMAX为二尖瓣舒张期峰值流速;MVA为二尖瓣面积
2.2 两组受检者3D-STI左心房功能指标比较
(1)左心储存功能、房助力泵功能和管道功能指标比较:观察组患者的LATEF、LAPEF、LAVIp及LAAEF水平明显低于对照组,LAVImax水平明显高于对照组,差异有统计学意义(t=17.821,t=22.544,t=22.544,t=10.333,t=10.490;P<0.01),见表2。
(2)两组受检者左心房16节段RPS、CPS、LPS及APS水平比较见表3:观察组患者左心房16节段全部APS、大部分LPS及CPS水平均低于对照组,差异有统计学意义(tAPS=9.194、12.312、10.928、12.962、11.032、7.739、6.692、13.061、13.391、20.122、14.520、11.259、13.840、11.658、11.133、19.540;tLPS=11.901、22.313、13.687、13.189、16.349、14.716、10.344、21.887、7.288、11.383、18.298、11.483、12.716;tCPS=10.526、10.249、11.730、8.828、11.835、10.548、7.506、11.191、12.452、12.064、24.710;P<0.01);两组受检者16节段的RPS差异无统计学意义。
表2 两组受检者左心房功能指标比较()
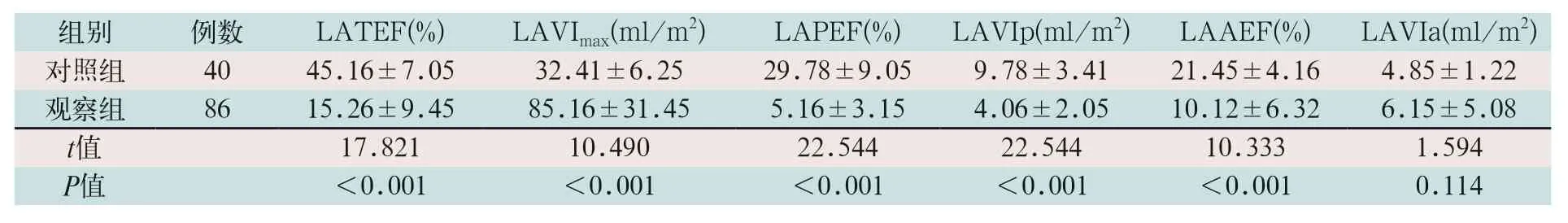
表2 两组受检者左心房功能指标比较()
注:表中LATEF为左心房总排空分数;LAPEF为左心房被动排空分数;LAVIp为左心房被动排空容积;LAAEF为左心房主动排空分数;LAVImax为左心房最大容积指数;LAVIa为左心房主动排空容积
表3 两组受检者左心房16节段RPS、CPS、LPS及APS水平比较()
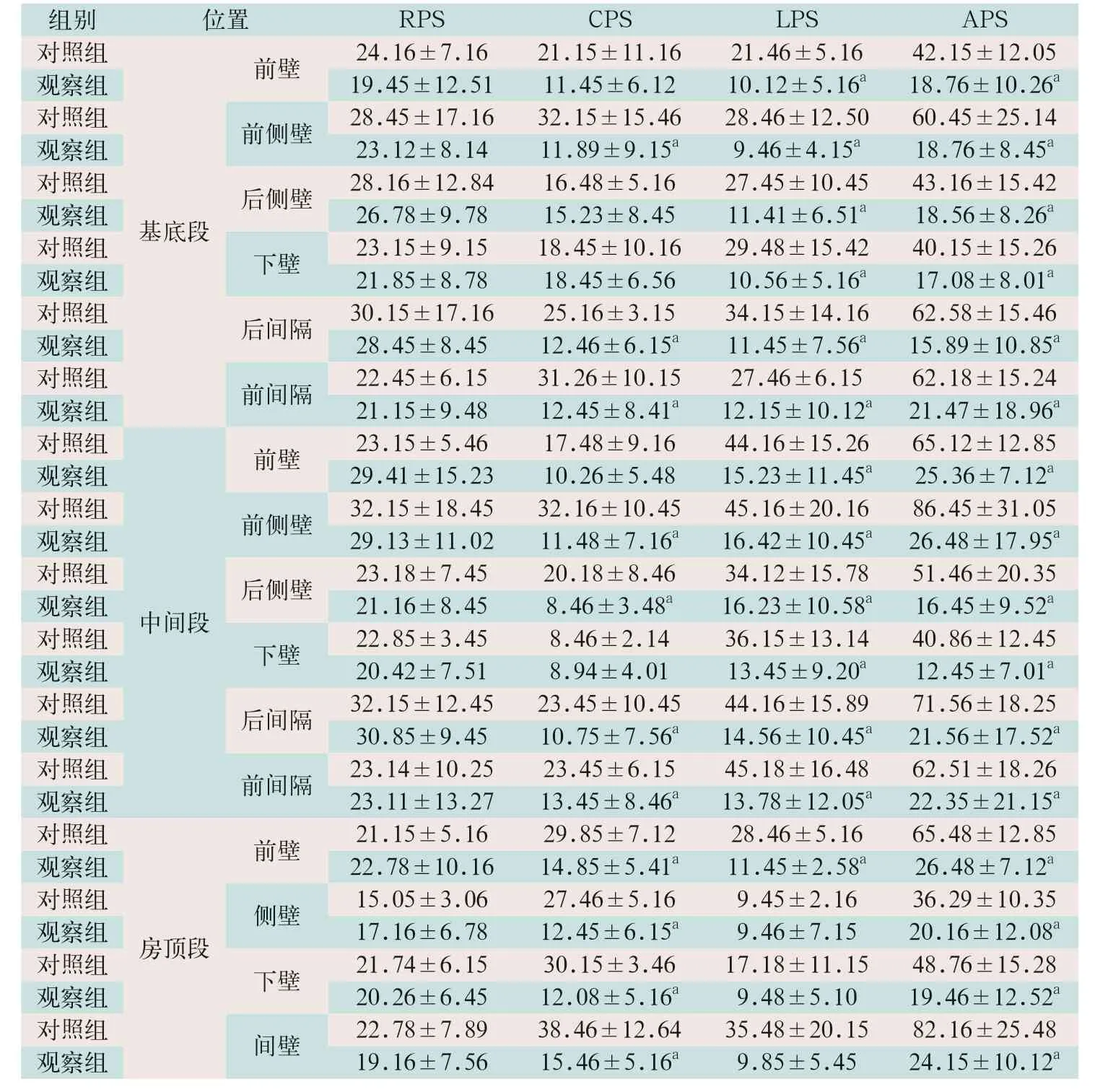
表3 两组受检者左心房16节段RPS、CPS、LPS及APS水平比较()
注:表中RPS为径向应变;CPS为圆周应变;LPS为纵向应变;APS为面积应变;a为与对照组相比,P<0.05
(3)两组受检者整体应变比较:观察组患者的GRPS、GCPS、GLPS及GAPS水平明显低于对照组,差异有统计学意义(t=2.587,t=15.417,t=25.554,t=23.096;P<0.05),见表4。
表4 两组受检者整体应变比较(%,)
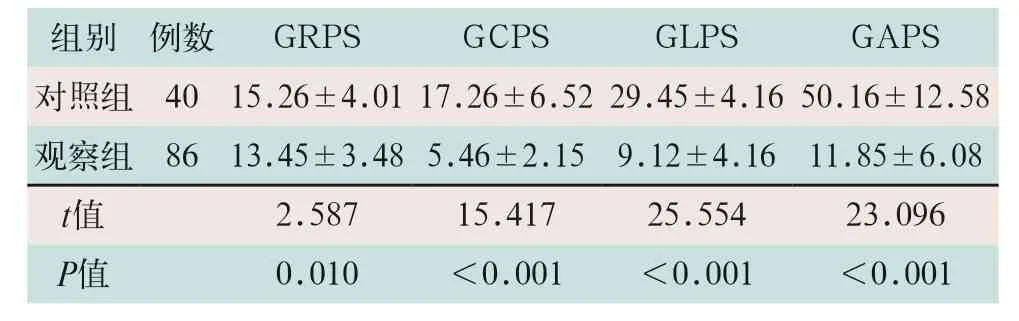
表4 两组受检者整体应变比较(%,)
注:表中GRPS为整体径向应变;GCPS为整体圆周应变;GLPS为整体纵向应变;GAPS为整体面积应变
2.3 3D-STI相关指标与LAAEF相关性分析
GRPS、GCPS、GLPS及GAPS与LAAEF均呈正相关(r=0.517,r=0.358,r=0.562,r=0.618;P<0.05)。
2.4 风湿性心脏病合并左心衰超声三维斑点追踪成像
风湿性心脏病合并左心衰的患者左室壁应变17节段牛眼图,显示各室壁应变率减低且运动不同步。风湿性心脏病合并左心衰的患者应变达峰时间牛眼图,显示各室壁应变率减低且运动不同步。风湿性心脏病合并左心衰超声三维斑点追踪成像分析见图1。
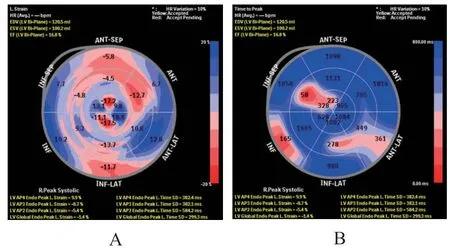
图1 风湿性心脏病合并左心衰超声三维斑点追踪成像分析牛眼图
3 讨论
二尖瓣是RHD最常累及的瓣膜,有研究显示,RHD中MS的发病率最高,约为65%~100%[7]。MS早期可出现瓣膜交界处及基底部水肿及炎症反应,后期出现瓣膜交界处的粘合,还表现瓣膜增厚、钙化等,减小瓣膜活动范围,导致瓣口狭窄[8]。患者早期可通过不同程度的左心房扩大及肥厚代偿性的增加收缩力,增加心房的主动排血量,但随二尖瓣狭窄程度的增加,左心房收缩力难以对抗血流动力障碍时,左心房进入失代偿阶段,出现瘀滞现象,甚至导致血栓形成,增加患者发生房颤、血栓栓塞的风险[9]。因此,早期发现患者左心房功能结构变化,诊断MS对早期治疗MS患者,改善其预后情况具有重要意义[10]。
3D-STI是结合超声心肌形变成像技术及斑点追踪超声心动图两种技术原理发展起来的新兴技术,通过一个心动周期内的心脏容面积图像,建立三维空间上心肌的运动信息,对心肌节段上变化进行评价,通过三维空间的定位准确评价患者心肌整体及局部的变化,为心脏超声的诊断提供更高的准确性[11-13]。正常情况下,左心房具有存储、管道及助力泵功能,即收缩晚期存储肺静脉的回心血量,舒张早期作为肺静脉血进入左心室的管道及舒张晚期将残留的左心房血泵入左心室,3D-STI中,左心房的功能对应相关指标即存储功能:LAVImax、LATEF;管道功能:LAVIp、LAPEF;助力泵功能LAVIa及LAAEF[14]。本研究中,观察组患者的LATEF、LAPEF、LAVIp及LAAEF水平明显低于对照组,LAVImax水平明显高于对照组,差异有统计学意义,可能与二尖瓣狭窄导致左心房内径增大导致左心房的储存能力增加,还使左心室舒张早期肺静脉血经左心房进入左心室受阻导致管道功能损伤,左心房自主收缩能力降低,助力泵功能下降有关。
左心壁主要有圆周和纵向的肌束组成,MS患者的RASS系统活跃,体液因子分泌增加,诱导心肌细胞肥大,心房组织出现不同程度的纤维化,最终导致患者左心房心肌出现各个方向的改变[15]。本研究中观察组患者左心房16节段全部APS、大部分LPS及CPS水平均低于对照组,差异有统计学意义。两组受检者16节段的RPS差异无统计学意义。观察组患者的GCPS、GLPS及GAPS水平明显低于对照组,差异有统计学意义。提示MS患者的左心房功能出现明显改变,而上述指标中,只有面积应变的相关参数出现全阳性,因此APS及GAPS可作为敏感、准确的反映左心房形变功能的新指标。
本研究采用Spearman分析得出,GRPS、GCPS、GLPS及GAPS与LAAEF均呈正相关,其中GAPS与LAAEF的相关性最好,进一步表明GAPS可全面的代表心肌在各方面运动的综合表现,为诊断MS提供相应检验参考。
4 结论
MS患者左心房的储存能力、管道功能及助力泵功能减退,GCPS、GLPS及GAPS水平降低,且与LAAEF呈明显正相关,3D-STI可检测MS患者左心房结构及心肌功能的变化,可作为评估诊断MS的检验方法。