一株溶藻菌CBA02的分离、鉴定及溶藻特性研究
2020-12-04杨冰洁向文洲金雪洁陈子硕王灵吴后波
杨冰洁 向文洲 金雪洁 陈子硕 王灵 吴后波
(1.中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室,广州 510301;2.中国科学院大学,北京 100049;3.南方海洋科学与工程广东省实验室,广州 510301)
微藻是一类资源丰富、种类繁多、生长速度快、具有极大应用价值的生物资源,其细胞内富含各类生物活性成分,如藻多糖、脂类、藻胆蛋白、β-胡萝卜素、氨基酸、蛋白质等,在医药、保健、食品、化妆品、饲料和能源等诸多领域具有巨大应用潜力,被誉为生物技术开发的“朝阳产业”[1]。
微藻的大规模养殖是微藻资源商业化应用的必不可少的重要途径之一,微藻的商业化大规模养殖通常于开放的水池或封闭的光生物反应器中单一藻株高密度培养[2]。然而在微藻的大规模养殖过程中,无论是开放还是封闭式的系统,环境中各种微生物如原生动物、其他杂藻、细菌、真菌和病毒等会通过各种途径进入其中,这些微生物组成复杂,群落多变,一旦对养殖微藻有害的微生物进入养殖系统,轻则影响微藻的产量,严重时甚至破坏整个微藻培养体系导致“颗粒”无收[3],这是微藻资源大规模持续发展所面临的重大挑战。在微藻养殖生产系统中细菌丰富,通常能达到109个/mL,是藻细胞浓度的10-100倍[4],目前已知某些细菌菌株会降低微藻的产量[5-6]。细菌破坏微藻生产主要包括两种方式,长期内逐渐降低生产或导致培养物快速失效甚至突然“崩溃”。
从理论上讲,细菌可能通过直接裂解藻细胞或分泌溶藻物质而发挥有害作用[7]。近几年来,有关藻菌互作特别是溶藻细菌的研究大部分集中于自然环境中有害赤潮或水华的生物防治等方面[8],而在微藻的工业化生产等方面的研究鲜有报道,随着国际上对微藻广泛应用前景的高度关注,从微藻养殖的病害防治的角度开展溶藻细菌的研究将十分重要和迫切。
本研究在海南三亚的微藻室外培养的前期研究中,发现一株污染蓝藻可以广谱“溶解”几乎所有处于不同扩种阶段、具有商业潜力的真核微藻,通过实验室对该蓝藻进行分离和培养研究,发现导致溶藻作用的罪魁祸首不是其蓝藻自身,而是源自于多株附生该蓝藻的细菌,蓝藻的爆发只是溶藻细菌的伴生现象。本研究将首次报道该蓝藻(Cyanobacterium sp.SCSIO-45682)藻际环境中分离得到的、对盐生杜氏藻具有极强溶藻作用的有害细菌CBA02,对其溶藻能力和方式作出阐释,初步分析其溶藻特性,以期为微藻大规模养殖中溶藻菌生物污染的防治供理论依据与指导。
1 材料与方法
1.1 材料
菌株CBA02从实验室分离得到的蓝藻(Cyanobacterium sp.SCSIO-45682)单种培养物的藻际环境中筛选获得,该蓝藻于2013年由本实验室从海南省三亚市天涯镇的被污染微藻开放养殖池中分离获得。实验藻种盐生杜氏藻(Dunaliella salina,SCSIO-45153)藻种由中国科学院南海海洋研究所经济微藻种质库提供。
1.2 方法
1.2.1 培养方法菌株CBA02采用2216E海洋细菌培养基[9],于温度28℃,转速200 r/min条件下培养。
实验所用所有藻种均采用F/2培养基[10],于温度25±1℃、光照强度60±5 μmol photons/m2/s、光暗比24 h∶0 h条件下培养。
1.2.2 菌株CBA02的分子鉴定 通过16S rRNA基因测序鉴定。DNA提取方法参照Englen等[11],PCR扩增引物选取27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACGGYTACCTTGTTACGAC TT-3')[12]。PCR反应体系:25 μL Premix rTaq(TAK ARA),2 μL正向引物(27F),2 μL反向引物(1492R),2 μL模版DNA,2 μL二甲基亚砜(DMSO),17 μL ddH2O。PCR反 应 条 件:94℃ 4min;94℃ 45 s,50℃ 45 s,72℃ 95 s,36个循环;72℃ 10 min。PCR产物送至广州天一辉远基因科技公司测序。测序结果用BLAST软件与GenBank中己知的16SrDNA进行同源性比较分析,并构建系统进化树。选取与CBA02的16S rDNA 序列相似性较接近的菌株,用MEGA 6.0软件以Neighbor Joining法构建系统发育树。
1.2.3 菌株CBA02生长曲线的测定 将固体培养基上的菌株CBA02菌落接种于2216E液体培养基中,设3组平行;于 28℃、200 r/min振荡培养。每12 h 取样测定其在600 nm处的吸光度(OD600),持续120 h。以吸光度(OD600)为纵坐标,时间为横坐标,绘制生长曲线,便于后续实验取样。
1.2.4 叶绿素含量和溶藻率的测定 叶绿素a测定方法采用丙酮法[13]。溶藻率计算方法为:溶藻率(%)=(C0-Ct)/C0×100%。其中,C0和Ct分别代表对照组和处理组的叶绿素a含量。
1.2.5 菌株CBA02的溶藻效应研究
1.2.5.1 菌液不同发酵时间对溶藻活性的影响 取发酵时间为48 h、72 h、96 h和120 h的菌液按照20%(体积比)添加到100 mL处于对数生长期的初始叶绿素a浓度约为3.6 μg/mL(OD750=0.100±0.008)的藻液中,进行溶藻试验;并以向相同藻液中加入等量2216E海洋细菌培养基作为对照,各设 3 组平行;共培养12 d,每隔2 d取样,用于测定叶绿素a浓度,并计算溶藻率。
1.2.5.2 不同菌液添加量对溶藻活性的影响 取培养72 h的菌液(OD600=1.714±0.071)按照5%、10%、15%和 20%(体积比)分别加入到100 mL处于对数生长期的初始叶绿素a浓度约为3.6 μg/mL(OD750=0.100±0.008)的藻液中,进行溶藻试验,各组中藻菌细胞数之比分别为1∶15、1∶30、1∶45和1∶60;并以向相同藻液中加入等量2216E海洋细菌培养基作为对照,各设3组平行;共培养12 d,每隔2 d取样,用于测定叶绿素a 浓度,并计算溶藻率。
1.2.5.3 藻液初始浓度对溶藻活性的影响 利用F/2培养基将处于对数生长期的盐生杜氏藻藻液(OD750= 1.200)稀释成OD750分别为 0.1、0.2、0.3、0.4和0.5,各组中取100 mL藻液并按照 20%(体积比)加入培养72 h的菌株CBA02的菌液(OD600=1.714±0.071),各组中藻菌细胞数之比分别为1∶15、2∶15、1∶5和4∶15,进行溶藻试验;并以向各组相同藻液中加入等量2216E海洋细菌培养基作为对照,各设3组平行;共培养12 d,每隔2 d取样,用于测定叶绿素a浓度,并计算溶藻率。
1.2.5.4 细菌的溶藻方式分析及高温影响 取培养72 h的菌液(OD600=1.714±0.071)分别按以下方式处理:无菌水洗涤3次并以2216E重悬的菌体、原菌液、用0.22 μm滤膜过滤的无菌上清液及高温处理(121℃)的无菌上清液,处理后的各组分别按照20%(体积比)添加100 mL对数生长期的初始叶绿素a浓度约为3.6 μg/mL(OD750=0.100±0.008)的藻液中共培养,并以向相同藻液中加入等量2216E海洋细菌培养基作为对照,各设3组平行,于第10天测定叶绿素a浓度。
1.2.5.5 pH对无菌上清液溶藻活性的影响 取培养72 h的菌液(OD600=1.714±0.071)经离心后用0.22 μm滤膜过滤,得到无菌上清液,之后将其pH用4 mol/L HCl 溶液和4 mol/L NaOH溶液分别调成2.0、4.0、6.0、8.0和10.0,在室温下过夜处理12 h后调回原pH,按照 20%(体积比)添加到100 mL对数生长期的初始叶绿素a浓度约为3.6 μg/mL(OD750=0.100±0.008)的藻液中共培养,并以向相同藻液中加入相同处理等量2216E海洋细菌培养基作为对照,各设 3 组平行,共培养12 d,每隔2 d取样,用于测定叶绿素a浓度,并计算溶藻率。
1.2.6 数据统计 本试验数据统计使用Graphpad Prism 5.0软件,用One-way ANOVA 分析,选用Duncan’s 法进行多重比较,进行单因素方差分析,所有数据用平均值±标准误差表示,P<0.05表示差异性显著。
2 结果
2.1 菌株CBA02的分离鉴定
从蓝藻(Cyanobacterium sp.SCSIO-45682)的藻际环境中分离出一株具有高效溶藻能力的细菌CBA02。扩增菌株CBA02的16S rDNA序列,获得1 377 bp的DNA序列片段。将CBA02的16S rDNA基因序列于GenBank数据库中已登录的16S rDNA基因序列进行同源性检索,并构建系统进化树(图1)。结果发现,CBA02与多株Ponticoccus的相似性达 99%以上,其中与一株Ponticoccus alexandrii 的相似性最高,达100%。
2.2 菌株CBA02生长曲线
将菌株CBA02接种在液体2216E中培养,每隔12 h取样,测定其600 nm处吸光度(OD600),绘制生长曲线如图2所示。从图2中可以看出,CBA02生长延滞期为0-12 h,对数生长期为12-72 h,72 h后进入稳定期。后续选取细菌浓度较高的稳定期进行溶藻相关试验。
2.3 菌株CBA02的溶藻效应研究
2.3.1 菌液CBA02不同发酵时间对溶藻活性的影响 菌株CBA02不同发酵时间对盐生杜氏藻溶藻活性的影响如图3所示。发酵时间为48-120 h的菌液均有一定的溶藻活性,且溶藻率随菌液的发酵时间和共培养时间的增加而增加,其中发酵时间为48 h时溶藻率最低,在共培养至第4天时溶藻率没有明显变化,第4天之后溶藻率随共培养时间的增加而有所上升,到第12天溶藻率达到最大为(9.98±0.14)%;其余各组中溶藻率变化趋势类似,随共培养时间的增加而增加,到第12天溶藻率达到最大,分别为(78.24±0.17)%、(98.69±0.27)%和(99.34±0.05)%。

图1 菌株CBA02的16S rDNA序列与相关菌株的系统发育树
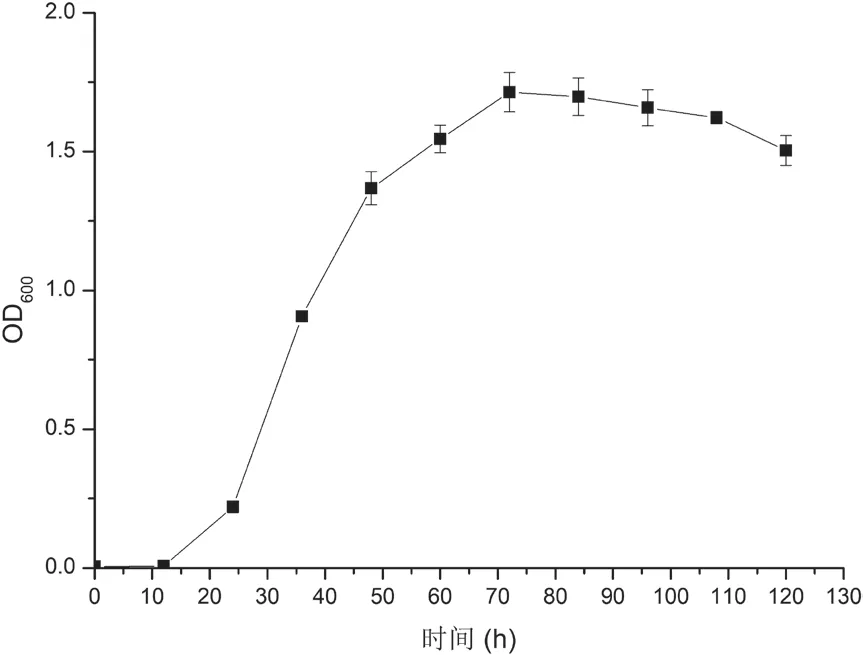
图2 菌株Ponticoccus sp.CBA02的生长曲线

图3 Ponticoccus sp.CBA02菌液不同发酵时间对溶藻活性的影响
2.3.2 菌液不同添加添加量对溶藻活性的影响 菌株CBA02菌液不同添加量对盐生杜氏藻溶藻活性的影响如图4所示。各组中溶藻率随体积比的增加而增加,其中菌液体积比为5%时溶藻率随共培养时间的增加而有所上升,至第8天达到最大(33.49±0.54)%,第8天之后呈下降趋势;其余各组中溶藻率变化趋势相近,随体积比和共培养时间的增加而增加,到第12天溶藻率达到最大,分别为(62.99±0.28)%、(82.79±0.24)%和(98.69±0.14)%。

图4 Ponticoccus sp.CBA02菌液不同添加添加量对溶藻活性的影响
2.3.3 藻液初始浓度对溶藻活性的影响 盐生杜氏藻的藻液初始浓度对菌株CBA02溶藻活性的影响如图5所示。各组中溶藻率随藻液初始浓度的增加而降低,藻液初始OD750为0.1时,溶藻率随共培养时间的增加而上升,至第12天达到最大值(98.68±0.24)%;藻液初始OD750为0.2、0.3和0.4时,共培养至第2天时溶藻率有所增加,第2-8天溶藻率变化幅度并不明显,但第8天后溶藻率随共培养时间的增加而大幅提升,第12天达到最大,分别为(73.99±2.27)%、(53.44±1.24)%和(41.76±0.96)%,最终溶藻活性随初始OD750的增加而降低;藻液初始OD750为0.5时,溶藻率于第2天达到最大为(10.64±0.77)%,之后随共培养时间的增加而降低,到第12天溶藻率为(2.53±0.23)%。
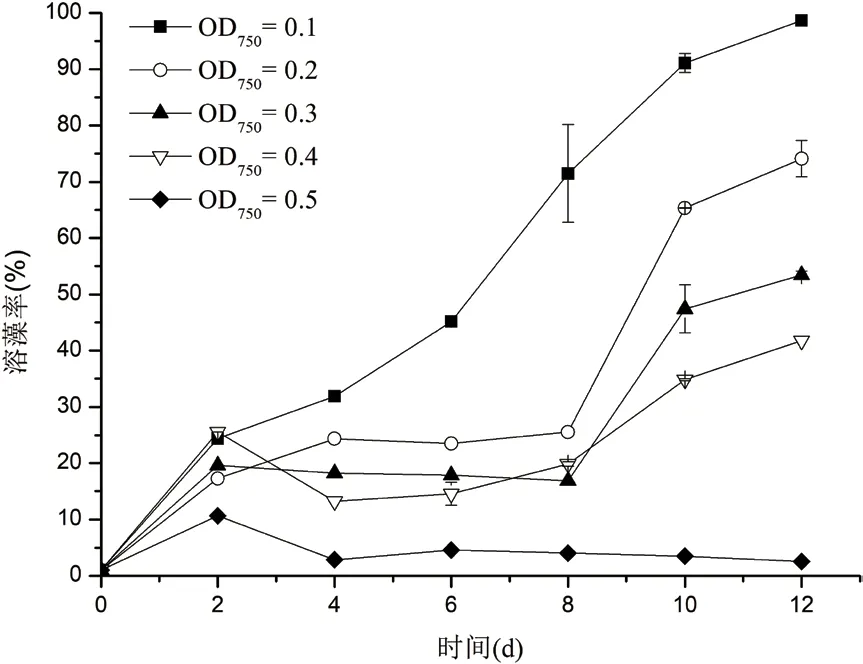
图5 盐生杜氏藻不同藻液初始浓度对溶藻活性的影响
2.3.4 菌液CBA02的溶藻方式分析与高温处理影响 为了研究菌株CBA02对盐生杜氏藻SCSIO-45153的作用方式,将Ponticoccus sp.CBA02的菌体、菌液、无菌上清液及高温处理无菌上清液分别接入藻液进行共培养,结果如图6所示。结果表明,与对照组相比,菌液、无菌上清液及高温处理无菌上清液组中叶绿素含量显著性降低(P<0.05),叶绿素a含量分别为0.28 μg/mL、1.42 μg/mL和0.29 μg/mL,溶藻率分别为96.69%、83.23%和96.58%;菌体组中叶绿素a含量仅有小幅度降低,其溶藻率为12.40%,其中,高温处理的无菌上清液和菌液的溶菌活性也明显高于无菌上清液(P<0.05)。
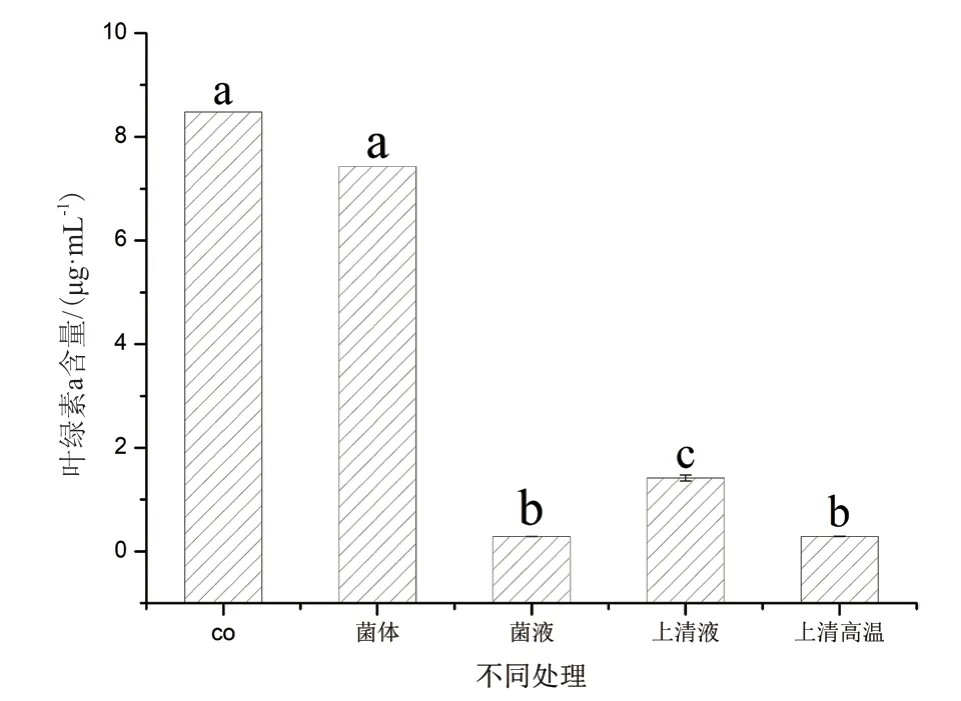
图6 Ponticoccus sp.CBA02菌液不同处理对溶藻活性的影响
2.3.5 pH对菌株CBA02无菌上清液的溶藻活性影响 调节菌株CBA02无菌上清液pH对其溶藻活性的影响如图7所示。各组中溶藻率随pH的增加而增加,上清滤液pH为2时,培养至第2天时溶藻率有所增加,第2-6天溶藻率大致处于平衡状态,到第6-8天溶藻率随培养时间的增加而降低,第8-12天溶藻率大致没有变化;上清滤液pH为4和6时,第6天之前溶藻率变化趋势与pH为2大致相同,第6天之后溶藻率随共培养时间的增加而上升,到第12天达到最大,分别为(27.28±2.27)%和(48.74±2.27)%;上清滤液pH为8和10时,溶藻活性随共培养时间的增加而增加,到第12天溶藻率达到最大分别为(85.63±0.33)%和(99.02±0.17)%。
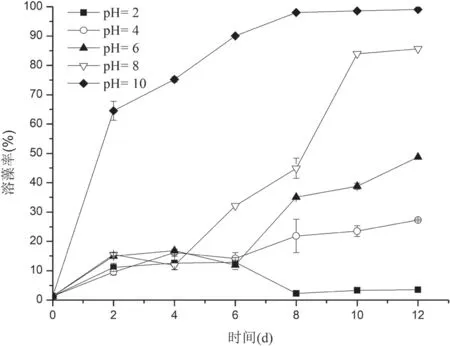
图7 Ponticoccus sp.CBA02无菌滤液经不同pH处理后对盐生杜氏藻的溶藻效率的影响
3 讨论
3.1 微藻规模化培养与溶藻菌污染
目前,已规模化培养的具有应用价值的常用微藻主要包括螺旋藻、盐生杜氏藻、小球藻和雨生红球藻等[12],在微藻的大规模养殖中,细菌、其他浮游生物的入侵污染会降低微藻的产量,造成巨大的经济损失,是急需解决的重要问题。Scott等[15]从生长状况不佳的微拟球藻中分离出一株芽孢杆菌(Bacillus pumilus),该菌株对微拟球藻的生长具有极大的抑制作用。Ding等[16]从含油微藻(Graesiella sp.WBG-1)的开放养殖跑道池中分离出一株该藻的体内寄生真菌Amoeboaphelidium protococcarum,该真菌能引起含油微藻(Graesiella sp.WBG-1)的种群崩溃。本研究从海南省三亚市天涯镇被污染微藻开放养殖池中分离获得一株蓝藻(Cyanobacterium sp.SCSIO-45682)的藻际环境中分离得到1株细菌CBA02,对盐生杜氏藻具有极强的溶藻能力,经分子鉴定属于红杆菌科(Rhodobacteraceae)的Ponticoccus属,虽然该菌株与P.alexandrii的16S rDNA的相似度达到100%,但由于尚未开展生理生化和其它分子序列的比较分类研究,尚不能肯定CBA02与P.alexandrii为同一物种,因此目前仅能定名为Ponticoccus sp.CBA02。
盐生杜氏藻(Dunaliella salina)是一种极具商业价值的微藻之一,富含大量的生物活性物质,如甘油、胡萝卜素、蛋白质、多糖和各种微量元素等,在食品,医药,保健,化学和水产养殖中具有独特的经济价值[17]。由于盐生杜氏藻的培养基采用高盐度这一避免微生物污染的策略进行商业化培养,尚无有关细菌对盐生杜氏藻产生溶解效应的报道,但过高的盐度同时也限制了盐藻的快速生长,因此,开展溶藻机制对于降低其培养盐度、提高产率和减少高盐极端条件控制所须的成本将均有裨益。而且正是由于微藻受制于细菌等微生物的污染及其导致的溶藻、噬藻或摄食微藻等敌害行为,目前仅有数种类似盐藻具有极端适应性的微藻实现商业化开发,丰富多样的微藻资源和生物活性物质还未能深入挖掘。以盐藻的溶藻细菌为模式,开展溶藻机制和溶藻防控技术,对更好地开发微藻种质资源具有十分重要的理论意义和应用价值。
3.2 菌株CBA02的溶藻特性及溶藻机制
本研究发现,溶藻菌作用活性随菌液发酵时间的增长而提高;溶藻菌Ponticoccus sp.CBA02的溶藻活性与其添加量有关,菌液浓度越高,溶藻活性越好,菌液添加浓度与溶藻活性呈现正相关的量效关系,在溶藻菌浓度较低时,其对藻细胞抑制作用不佳;溶藻菌作用活性与藻细胞初始浓度密切相关,藻细胞初始浓度越高,溶藻菌溶藻活性越差。CBA02溶藻的量效关系等特性与前人的报道类似,已有研究表明,溶藻菌的溶藻特性受到菌浓度、藻细胞初始浓度、光照强度、温度、pH等多种因素影响。Shao等[18]研究表明当Bacillus sp.B50的细胞浓度达到 1.9×106CFU/mL时才有溶藻活性,而细胞浓度低于1.9×105CFU/mL时没有溶藻活性,陈庆丽等[19]发现溶藻菌Pseudomonas aeruginosa JM1 的溶藻效率随藻细胞浓度的增加而降低。
溶藻细菌主要通过直接溶藻和间接溶藻两种方式进行,前者直接进攻藻细胞,与藻细胞表面直接接触,甚至侵入藻细胞内而引起藻细胞裂解死亡,后者主要都是通过分泌抑制藻类生长或者溶解藻细胞的胞外物质来间接攻击藻类[20]。本研究表明,CBA02的菌体只有微弱的溶藻活性,远远低于菌液和无菌上清液处理组,表明菌株CBA02的溶藻方式是间接溶藻,直接溶藻方式的可能性不大,推测该菌株通过释放某些溶藻活性物质杀死盐生杜氏藻SCSIO-45153。CBA02的菌体也具有微弱的溶藻性可能由于藻菌共培养时菌体已生长至对数生长末期和环境的突然改变导致菌体仍会分泌少量的溶藻活性物质。
与本研究类似,目前已在生态学研究中报道了多种间接溶藻菌的存在,如Li等[20]发现溶藻菌LY03通过分泌几丁质酶溶解细胞壁使其裂解死亡。Yi等[21]报道了Acinetobacter sp.A2通过分泌杀藻物质4-羟基苯乙胺高效杀死铜绿微囊藻。Harvey等[22]报道Pseudoalteromonas piscida通过分泌群体感应信号分子前体改变菌藻互作关系,诱导赫氏圆石藻(Emiliania huxleyi)死亡。有关经济微藻养殖中溶藻细菌的鉴定、溶藻方式的确定及其溶藻特性的研究并不多见。
从图5中同时还可以看出,这些推定的溶藻物质具有较强的热稳定性,无菌过滤液经高温处理,其活性甚至高于未处理的无菌过滤液,一方面说明溶藻物质可能主要为耐高温的非蛋白结构成分,另一方面,说明过滤上清液中可能存在热敏、可抑制溶藻物质溶藻活性的成分,在高温处理后其抑制活性被解除,溶藻物质的溶藻活性得以提高。
由图7可见,酸碱条件对溶藻物质的活性具有显著的影响,较强酸性条件(pH2)时的溶藻活性非常低,但当pH 逐渐升高溶藻物质的溶藻活性也随之增强,高碱(pH10)时表现极强的溶藻活性,说明酸碱条件可能改变溶藻活性物质的稳定性、化学组成或结构及其与藻细胞的相互作用关系,从而改变其溶藻活性。
综上所述,菌株CBA02通过分泌溶藻物质间接方式杀死盐生杜氏藻SCSIO-45153,溶藻物质的主要成分可能为非蛋白成分,其溶藻特性受发酵时间、添加量、藻细胞初始浓度和pH的影响,同时具有热稳定性,高pH条件更适宜其溶藻作用,溶藻活性随着pH的降低逐步降低。这些特性对更好的追踪、阐明溶藻物质的化学结构、特性与作用机制,以及针对微藻养殖的溶藻现象建立适宜的防控技术,提供了重要的科学线索和实验基础,相关工作有待更进一步的探索。
4 结论
本研究从经济微藻开放池养殖池污染的蓝藻(Cyanobacterium sp.SCSIO-45682)中分离出1株溶藻菌CBA02,经16S rRNA 基因鉴定为Ponticoccus sp.CBA02。该菌对盐生杜氏藻SCSIO-45153具有极强的溶藻作用,胞外产生水溶性、热稳定、适宜较高pH的溶藻物质是溶藻现象发生的主要原因,其溶藻活性受菌液发酵时间、添加量、藻细胞初始浓度和pH等因素的影响。
