玉米铁还原酶基因ZmFRO2的功能分析
2020-12-04乔孟欣李素贞陈景堂
乔孟欣 李素贞 陈景堂
(1.河北农业大学农学院 国家玉米改良中心河北分中心 河北省作物种质资源实验室,保定 071000;2.中国农业科学院生物技术研究所,北京 100081)
Fe元素是植物生长发育过程中最重要的微量元素之一。Fe在地壳中的含量很高,但在有氧环境下,Fe易与羟基结合形成不溶态而不能被植物直接吸收利用[1]。在长期的进化过程中,高等植物形成了吸收Fe的不同机理:即机理I和机理II,相应的植物称为机理I植物和机理II植物[2]。机理I植物主要包括双子叶植物和非禾本科单子叶植物,机理I植物吸收铁分为3个步骤,首先H+-ATPase酸化土壤中的三价铁离子,随后FRO将土壤中的Fe3+还原成Fe2+,再由Fe2+转运蛋白(Iron-regulated transporter,IRT1/IRT2)将Fe2+转运至植物体内以供植物各部分生长发育[3];机理II植物主要包括禾本科植物,机理II植物则通过向胞外分泌植物铁载体(Phytoziderophore,PS)与土壤中的Fe3+螯合形成Fe3+-PS复合物,再由专一转运蛋白如黄色条纹蛋白(Yellow stripe-like,YSL)将Fe3+-PS复合物转运至植物根部细胞内[1]。
FRO基因是机理I植物吸收铁过程中非常重要的组成部分,目前,已在多种植物中被发现与研究,如拟南芥[4]、番茄[5]、大豆[6]、花生[7]、蒺藜苜蓿[8]和水稻[9]。值得注意的是,水稻是机理II植物,但是许多研究证明水稻根系中存在具有机理I特征的基因FRO和IRT的表达[9-14]。此外,将机理I和机理II中的关键基因转入水稻能显著提高其产量,Masuda等[15]将大麦麦根酸合成基因IDS3、酵母铁还原酶基因refre1/372和水稻铁载体分泌基因IRO2三种基因共同转入水稻得到转基因水稻IRI,发现IRI的产量比野生型高9倍。近期,一项研究用同位素示踪法揭示了水稻在铁充足水培条件下采用机理I吸收和转运铁,在缺铁田间条件下主要采用机理II[16]。以上关于水稻吸收转运铁机理的研究和发现在机理I与机理II之间架起了一座桥梁,也就是说,水稻可以采用两种机理结合的方式吸收转运铁。另外Wairich等[17]发现这种方式不是水稻特有的,也存在于与水稻近缘的物种中,这为想要提高作物植株或种子铁含量的育种家们打开了新视野。
玉米是全世界重要的粮食作物和饲用作物,玉米中微量元素的含量直接关系到人类的健康。然而,碱性土壤中,玉米极易受到缺铁胁迫所带来的危害。目前,科学家已经完成玉米全基因组测序,许多与机理I相关的基因或基因家族已经被分离并研究[18-19]。在转基因拟南芥中,ZmIRT1 和ZmZIP3在不同部位发挥积累锌铁元素的生理功能,FRO基因也已在玉米中预测到[20-21]。本研究对玉米铁还原酶基因ZmFRO2进行了生物信息学分析、表达模式分析、亚细胞定位分析、铁还原酶活力和锌铁含量测定以初步了解ZmFRO2在玉米中的功能。
1 材料与方法
1.1 ZmFRO2的识别与生物信息学分析
在玉米全基因组数据库(http://maizesequence.org/index.html)中用Blast搜寻与AtFRO2(GenBank accession No.Y09581)氨基酸序列具有同源性的基因,结果发现,在玉米中,FRO家族目前只有一名成员ZmFRO2。通过Clustal X Version 2.0对来自拟南芥、番茄、大豆、花生、蒺藜苜蓿、水稻、玉米等的FRO进行氨基酸序列比对并用BOXSHADE(http://www.ch.embnet.org/software/BOX_form.html)进行染色。用TMHMM预测蛋白质跨膜序列。用MEGA version 4.0对这些来自不同物种的19个FRO蛋白进行系统进化树分析。这些蛋白质的编号如下:Arabidopsis thaliana(AtFRO1:AEE27309.1,AtFRO2:AEE27308.1,AtFRO3:AEE30323.1,AtFRO4:AED93241.1,AtFRO5:AED93243.1,AtFRO6:AED95851.1,AtFRO7:AED95852.1,AtFRO8:AED95905.1);Lycopersicum esculentu(LeFRO1:AAP46144.1);Glycine max(GmFRO2:XP_003528841.1);Oryza sativa(OsFRO1:BAD18962.1,OsFRO2:BAD18963.1);Arachis hypogaea(AhFRO1:XP_025631421.1,AhFRO2:XP_025631421.1);Medicago truncatula(MtFRO1:AAR15416.1,MtFRO2:XP_003594430.1,MtFRO4:XP_003592210.2,MtFRO5:ABN06137.1,MtFRO6:BAD18962.1);Zea mays(ZmFRO2:ONM17159.1)。
1.2 ZmFRO2表达量的检测
先把蛭石用Hoagland营养液浸透,将玉米自交系B73种子点播于育苗盘中,在温室(14 h光照/10 h 黑暗,26℃)中培养,10 d幼苗长至2叶一心移入标准Hoagland(100 μmol/L Fe(III)-EDTA)营养液中生长5 d至三叶一心(每3 d换一次营养液),三叶一心的玉米幼苗在标准营养液和不加铁的条件下处理0、6、12、24、48、96 h后,分别收取幼苗地上部和根,液氮速冻后于-80℃保存用于总RNA的提取。用RNA提取试剂盒(HuaYueYang,Beijing,China)提取总RNA,用反转录试剂盒(TaKaRa,Japan)合 成cDNA,将cDNA稀 释20倍作为RT-PCR的模板,扩增引物为RTZmFRO2F 5'-AAACCAGCAAGCCTCCACTA-3' 和RTZmFRO2R 5'-ACATCGGTGATGATGCTCCT-3',体 系 为20 μL,包括:5 μL cDNA,上下游引物各10 μmol/L和10 μL SYBR Green I(TaKaRa),在CFX-96 Real Time Thermal Cycler中扩增。参照基因选用ZmActin1(GenBank:J01238.1),扩 增 引 物 为ZmActin1F 5'-ATGTTTCCTGGGATTGCCGAT-3' 和 ZmActin1R 5'-CCAGTTTCGTCATACTCTCCCTTG-3'。选 用ΔΔCt法计算相对表达量,2次生物学重复,3次技术重复。
1.3 融合表达载体的构建
将上述合成的cDNA稀释10倍作为扩增ZmFRO2 cDNA(去掉终止子)的模板,扩增引物为ZmFRO2GF 5'-CCCTCGAGCTTCCCGGGCCCCTAGA TTC-3' 和ZmFRO2GR 5'-GCTCTAGAGCTGTGGCTG TTGAAATGGAAG-3',用KOD酶(TOYOBO)扩增,扩增程序为:94℃ 3 min;94℃ 15 s,58℃ 1 min,68℃ 2 min 30 s,35个循环;68℃延伸10 min。将目的基因跑胶回收后构建至pRTL2NGFP 载体,融合质粒纯化后(1-2 μg/μL)用于转化玉米叶肉原生质体。
1.4 玉米叶肉原生质体的制备及转化
将玉米自交系B73种子种植于用水浸透的蛭石中,置于28℃培养箱中,不提供光照。待玉米黄化苗生长至三叶一心时,取第二片叶子中间部分,用刀片切成0.5-1 mm的细丝;加入酶解液后置于水平摇床(30 r/min)上室温遮光消化3-4 h;加入等体积的W5缓冲液混匀终止消化;过滤酶解液,100 g,离心1 min,沉淀原生质体;用预冷的 W5 缓冲液重悬沉淀,冰上放置30 min后计数;4℃,100×g,离心1 min,沉淀原生质体;加入MMg溶液至原生质体的终浓度约为106个/mL;向200 μL原生质体中加入20 μL已纯化好的质粒,再加入220 μL 40%的PEG-Ca2+溶液,用手轻弹混匀,室温放置30 min;加入880 μL缓冲液W5,用手轻弹混匀,室温,100×g,离心1 min;吸弃上清,加入1 mL W5缓冲液,室温黑暗孵育12-16 h,荧光显微镜观察。
1.5 过表达载体的构建及转基因玉米的获得
将上述合成的cDNA稀释10倍作为扩增ZmFRO2 cDNA(全长)的模板,扩增引物为35SZmFRO2F 5'-CCAGATCTCTTCCCGGGCCCCTAGA TTC-3' 和35SZmFRO2R 5'-GCGGTCACCTGAACCGA CCAAACGAGACG-3',用KOD酶(TOYOBO)扩增,扩增程序为:94℃ 3 min;94℃ 15 s,58℃ 1 min,68℃ 2 min 30 s,35个循环;68℃延伸10 min。将目的基因跑胶回收后构建至pCAMBIA3301载体,融合质粒转化农杆菌后用于侵染HiII玉米幼胚[22]。出苗后移至大田与郑58杂交后再连续回交,收取BC2F1代种子进行表达量检测后用于下一步试验。
1.6 玉米根部铁还原酶活力的测定
将转基因与非转基因玉米种子置于润湿的滤纸上发芽,14 h光照/10 h黑暗,28℃培养室培养,待根长约为2-3 cm时,移入标准Hoagland营养液中生长至2叶一心,随后对所有幼苗进行缺铁处理,0、1、3、5、9 d后,检测转基因与非转基因玉米幼苗根部的铁还原酶活力。用检测液(0.2 mmol/L CaSO4,5 mmol/L HEPES,pH5.5,0.1 mmol/L Fe(III)-EDTA,0.2 mmol/L BPDS)清洗幼苗根部;将幼苗根部浸没于含有50 mL检测液的锥形瓶中,于25℃黑暗条件下孵育1 h;将幼苗根部取出,摇晃混匀,于535 nm下读取溶液的吸光值A,检测液作为空白对照;用吸水纸除去幼苗根部残余溶液,称量幼苗根部鲜重FW;用消光系数28.6 mM-1cm-1计算Fe(II)-BPDS浓度,根据比尔定律计算:铁还原酶活力(nmol/g FW/h)=5A/(28.6×FW)×104。本试验共测定2个转基因事件(OX-1和OX-2),每个事件3次重复,每次重复包含1株幼苗,选择分离出的阴性植株作为对照。
1.7 玉米锌铁含量的测定
将转基因与非转基因玉米种子分别点播于用水浸透的蛭石和盆栽碱性土壤中,14 h光照/10 h黑暗,28℃培养,分别收取三叶一心期幼苗地上部与根部,吐丝期授郑58花粉,成熟后收取棒三叶与籽粒,将材料洗净,烘干用于测定锌铁含量。将烘干后的材料粉碎后称取幼苗地上部,棒三叶各0.3 g,籽粒0.4 g,幼苗根部0.1 g;将称量好的样品倒入消解罐底部,向其中加入7 mL硝酸,过夜消化;加入1 mL H2O2微波消解,彻底消化;将溶液小心转移至容量瓶中(幼苗根部及籽粒溶液转移至25 mL容量瓶,幼苗地上部及棒三叶溶液转移至50 mL容量瓶),用超纯水定容,摇匀后过滤,滤出液4℃保存待测;用原子吸收光谱仪测定各样品锌铁含量;计算:根/籽粒锌铁浓度(μg/g)=机器测定浓度(μg/mL)×25 mL/样品干重(g);幼叶/棒三叶锌铁浓度(μg/g)=机器测定浓度(μg/mL)×50 mL/样品干重(g)。共测定2个转基因事件(OX-1和OX-2),每个事件3次重复,每次重复3株混收,籽粒每株2粒,共6粒,选择分离出的阴性植株作为对照。
2 结果
2.1 氨基酸序列比对
为了找到玉米中的铁还原酶基因家族,本研究利用已经报道的AtFRO2的氨基酸序列在玉米基因组数据库中进行BLAST,仅有一个FRO基因被找到,即ZmFRO2。ZmFRO2基 因 全 长4 590 bp,cDNA序列长2 585 bp,该基因编码的蛋白质具有759个氨基酸,10个跨膜区域,1个FAD结合区,一个NADPH结合区,在V和VII跨膜区域上有两对组氨酸残基构成的亚铁血红素结合区,在VIII跨膜区域内存在氧化还原标志序列(图1)。这些特征在各物种中的FRO之间高度保守。说明ZmFRO2具有发挥铁还原酶功能的结构基础。
2.2 系统进化树分析
ZmFRO2与AtFRO1、AtFRO2、AtFRO3、AtFRO4、AtFRO5、AtFRO6、AtFRO7、AtFRO8、LeFRO1、GmFRO2、AhFRO1、MtFRO1、MtFRO2、MtFRO4、MtFRO5、MtFRO6、OsFRO1、OsFRO2等18种FRO蛋白之间的进化树分析表明 ZmFRO2与OsFRO1 处于同一分支,且两者与MtFRO2、AtFRO6 和 AtFRO7联系紧密并处于同一分支簇中(图2)。推测ZmFRO2在玉米植株中的特性与功能与OsFRO1在水稻中,MtFRO2在蒺藜苜蓿中以及AtFRO6 和 AtFRO7在拟南芥中的特性与功能类似。
2.3 ZmFRO2田间表达模式分析
为了在整体上了解玉米中ZmFRO2的表达模式,在田间正常生长的玉米植株上进行取样,取样部位分别为冠根(C-root)、侧根(L-root、)、茎(Stem)、叶(Leaf)、叶鞘(Sheath)、雄穗(Tassel)、花药(Anther)、穗轴(Cob)、花丝(Silk)、种皮(Husk)、授粉后10 d的种子(10 seed)、授粉后15 d的胚(15 E)、授粉后15 d的胚乳(15 En)、授粉后20 d的胚(20 E)、授粉后20 d 的胚乳(15 En),对这15个样品进行RT-PCR以得到ZmFRO2在这些部位中的相对表达量,结果(图3)表明,ZmFRO2在叶片中的表达量远远高于在其他部位中的表达量,其次是在叶鞘中的表达量较高。说明在田间正常条件下,玉米中的ZmFRO2主要在叶片中表达。
2.4 ZmFRO2缺铁处理表达模式分析
为了解玉米在缺铁条件下ZmFRO2的表达模式,在缺铁处理后不同时刻(0 h、6 h、12 h、24 h、48 h、96 h)分别收取玉米幼苗地上部全部叶片及地下部所有根系进行RT-PCR。结果显示,在缺铁处理24 h时,玉米叶片中ZmFRO2的表达量显著高于对照,而24 h后,显著低于对照(图4-A);在缺铁处理6 h时,玉米根部ZmFRO2的表达量显著高于对照,而6 h后,显著低于对照(图4-B)。从试验结果可以看出,缺铁条件对玉米叶片和根部ZmFRO2表达的调控均具有暂时性,叶片在缺铁处理24 h之后,根部在缺铁处理6 h之后,仍受到缺铁条件的胁迫,甚至ZmFRO2的表达量比对照组还低,说明缺铁条件在某一特定时间诱导,之后则抑制ZmFRO2的表达。根部对缺铁胁迫更为敏感。
2.5 ZmFRO2的亚细胞定位
亚细胞定位能够实现目标蛋白在细胞内的精确定位,有助于在细胞水平上理解目的基因的表达特性。本试验构建了pRTL2NGFP-ZmFRO2融合表达载体并转化玉米叶肉原生质体,荧光显微镜下分别开启绿色激发光、红色激发光、绿色和红色激发光和明场观察发现,ZmFRO2融合蛋白定位于质膜与胞质(图5),跟与其亲缘关系较近的OsFRO1在水稻中、AtFRO6和AtFRO7在拟南芥中的定位均有所不同,ZmFRO2在玉米中的亚细胞定位有其独特性。


图1 ZmFRO2与其他FRO的氨基酸序列比对

图2 ZmFRO2与其他FRO的系统进化树分析

图3 土壤条件下ZmFRO2在玉米各部位的表达模式
2.6 转基因玉米ZmFRO2表达量检测
利用农杆菌介导法将pCAMBIA3301-ZmFRO2过表达载体(图6-A)转化玉米,为确认ZmFRO2基因在玉米植株中是否过表达,取转基因与非转基因玉米植株(BC2F1)叶片提取总RNA,进行Realtime PCR扩增检测目的基因相对表达量,郑58作为对照。结果显示,过表达玉米植株中ZmFRO2基因的相对表达量显著高于非转基因玉米植株,是非转基因植株的10-15倍(图6-B),说明在回交转育材料中ZmFRO2基因确实过量表达,该批回交转育材料可作为试验材料进行以下试验。

图4 不同供铁条件下ZmFRO2在玉米幼苗叶片和根部的表达模式
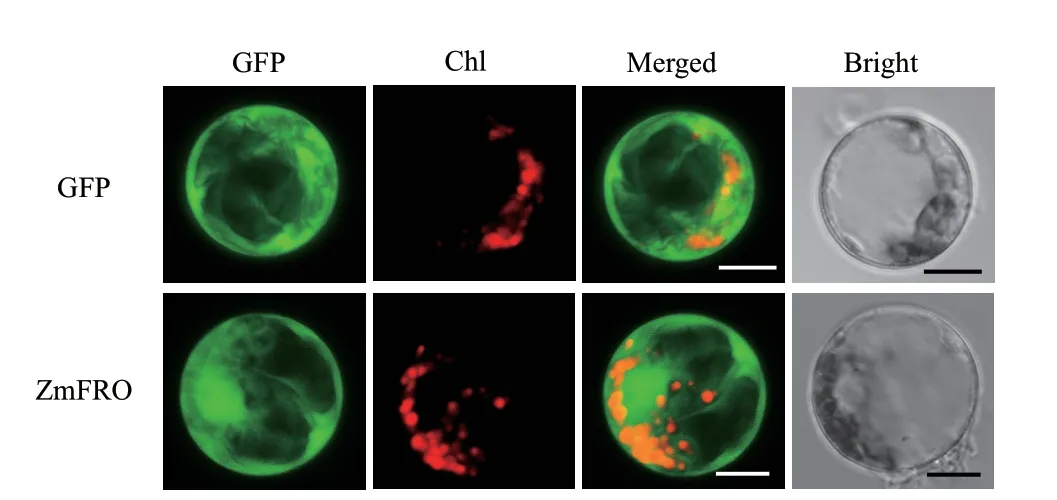
图5 ZmFRO2在玉米叶肉原生质体中的定位
2.7 转基因玉米根部铁还原酶活力的测定
为了解ZmFRO2在玉米中的生理活性,本试验测定了在缺铁处理0、1、3、5和9 d时转基因和野生型玉米幼苗根部的铁还原酶活力,野生型作为对照。结果(图7)显示,在缺铁处理0、1、3和5 d时转基因和野生型玉米幼苗根部的铁还原酶活力均维持在较低水平,最高不超过205.57 nmol/g FW/h,而且在缺铁处理3 d时,转基因和野生型玉米幼苗根部受到的缺铁胁迫最为严重,两者根部的铁还原酶活力均出现最低值,最低为14.51 nmol/g FW/h。此后,转基因玉米幼苗根部的铁还原酶活力逐渐增加,到缺铁处理9 d时,事件OX-2玉米幼苗根部铁还原酶活力极显著高于野生型玉米幼苗8.35倍,为631.08 nmol/g FW/h,而事件OX-1玉米幼苗根部铁还原酶活力还未表现出显著差异。由此可以看出,在缺铁条件下,过表达ZmFRO2基因能够提高玉米幼苗根部的铁还原酶活力,该基因所编码的蛋白可能具有铁还原酶功能。

图6 ZmFRO2在转基因玉米中的表达
2.8 转基因玉米锌铁含量的测定
为了解过表达ZmFRO2基因对于玉米幼苗或植株锌铁含量的影响,本试验测定了转基因和野生型玉米幼叶、幼根、成熟叶及籽粒的锌铁含量,野生型作为对照。结果显示,转基因玉米幼苗根部的铁含量显著高于野生型玉米幼苗6.84-11.82倍,同时转基因玉米幼苗根部的锌含量显著高于野生型玉米幼苗8.44-9.40倍(图8-B),说明过表达ZmFRO2基因不仅能够增加玉米幼苗根部的铁含量,而且也能够间接促进Zn在玉米幼苗根部的积累。另外转基因玉米幼叶、成熟叶和籽粒中的Fe含量均近于或显著高于野生型玉米植株,事件OX-2幼叶中的铁含量比野生型增加23.43%(图8-A),成熟叶增加42.53%(图8-C),籽粒增加17.11%(图8-D),所以过表达ZmFRO2基因能够不同程度增加玉米幼叶、根部、成熟叶以及籽粒中的铁含量。
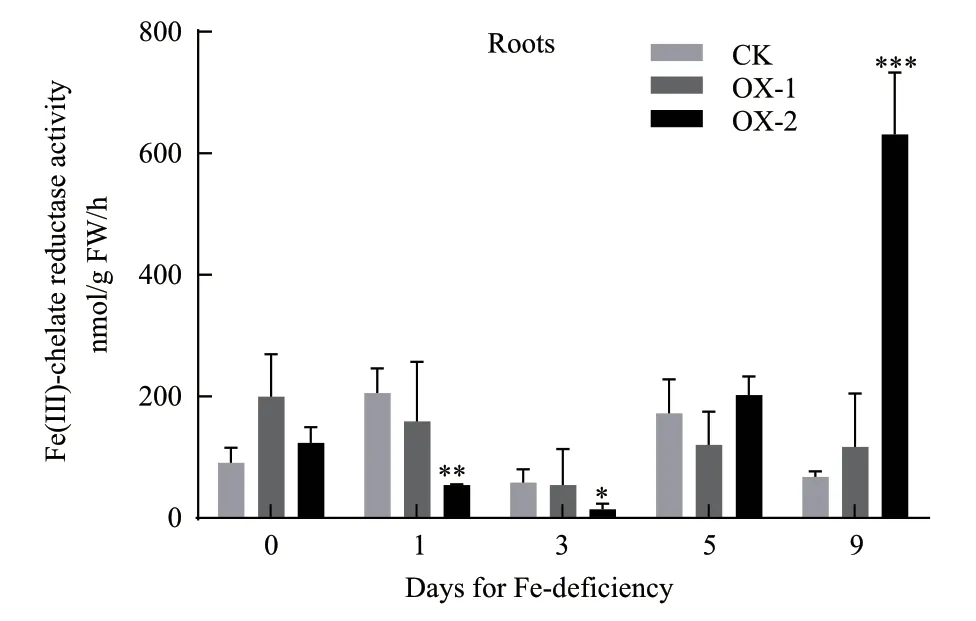
图7 ZmFRO2过表达玉米根部铁还原酶活力
3 讨论
截至目前,FRO家族基因已经在多种高等植物中被发现与研究,如拟南芥、番茄、大豆、水稻、花生、蒺藜苜蓿等。但在玉米中还鲜有报道,那么玉米中的FRO是否与上述高等植物中的FRO一样具有还原铁的功能呢?本研究中,利用拟南芥AtFRO2的氨基酸序列在玉米基因组数据库中搜寻到ZmFRO2基因,为了解ZmFRO2与其他植物FRO的结构相似性和进化关系,在ZmFRO2和上述植物中已报道的FRO之间进行了氨基酸序列比对和系统进化树分析。结果表明,ZmFRO2同样具有10个跨膜结构域,有富含组氨酸的金属离子结合区和氧化还原特征区域,具有铁还原酶的结构基础,推测ZmFRO2可能具有还原铁的能力;与OsFRO1、MtFRO2、AtFRO6和AtFRO7亲缘关系较近,其中与OsFRO1的亲缘关系最近,推测ZmFRO2可能与OsFRO1来自同一祖先,与OsFRO1、MtFRO2、AtFRO6和AtFRO7的特性相似。
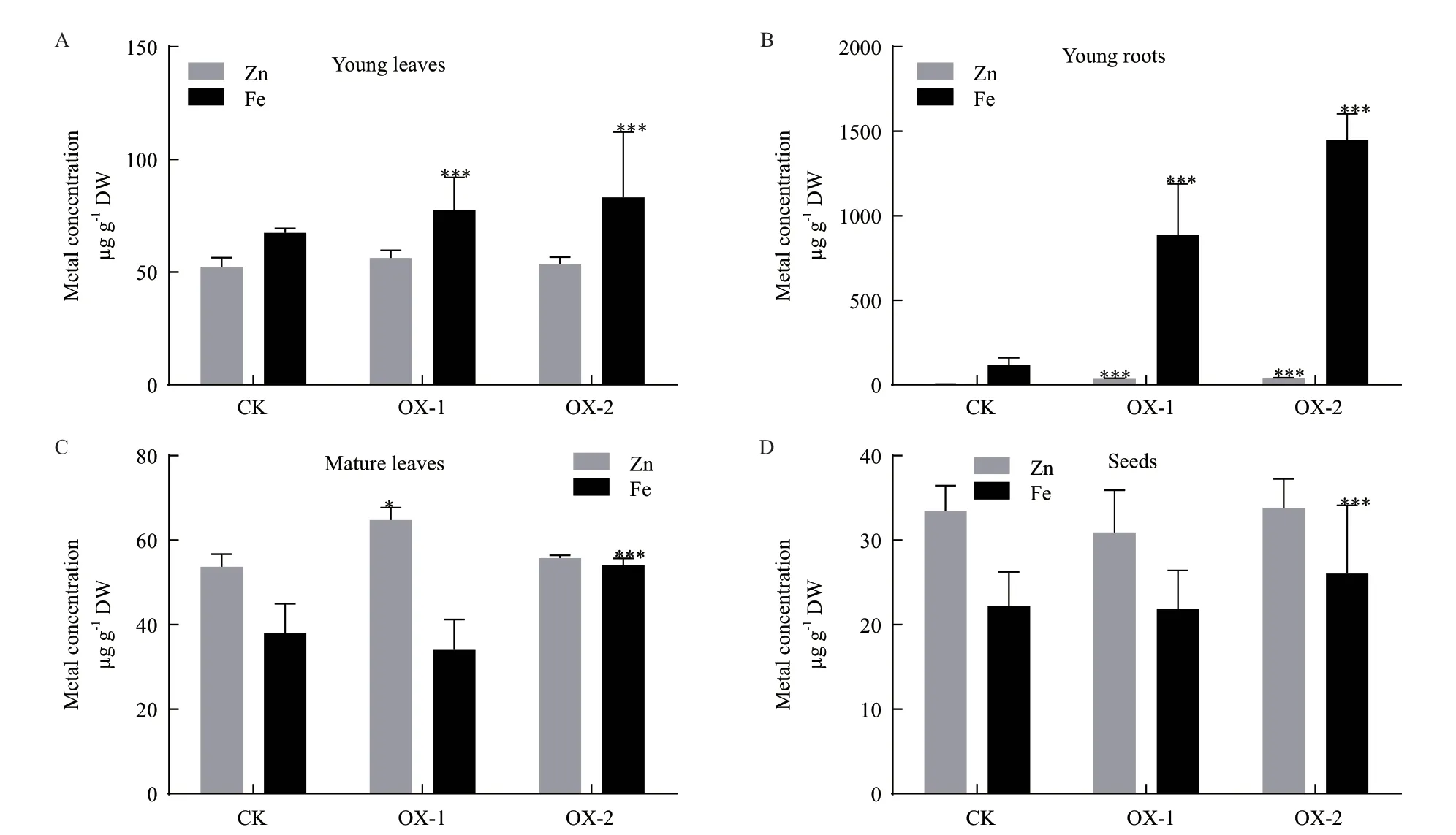
图8 ZmFRO2过表达玉米各部位锌铁含量
FRO家族基因的主要表达部位以及缺铁条件下的表达模式已经被广泛研究。总体来说,各FRO基因的表达部位不尽相同,但大部分FRO基因的表达量会因缺铁诱导而升高。AtFRO2主要在拟南芥根部表达并受缺铁诱导[23],AtFRO6和AtFRO7主要在拟南芥地上部表达,表达水平稳定,不受缺铁诱导[24-25],AtFRO3和AtFRO8主要在拟南芥维管系统中表达并受缺铁诱导[26],LeFRO1在番茄植株各部位均有表达,在根中的表达受缺铁诱导[27],GmFRO2主要在大豆地上部表达并受缺铁诱导[6],OsFRO1和OsFRO2在水稻叶片中表达,OsFRO2的表达可由铁过量或持续性缺铁诱导[10-11],MtFRO1、MtFRO3-6在蒺藜苜蓿地上部表达并受缺铁诱导[8]。本研究中,ZmFRO2主要在玉米叶片表达,跟与其亲缘关系较近的OsFRO1、AtFRO6和AtFRO7相似;在缺铁处理的幼苗中,ZmFRO2在叶片和根部的表达量均出现先升高后降低的趋势,叶片和根部分别在缺铁处理24 h时和6 h时表达量升高,之后降低,推测缺铁条件对ZmFRO2的表达先诱导后抑制。
前人研究发现,AtFRO2定位于质膜,具有还原Fe3+的功能[28];AtFRO6和AtFRO7的亚细胞定位分别为质膜和叶绿体,AtFRO6具有在叶片质膜上还原Fe3+的功能[29],AtFRO7可能在类囊体薄膜上参与Fe3+的还原,进而促进细胞色素等的合成;AtFRO3和AtFRO8定位在线粒体[25],与线粒体铁转运蛋白MIT1和MIT2协同作用维持线粒体与胞质之间的铁平衡[30];OsFRO1定位在液泡膜,参与维持液泡与胞质之间的铁平衡[31];LeFRO1定位在细胞膜,具有铁还原酶功能[32]。本研究中,玉米叶肉原生质体的制备及转化试验结果显示,ZmFRO2定位在质膜与胞质,推测ZmFRO2在质膜上和胞质中发挥还原Fe3+的功能,既能还原胞外Fe3+,又能还原胞内Fe3+。
因为ZmFRO2基因所编码的蛋白是玉米铁还原酶,所以想要了解ZmFRO2基因的生理功能,必不可少的就是检测转基因玉米的铁还原酶活力。Paolacci等[33]发现缺铁条件能够显著提高番茄根部的铁还原酶活力。Andaluz等[34]发现在缺铁处理5 d后,蒺藜苜蓿根部的铁还原酶活力显著增强。Masuda等[35]将酵母的铁还原酶基因refre1/372转入水稻中发现在缺铁处理3 d后水稻根部铁还原酶活力升高,表明酵母铁还原酶基因具有铁还原酶功能。本研究中,对转基因和非转基因玉米幼苗进行缺铁处理,缺铁处理0、1、3、5、9 d时检测根部铁还原酶活力,结果显示,在缺铁处理9 d后,转基因玉米幼苗根部的铁还原酶活力出现显著升高,约为非转基因玉米幼苗的10倍,推测ZmFRO2基因所编码的蛋白具有铁还原酶活性。事件OX-1没有表现出铁还原酶活力的显著升高,可能原因一是缺铁处理天数不足,可能会在后期出现显著升高;二是本试验中收取单株检测,并没有混收,存在因单株基因型不同导致的表型差异问题。
铁还原酶活性的增强有利于植株对铁的吸收、转运和积累。转refre1/372基因水稻由于根部铁还原酶活力提高,植株及籽粒中的铁含量均显著增加[35]。本研究对转基因玉米幼苗、植株或种子进行了锌铁含量的测定,分别混合收取三叶期幼苗叶和根,成熟后的棒三叶和籽粒(BC3F1)烘干磨碎消解后用原子吸收分光光度计测定锌铁含量。结果显示,幼苗根部Fe和Zn的含量均显著增加,表明ZmFRO2基因能够促进Fe在幼苗根部的积累,同时能够间接促进幼苗根部对Zn的吸收,这与Vasconcelos等[28]对AtFRO2的研究结果一致:AtFRO2不仅可以提高Fe的转运效率,也可间接促进Zn、Cu、Mn、K、Ni等其他离子的转运;幼苗叶片、棒三叶、籽粒中的Fe含量也出现显著增加,推测ZmFRO2基因能够还原更多的Fe到幼苗根部,再次还原更多的Fe到叶片,最终增加籽粒中的Fe含量。事件OX-1成熟叶片中的Fe含量增加不显著可能是在成熟过程中叶片中的Fe向繁殖器官大量转移的原因。
基于目前研究结果,在下一步试验中,本研究将会深入进行对该基因的功能验证,包括ZmFRO2对玉米表型的贡献、对产量相关性状的影响,调控因素和调控机理等,为玉米品质育种提供新的功能基因和基础材料,为提高玉米锌铁含量提供新的途径。
4 结论
搜寻到预测基因ZmFRO2,该基因为玉米FRO基因家族唯一成员,ZmFRO2具有其他植物FRO蛋白所具有的10个跨膜区域,FAD结合区,NADPH结合区,亚铁血红素结合区和氧化还原标志序列;ZmFRO2与OsFRO1、MtFRO2、AtFRO6 和 AtFRO7亲缘关系较近。ZmFRO2是铁还原酶。
ZmFRO2主要在玉米叶片中表达,缺铁处理0 h-96 h内,幼苗叶片及根部ZmFRO2的表达分别在24 h和6 h被诱导,之后则被抑制,推测ZmFRO2在叶片和根参与Fe3+的还原。亚细胞定位分析表明ZmFRO2定位在质膜和胞质,推测ZmFRO2在质膜上和胞质内参与Fe3+的还原,既能还原胞外Fe3+,又能还原胞内Fe3+。
缺铁条件下,过表达ZmFRO2能够提高铁还原酶活力、增加植株及籽粒的铁含量,推测ZmFRO2具有铁还原酶活性及功能。
