紫杉醇耐药细胞株SKOV3/TS的建立及多药耐药性比较
2020-12-04尹茳平黎丹戎
尹茳平,王 琪,张 玮,黎丹戎,李 力*
0 引言
卵巢癌是我国致死率最高的妇科恶性肿瘤,初始治疗以手术联合化疗为主,其中紫杉醇联合铂类是最常用的一线化疗方案之一[1]。紫杉醇成分复杂,其抗癌活性成分属于四环二萜类化合物,主要通过影响α、β微管蛋白的动态平衡以及二聚体的形成,抑制肿瘤细胞增殖并促其凋亡[2]。在长期治疗中,与其他化疗药物类似,紫杉醇也会出现继发性耐药[3]。深入探讨卵巢癌细胞对紫杉醇的耐药机制,对于提高紫杉醇的临床应用和疗效具有十分重要的价值。目前基础研究多选择二维培养的耐药细胞模型,包括浓度梯度递增法、间歇诱导法等[4],但都存在一定的局限性。近年来,三维细胞模型培养备受关注[5],本文拟通过二维和三维培养系统构建不同的SKOV3紫杉醇耐药细胞株,为建立理想的体外耐药细胞模型提供一定的理论依据。
1 材料与方法
1.1 主要材料和仪器
1.1.1 实验细胞 人卵巢癌细胞株SKOV3购自中国科学院上海生物细胞研究所。
1.1.2 实验药物 紫杉醇(TAX,规格:30 mg,国药准字H10980068,山东齐鲁制药厂)、奥沙利铂[L-OHP,规格:50 mg,国药准字H20093892,费森尤斯卡比(武汉)医药有限公司]、吉西他滨(GCB,规格:200 mg,国药准字H20030104,江苏豪森药业集团有限公司)、米托蒽醌(MIT,规格:5 mg,国药准字H10960189,四川升和药业股份有限公司)、环磷酰胺(CTX,规格:200 mg,国药准字H32020857,江苏恒瑞医药股份有限公司)。
1.1.3 主要试剂 Ⅰ型鼠尾型胶原和噻唑蓝(MTT),美国Sigma公司;Ⅰ型胶原酶、RPMI1640培养液、特基胎牛血清和胰蛋白酶,美国Hyclone公司;实时定量PCR试剂盒,大连宝生生物工程有限公司。
1.1.4 主要仪器 超净工作台,山东BIOBASE科学仪器有限公司;CKX41-A32PH型倒置相差显微镜,日本奥林巴斯;酶标仪,美国Molecular公司。
1.2 实验方法
1.2.1 单层(二维)细胞培养 取冻存SKOV3细胞,室温下复苏后,加入RPMI1640完全培养液,置于无菌条件下的CO2培养箱内培养。次日更换培养液,待细胞融合率超过70%时,用0.25%胰蛋白酶溶液进行消化,继续传代培养。
1.2.2 浓度梯度递增法建立SKOV3/TS-1耐药细胞株 取对数期生长的SKOV3细胞,置于细胞培养皿中,细胞浓度为2×106个/ml。加入0.02 μg/ml紫杉醇溶液,48 h后更换为正常培养液,继续培养2~3周后,逐级递增紫杉醇干预浓度,待SKOV3细胞可在0.1 μg/ml的含药培养液中稳定生长,即得到SKOV3/TS-1耐药细胞株。
1.2.3 三维细胞培养 采用Liquid Overlay技术,取对数期生长的SKOV3细胞,接种于含有胶原培养液(ddH2O∶PBS∶胎牛血清∶Ⅰ型鼠尾型胶原∶RPMI1640培养液=1∶1∶1∶2∶5,pH值7.0)的培养皿中,细胞浓度为2×106个/ml。置于37 ℃、CO2培养箱内培养1.5 h,待完全凝固成为细胞培养层后,加入RPMI1640培养液作为覆盖层,隔日更换一次新鲜培养液。将得到的细胞命名为SKOV3/TS-2。
1.2.4 细胞形态学观察 利用倒置相差显微镜,观察二维培养及三维培养条件下的SKOV3/TS-1和SKOV3/TS-2细胞形态学变化,拍照记录。
1.2.5 药物敏感性测定 取二维培养的SKOV3细胞和SKOV3/TS-1细胞,调整细胞浓度为1×104个/ml。以100 μl/孔接种于96孔板中,置于37 ℃、CO2培养箱内培养24 h,待贴壁生长后,更换含药培养液,继续培养72 h。另取三维培养的SKOV3/TS-2细胞,以相同方式接种于含有胶原培养液的96孔板中,覆盖层培养液中加入不同药物干预,继续培养72 h。采用MTT法检测细胞增殖抑制率,绘制抑制率曲线,计算半数抑制浓度(IC50)和耐药指数(Resistance index,RI)。药物浓度设定参考临床用量的血药峰浓度,上下浮动55倍,见表1。
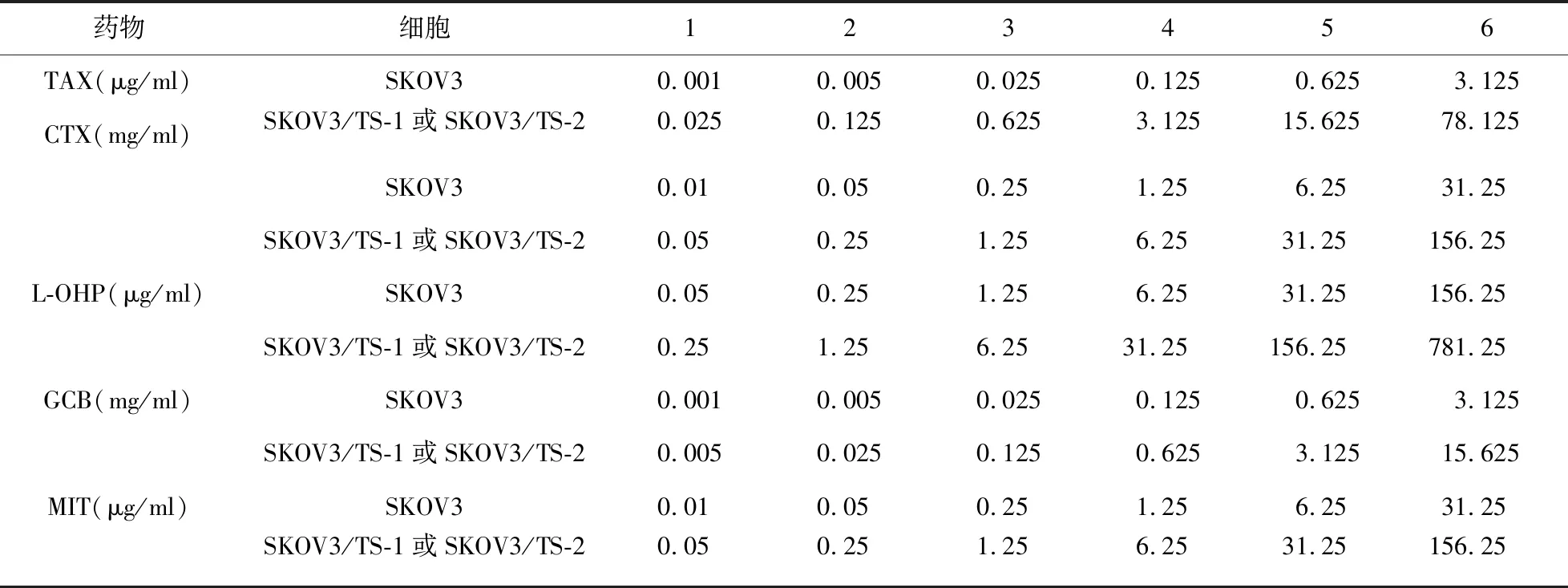
表1 交叉耐药的药物浓度设定
RI=IC50(SKOV3/TS)/IC50(SKOV3)
1.2.6 实时荧光定量PCR法检测多药耐药相关基因 收集SKOV3细胞、SKOV3/TS-1或SKOV3/TS-2细胞1×107个,加入TRIzol试剂提取总RNA。采用逆转录试剂盒制备cDNA。逆转录条件:16 ℃ 30 min、42 ℃ 30 min,最后80 ℃ 5 min。以cDNA为模板,采用实时荧光定量PCR试剂盒进行基因扩增,反应条件:95 ℃ 5 min,90 ℃ 10 s,60 ℃ 15 s,72 ℃ 1 min,40个循环。内参选择β-actin。以2-△△CT法计算目的基因的表达量。β-actin引物:上游引物5′-CTC CAT CCT GGC CTC GCT GT-3′;下游引物5′-GCT GTC ACC TTC ACC GTT CC-3′。多药耐药基因1(Multidrug resistance 1,MDR1)引物:上游引物5′-GGA CTG AGC CTG GAG GTG AAG AA-3′;下游引物5′-CGC TCC TTG ACT CTG CCA TTC TG-3′。β-微管蛋白Ⅲ型(β-tubulin-III,TUBB3)引物:上游引物5′-CGC GGA TCC GCA GGA AAT TTA GAA GA-3′;下游引物5′-CCG GAA TTC TTA GGC ATA CCT GGT CAT GTC TCC-3′。谷胱甘肽S转移酶π(Glutathione s-transferase-π,GST-π)引物:上游引物5′-CCA ATA CCA TCC TGC GTC AC-3′;下游引物5′-TCA CTG TTT CCC GTT GCC CAT-3′。

2 结果
2.1 SKOV3细胞、SKOV3/TS-1细胞、SKOV3/TS-2细胞形态学观察 经倒置相差显微镜观察,二维培养的SKOV3细胞和SKOV3/TS-1细胞呈贴壁生长,细胞体积较小,形态均匀一致。与SKOV3细胞相比,SKOV3/TS-1细胞大小、形状不一,且细胞体积偏大,核分裂相增多。而三维培养的SKOV3/TS-2细胞呈圆形,悬浮于胶原培养液中聚团生长,多细胞球大小不一、形状不规则。见图1。

图1 倒置相差显微镜观察SKOV3细胞(A)、SKOV3/TS-1细胞(B)、SKOV3/TS-2细胞(C)形态学特点
2.2 SKOV3细胞、SKOV3/TS-1细胞、SKOV3/TS-2细胞对TAX敏感性检测 经MTT法检测,SKOV3细胞、SKOV3/TS-1细胞、SKOV3/TS-2细胞对TAX药物的IC50为(0.240±0.078)μg/ml、(4.285±0.538)μg/ml、(3.540±0.356)μg/ml,SKOV3/TS-1细胞和SKOV3/TS-2细胞RI分别为17.85和14.75。见图2、表2。
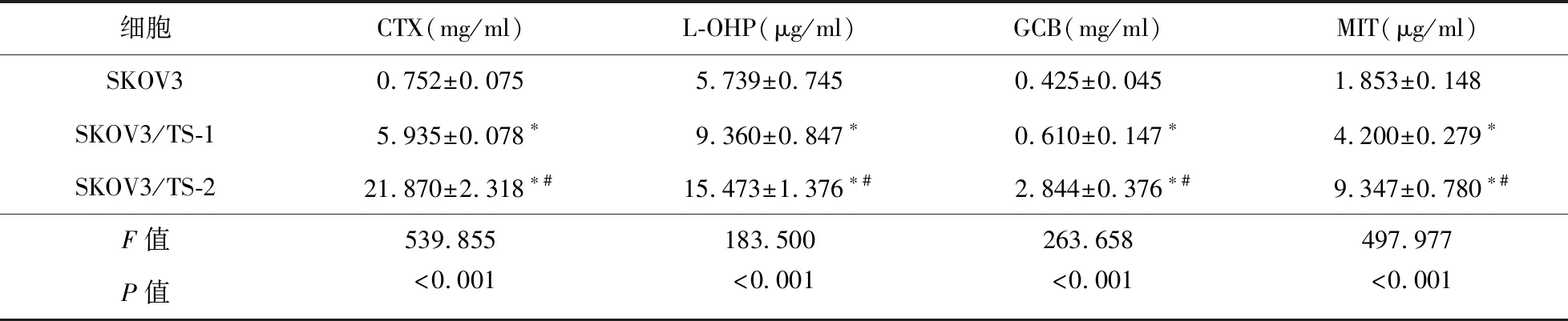
表2 其他化疗药物对SKOV3/TS-1细胞和SKOV3/TS-2细胞增殖抑制的IC50
2.3 SKOV3/TS-1细胞和SKOV3/TS-2细胞对其他化疗药物交叉耐药性检测 经MTT法检测,SKOV3/TS-1细胞和SKOV3/TS-2细胞对CTX、L-OHP、GCB、MIT均有一定的耐药性,且SKOV3/TS-2细胞的耐药性高于SKOV3/TS-1细胞,差异有统计学意义(P<0.05)。见图3。
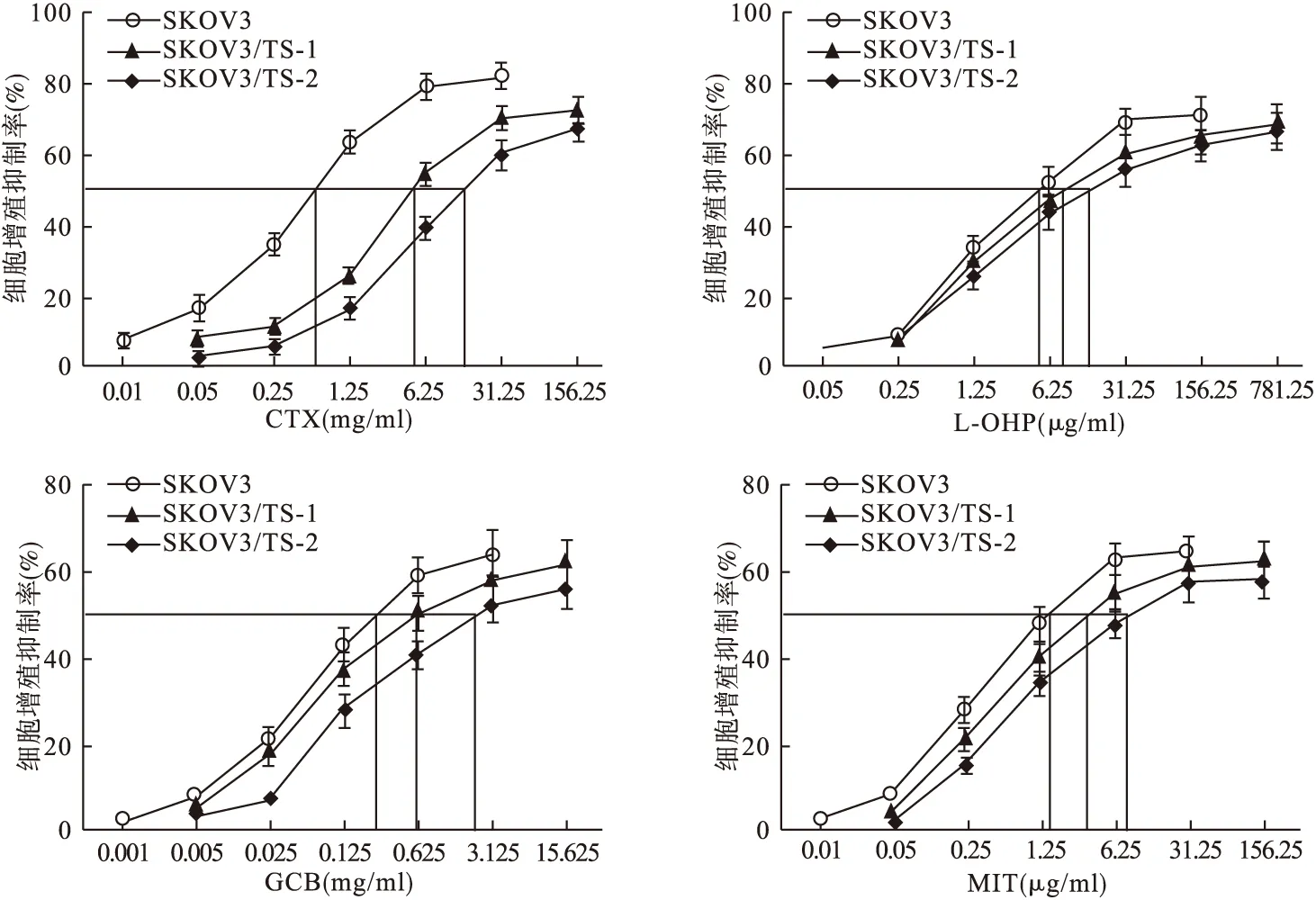
图3 不同化疗药物干预条件下SKOV3细胞、SKOV3/TS-1细胞、SKOV3/TS-2细胞增殖曲线
2.4 SKOV3/TS-1细胞和SKOV3/TS-2细胞多药耐药相关基因表达变化 经实时荧光定量PCR法检测,SKOV3/TS-1细胞和SKOV3/TS-2细胞TUBB3mRNA和MDR1mRNA表达量高于SKOV3细胞,差异有统计学意义(P<0.05);而3种细胞GST-π mRNA表达基本一致,差异无统计学意义(P>0.05)。见表3。
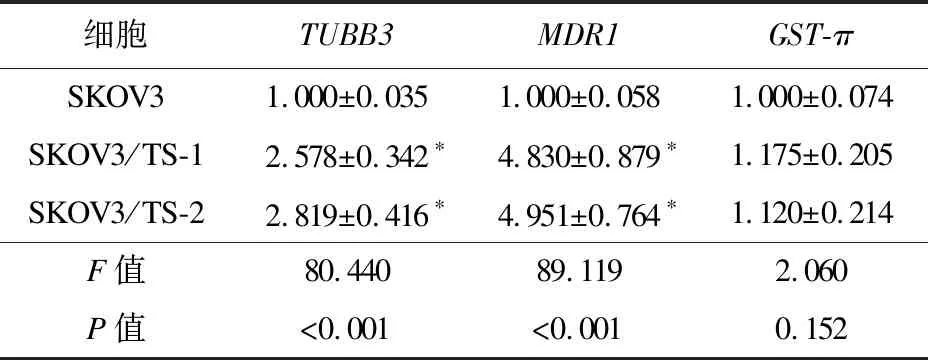
表3 SKOV3/TS-1细胞和SKOV3/TS-2细胞多药耐药相关基因表达差异
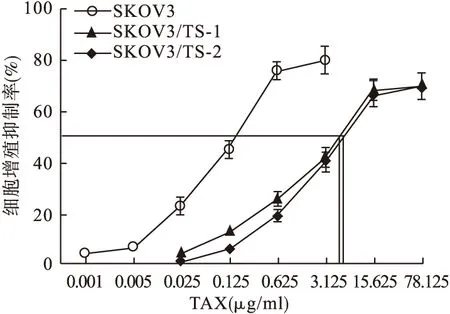
图2 不同TAX干预条件下SKOV3细胞、SKOV3/TS-1细胞、SKOV3/TS-2细胞增殖曲线
3 讨论
紫杉醇是卵巢癌一线化疗药物之一[6],但是耐药性问题一直是困扰临床的重要难题。耐药细胞株模型的建立,对于深入阐述肿瘤细胞的耐药机制、逆转多药耐药性以及提高临床化疗效果有重要价值。既往的基础研究中最常采用的耐药细胞株都属于单层贴壁(二维)培养系统,包括高浓度间歇诱导法[7]、药物浓度递增诱导法[8]、高浓度反复间歇诱导与药物浓度递增相结合法[9]等,一方面由于操作步骤繁琐、药物剂量不好把握、培养周期过长等,另一方面不能完全模拟体内肿瘤微环境,因此耐药性有限,在实验过程中存在一定的局限性。
注:*与SKOV3细胞相比,P<0.05;#与SKOV3/TS-1细胞相比,P<0.05
注:*与SKOV3细胞相比,P<0.05
三维细胞培养系统是近年新发展的一项细胞培养技术,利用具有三维结构的支架材料作为载体[10],例如本研究中所使用的Ⅰ型鼠尾型胶原,此外还包括琼脂糖、Matrigel、壳聚糖、明胶等,与细胞共同培养,通过构建细胞-细胞-载体三维空间结构,既能保留天然细胞微环境的物质结构基础,又能更好地模拟体内细胞生长的微环境[11],因此,三维培养系统得到的细胞更贴近体内肿瘤微环境,对于耐药机制的研究更具有临床指导价值。
本研究分别通过二维培养系统和浓度梯度递增法建立TAX耐药细胞株SKOV3/TS-1,通过三维培养系统建立SKOV3/TS-1细胞株,通过MTT法验证,两种细胞模型对TAX均具有显著耐药性,RI分别为17.85和14.75。说明SKOV3/TS-1细胞和SKOV3/TS-2细胞对TAX的敏感性均低于亲本细胞SKOV3,但是单纯从耐药指数分析,SKOV3/TS-1细胞和SKOV3/TS-2细胞对TAX的耐药性差别不明显。另外,通过倒置相差显微镜观察两种细胞的形态学差异,发现SKOV3/TS-1细胞具有明显的伸展性,且细胞体积和形态较为均一;而SKOV3/TS-2细胞则悬浮于三维支架载体中,大多呈抱团生长,细胞间连接更为紧密,含有丰富的胞间连接、中间连接、桥粒等结缔组织[12],这可能也是导致细胞耐药的重要原因之一。而且考虑到二维培养的SKOV3/TS-2肿瘤细胞虽然增殖迅速,但短期内易退化死亡,而SKOV3/TS-1细胞不易过度生长,说明三维培养环境可以为肿瘤细胞提供更大的生长空间。
此外,本研究进一步观察SKOV3/TS-1细胞和SKOV3/TS-2细胞对其他化疗药物的交叉耐药性,结果显示,SKOV3/TS-1细胞和SKOV3/TS-2细胞对CTX、L-OHP、GCB、MIT均有一定的耐药性,且SKOV3/TS-2细胞的耐药性高于SKOV3/TS-1细胞。推测可能是由于三维培养系统得到的SKOV3/TS-2细胞的生长周期多停滞在G1期,导致细胞分裂增殖活跃度显著降低,早期凋亡率大大增加;同时肿瘤细胞也丧失了大量化疗药物作用靶点,使得细胞向耐药表型转化[13]。在本研究中,SKOV3/TS-1细胞和SKOV3/TS-2细胞TUBB3 mRNA和MDR1 mRNA表达量均高于SKOV3细胞。P-糖蛋白(Permeability glycoprotein,P-gp)是一类跨膜糖蛋白分子,因其可以利用ATP水解释放的能量促使众多化疗药物排出细胞外,因此是目前医学界普遍认可的多药耐药分子之一,被认为是MDR1基因编码的能量依赖型药泵[14]。而TUBB3是影响α、β微管蛋白动态平衡、微管二聚体重聚的重要分子[15]。在本研究中SKOV3-TS细胞TUBB3 mRNA表达量升高,说明微管蛋白的动力学活性最高,从而逆转了TAX抑制微管聚合的作用,导致细胞对TAX产生耐药性。
综上所述,三维培养系统构建的SKOV3/TS-2细胞模型与二维培养系统得到的SKOV3/TS-1细胞相比,形态结构和生物学特性都显示了较大差异,这可能是诱导SKOV3/TS-2细胞产生较强多药耐药的作用机制之一。此外,SKOV3/TS-1细胞和SKOV3/TS-2细胞中多药耐药相关基因TUBB3mRNA和MDR1mRNA表达量均显著上调,这可能与细胞产生交叉耐药有关,但其相关的作用机制尚需进一步研究。
