稳定敲降NF-YB基因HeLa细胞系的构建
2020-12-04姜晓燕丁库克
杜 璐,姜晓燕,丁库克
(中国疾病预防控制中心辐射防护与核安全医学所放射生态研究室,北京 100088)
目前宫颈癌依旧是威胁我国女性生命健康的主要公共卫生问题之一,是女性常见的恶性肿瘤,其对女性生命健康的危害仅次于乳腺癌[1-2]。放射治疗是临床上治疗宫颈癌的重要手段之一,但在治疗过程中存在辐射不敏感,所以在放疗中辐射敏感性的研究成了热点问题。近年来研究者们试图寻找辐射敏感性基因作为宫颈癌治疗的靶点,以提高放疗效果[3]。人类肿瘤的发生与特定细胞周期蛋白水平的改变有一定的相关性[4],本课题组前期工作发现IER5 为宫颈癌放疗敏感基因,与细胞周期密切相关。该基因的过表达具有抑癌基因的功能,能抑制宫颈癌和肝癌细胞增殖。在辐射刺激下IER5表达量升高,并与CDC25B表达存在负相关关系,通过对CDC25B 基因启动子报告基因载体的构建及转录活性分析发现核转录因子Yβ 亚基(nuclear transcription factor Y subunit beta,NF-YB)是CDC25B的转录调控因子[5-7]。
NF-YB 是核转录因子Y(nuclear transcription factor Y,NF-Y)的一个亚基,基因定位于染色体12q22-q23。NF-Y是一种三聚体的CCAAT结合因子,能够识别并结合CCAAT 序列,刺激基因的转录,并且CCAAT 序列在G2/M 期调控基因的启动子中大量存在[8-9]。通过控制细胞周期进展中所需基因的表达[10-11]和各种基因的转录起始,参与细胞增殖的调节[12],特别是在G2/M期基因的转录调控中具有基本功能。基因芯片和逆转录聚合酶链反应数据表明,NF-YB敲除不仅使G2/M 期基因的表达受到抑制,并且在没有DNA损伤的情况下,能激活p53 及其促凋亡的靶基因[13]。当NF-YB 基因沉默时对细胞G2/M 期产生严重影响,但基本不干扰细胞S 期的进展[11,14]。Nakamura 等[15]在研究急性髓细胞白血病的发生发展时发现,经过TMPP(一种抗白血病药物)处理后通过介导NF-YB 和p300的释放,引起细胞周期G2/M期阻滞并且抑制白血病细胞增殖。Iyer 等[16]发现NF-YB 在脊椎动物精原干细胞中可促进细胞的自我更新和增殖,凋亡生殖细胞增加。Fang等[17]在结直肠癌实验中证明NF-YB敲降后会减弱细胞的耐药性。目前NF-YB基因在宫颈癌发生发展中的作用还未见相关的研究,为了探究NF-YB基因在宫颈癌中的作用,我们选取宫颈癌细胞系HeLa作为模式细胞,针对HeLa 细胞中的NF-YB 基因,设计shRNA 引物序列,利用RNA 干扰技术构建稳定的NF-YB 基因敲降HeLa 细胞系,为进一步研究该基因在宫颈癌中相关的机制及功能提供实验材料。
1 材料与方法
1.1 材料
人宫颈癌HeLa 细胞及人胚胎肾293T 细胞由本实验室保存;DMEM 培养基购于美国Gibco 公司;胰酶,胎牛血清,青链霉素混合液双抗购于BI 公司;DNA 内切酶(BamHⅠ、EcoRⅠ),DNA 连接酶,DNA marker 购于MBI Fermentas 公司;转染试剂RNAi-Mate,载体H1/GFP-Puro、包装质粒pGag/Pol、pRev、pVSV-G 购于苏州吉玛基因有限公司;鼠源anti-βactin 抗体购于Proteintech Group 公司;鼠源anti-NFYB 抗体购于美国Santa Cruz 公司;逆转录试剂盒MonScriptTMRTⅢAll-in-One Mix with dsDNase 购于莫纳生物科技有限公司;2×RealStar Green Power Mixture with ROXⅡ试剂盒购于北京康润诚业生物科技有限公司。
1.2 方法
1.2.1 细胞培养293T、HeLa 细胞均用含10%胎牛血清和1%青霉素和链霉素的DMEM培养基,在CO2体积分数为5%、37 ℃的培养箱中培养。每天观察其生长状态,当汇合度达90%时进行传代。
1.2.2 构建质粒利用Sigma 公司网站(http://www.sigmaaldrich.com/)查询目的基因的shRNA 引物序列,选择基因敲低效率较高的序列插入酶切位点,在序列前后加入几个保护碱基提高酶切活性,Loop结构选用TTCAAGAGA 以避免形成终止信号。shRNA 引物送苏州吉玛基因有限公司合成。将寡聚核苷酸链退火合成相应的双链DNA,经与BamHⅠ与EcoRⅠ双酶切线性化的慢病毒载体连接,转化感受态,经氨苄抗性筛选,提取H1/GFP-Puro-shRNA-NF-YB 质粒(按照质粒提取试剂盒步骤操作)送苏州吉玛基因有限公司测序。阳性重组质粒分别命名H1/GFP-Puro-shRNA-NF-YBsh1、H1/GFP-Puro-shRNA-NF-YB-sh2、H1/GFPPuro-shRNA-NF-YB-sh3,空白对照质粒命名为H1/GFP-Puro-shRNA-NF-YB-control(下文中分别简称SH1、SH2、SH3、CON)。靶序列及引物序列见表1。

表1 靶序列及引物序列
1.2.3 细胞转染及病毒收集将293T 细胞培养12 h左右,汇合度达到60%时进行转染。取无菌EP管,加入无血清DMEM、按比例加入H1/GFP-Puro-shRNANF-YB 穿梭质粒和包装质粒(pGag/Pol、pRev、pVSVG)混匀。取另一支无菌EP管,加入适量无血清DMEM和1/5 的RNAi-Mate 混匀,室温放置5 min 后将两个EP 管中的混合液混合并吹打均匀,室温放置20~25 min。将混合液逐滴加入培养皿中,6 h后换新鲜培养基继续常规培养72 h。收集培养基中的培养液离心、过滤。-80 ℃保存备用。
1.2.4 细胞感染及筛选对状态良好的HeLa 细胞进行感染,加入适量浓度病毒液的同时加入5 μg/mL 聚凝胺溶液,以提高感染效率。6~8 h 时观察细胞状态,24 h后换成新鲜培养基,正常培养48 h后加入浓度为2 μg/mL 嘌呤霉素的培养基进行细胞筛选,观察细胞状态及细胞死亡数量,然后按梯度增加嘌呤霉素的浓度至实验组细胞无明显死亡且空白对照组细胞全部死亡,最后加入浓度为10 μg/mL 嘌呤霉素的培养基持续培养1周后即筛选出shRNA-NF-YB-HeLa稳定细胞系。
1.2.5 RNA 提取和实时荧光定量PCR 检测收集细胞,加入500 μL 的Trizol,在冰上静置待其充分裂解,加入1/5 体积的三氯甲烷振荡混匀离心,吸上层水相至RNase free的EP管中加入等量的异丙醇混匀离心,弃上清收集RNA沉淀,用70%的乙醇清洗后加入适量DEPC 水溶解,最后用酶标仪紫外分光光度法定量RNA。取等量RNA 用MonScriptTMRT Ⅲ All-in-One Mix with dsDNase 试剂盒将RNA 逆转录为cDNA。实时荧光定量PCR 使用2×RealStar Green Power Mixture with ROXⅡ试剂盒。实时荧光定量PCR使用的基因引物序列见表2。
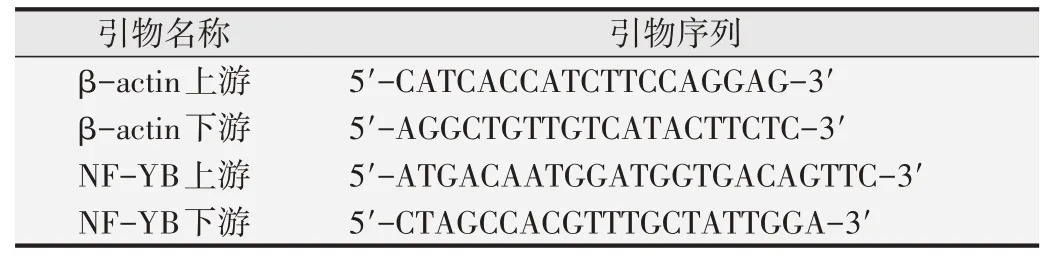
表2 实时荧光定量PCR使用的基因引物序列
1.2.6 Western blot将筛选后的HeLa 细胞加入1×SDS上样缓冲液,混匀后99.9 ℃金属浴15 min,使之变性。收集的蛋白样品使用10%的SDS-PAGE 电泳分离,每孔上样10 μL,分离条件为80 及120 V。硝酸纤维素膜250 mA 恒流转膜,使用封闭缓冲液封闭转印膜1 h,TBST 洗膜后按照marker 指示切下目的条带。加入NF-YB一抗、β-anctin一抗4 ℃摇床孵育过夜。TBST 清洗后加入山羊抗小鼠二抗室温摇床孵育1 h。清洗后加ECL 显影液进行化学发光检测,暗室压片,显影,洗片,扫描片子后用ImageJ进行灰度值分析。
1.3 统计学分析
各组数据值用xˉ±s 表示,所有的数据处理用GraphPad Prism 软件,组间数据进行多重t 检验。以α=0.05为检测水准。
2 结 果
2.1 H1-GFP/puro-shRNA-NF-YB质粒的构建
将提取所得质粒进行测序。结果如图1。测序结果表明插入的目的片段与设计目的靶基因序列完全一致,未发现有突变、插入异常等异常情况存在。表明已成功构建H1-GFP/puro-shRNA-NF-YB质粒。
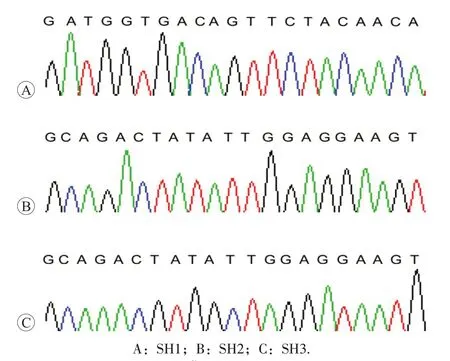
图1 靶序列测序结果
2.2 感染效率的检测
将感染后的细胞正常培养72 h,在荧光显微镜下观察细胞中绿色荧光蛋白的表达。观察结果见图2。结果表明,90%以上的细胞中均有绿色荧光的表达,提示细胞被高效率转染。
2.3 敲低效率的实时荧光定量PCR检测结果
收集筛选后的细胞提取RNA,将RNA 反转录为cDNA后采用实时荧光定量PCR检测NF-YB mRNA的表达。用荧光PCR 仪QuantStudio 3(Thermo Scientific)获得每个样品中的内参β-actin和目的基因NF-YB的CT值,计算2-ΔΔCT值为基因的相对表达量。结果显示SH1和SH3转染组相比空白对照组在mRNA 水平表达量明显减少(P<0.01),提示SH1和SH3的稳定敲降细胞株构建成功(图3)。
2.4 敲低效率的Western blot检测结果
取筛选后的细胞加入1×SDS上样缓冲液金属浴变性后,通过Western blot 在蛋白水平对NF-YB 的表达进行检测,条带用ImageJ 计算其灰度值。结果显示SH1 和SH3 转染组相比空白对照组在蛋白水平表达明显减少(P<0.01),提示SH1 和SH3 显著降低了NF-YB的表达(图4)。
3 讨 论
RNA 干扰技术被Jorgensen R 发现报道,他在牵牛花中导入色素合成基因后,不仅想要的色素没有合成,插入的基因也没有表达,这种现象被称为共抑制[18]。直到Fire 等[19]研究结果表明在导入了双链RNA后会导致目的基因的特异性沉默,才将其命名为RNA干扰。2002年RNA干扰技术被Science和Nature评为重大科技成果之一,它具有高效性、高特异性等特点[20]。短发夹RNA(shRNA),包含一个Loop 结构,可加工成siRNA,也可通过与目标mRNA 互补结合序列特异性地实现靶mRNA 降解。使用细菌或病毒载体,被导入靶细胞的细胞核内,在某些情况下,载体可以稳定地整合到基因组中。
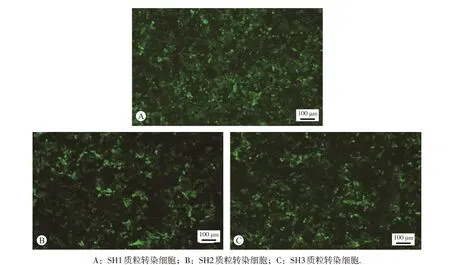
图2 荧光显微镜下观察绿色荧光蛋白的表达
图3 qPCR检测结果
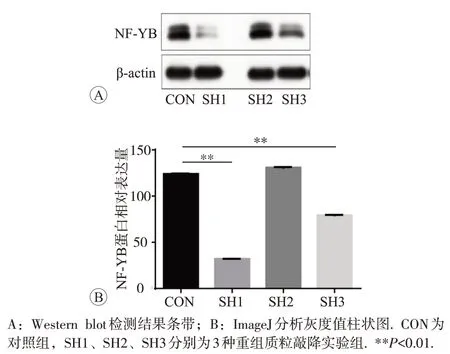
图4 Western blot检测结果
宫颈癌是一种最常见的妇科恶性肿瘤,在我国其发病率与病死率已经上升至女性生殖道恶性肿瘤首位,严重威胁着女性的生命健康[21-22]。现已证明宫颈癌的发生是体内外等多方面因素共同作用的结果。体细胞中基因结构及拷贝数量的改变均能够引起基因功能的变化,导致细胞正常增殖凋亡过程紊乱,甚至发生癌变。经过课题组前期研究证实IER5为宫颈癌的辐射敏感性基因,在辐射刺激时IER5与CDC25B呈负相关关系,经过基因启动子报告表明NF-YB 为CDC25B的调控因子[5-7]。研究者们在多个试验中发现NF-YB影响着细胞周期的发展[11,14-17],并且在没有DNA 损伤的情况下,NF-YB 的沉默能激活p53 及其促凋亡的靶基因[13]。
本研究设计出特异性敲降NF-YB 的有效序列后,利用分子克隆技术构建了H1-GFP/puro-shRNA-NFYB质粒,经过测序证实插入序列与设计序列一致,表明成功构建了H1-GFP/puro-shRNA-NF-YB 质粒。并成功转染至细胞中,观察细胞中GFP的表达表明转染效率高达90%。收集筛选后的细胞应用Western blot和实时荧光定量PCR分别在蛋白质水平和RNA水平证明构建的3 个质粒中有2 个都不同程度的抑制了NFYB 的表达,敲降效率达60%以上,以上实验结果表明,本研究成功构建了稳定干扰NF-YB 的HeLa 细胞系并且效果差异显著。为后续研究NF-YB 对HeLa 细胞周期及其他功能的影响奠定了良好的基础。
