玉米抗玉米蚜种质的鉴定与抗性位点的定位分析
2020-12-04李兴华王江浩张动敏张全国王立伟魏剑锋李荣改
宋 炜 李兴华 王江浩 张动敏 张全国 王立伟 魏剑锋 李荣改
(河北省农林科学院粮油作物研究所/河北省作物遗传育种实验室, 河北 石家庄 050035)
玉米(ZeamaysL.,2n=20)是世界上主要的粮食作物之一。我国是世界第二大玉米生产大国,产量占世界总产量的20%,因此玉米生产在保障我国粮食安全和国民经济发展方面发挥着重要作用[1];而且随着全球气候变暖,玉米作为一种适应性广、抗逆性强的粮食作物越来越受到重视[2]。玉米蚜(RhopalosiphummaidisFitch)对玉米生产的危害是一个全球性问题[3]。玉米蚜直接从植株体内吸食汁液对玉米造成危害,并且还作为病毒的载体传播,如玉米矮花叶病毒等多种病毒,引起病害,严重危害玉米生产[4]。近年来,随着我国玉米生产由单一的籽粒生产向鲜食、粮饲兼用或青贮专用生产的方向发展,受种植密度增加及夏季天气干旱少雨等因素的影响,玉米蚜的发生更趋严重,严重年份可造成玉米减产50%[2]。而且玉米蚜有着极高的繁殖率,单头蚜虫可在6个星期内生产5.9万个后代[5],并能产生有翅迁移蚜,给化学防治带来困难。因此,选育抗蚜虫品种是防治虫害和保护生态环境最有效的方法;筛选抗蚜玉米新种质、对其抗蚜性进行遗传分析、定位和克隆抗性基因,对开展玉米抗蚜育种具有重要的理论和现实意义。
国外从上世纪20年代就已经开始了玉米对蚜虫的抗性研究,Gernert[6]在1917年首次报道了利用一年生蜀黍(Euchlaenamexicana)与黄色马齿型玉米杂交,其杂种F1从玉米的野生近缘种中获得了对玉米蚜的抗性。我国开展玉米抗蚜研究起步晚,多集中于生产上不同玉米品种(系)的抗蚜鉴定,很少涉及对种质资源进行系统性的抗性鉴定和遗传研究[7-8]。国内外研究显示,虽然鉴定出少数抗性种质资源,但在玉米中未发现对玉米蚜免疫的材料,且对少数抗性资源进行了遗传研究[9-13]。对来自热带甜玉米自交系AA8sh2的抗蚜性遗传研究发现,其抗性是隐性的,连锁分析发现了2个抗性位点aph和aph2,分别被定位在第10和第2染色体[10, 14-16]。而对温带玉米抗蚜性遗传研究发现抗性受多个基因控制,加性效应大于非加性效应[11, 17-19]。近年来,随着玉米基因组序列的获得和全基因组关联分析的应用,分别在玉米第1、第4、第5、第6、第7和第10染色体上发现了对玉米蚜的抗性位点,能够解释15%~27%的抗性表型变异[4, 11, 20]。以上研究结果表明,玉米对玉米蚜的抗性遗传机制比较复杂,抗性遗传一般受多基因与环境共同控制。为了挖掘玉米抗蚜基因和改良品种的抗性,本研究在筛选玉米抗蚜种质的基础上,对玉米抗蚜性状进行遗传分析,并采用分离群体分组分析法(bulk segregation analysis,BSA)与特异位点扩增片段测序(specific-locus amplified fragment sequencing,SLAF-seq)相结合的方法对抗性位点进行定位分析,以期为抗蚜基因的克隆和分子标记辅助育种奠定基础。
1 材料与方法
1.1 供试材料与田间试验设计
试验在河北省石家庄市藁城区河北省农林科学院粮油作物研究所堤上试验站进行。国内外收集的98份玉米种质资源(表1)分别于2014年和2015年的5月20日、6月15日分两期播种,进行两年共4个处理(环境)的田间抗蚜性鉴定。每份材料单行区种植,行长5 m,行距0.6 m,每穴双粒点播,每行播种18穴,出苗后每穴定苗留1株。生长期间肥水管理同一般大田。
1.2 试验材料的抗蚜鉴定
每小区定点5株,分别在玉米生长发育的苗期、小喇叭口期、大喇叭口期、抽雄期,田间调查蚜虫数量2次,2次间隔3 d,从授粉期至收获,每间隔5 d调查1次;抽雄期以前每株调查心叶、展开叶叶片和叶鞘上的玉米蚜数量,抽雄期后调查叶片、叶鞘、雄穗、雌穗上的玉米蚜数量。计数精度视虫口密度而定,当每株虫量在50头以下逐头实数,50头以上时,分别以10头或20头为单位目测估计。参考董怀玉等[21]抗蚜性等级确定方法和蚜情指数进行抗蚜性鉴定和评价。
蚜情指数=某份玉米材料的平均蚜量/全部观测玉米材料的平均蚜量。即根据每份玉米材料上的蚜情指数,将其抗蚜性划分为免疫(immune,IMMU)、高抗(high resistance,HR)、抗(resistance,R)、感(sense,S)、中感(medium sense,MS)、高感(high sense,HS)6级,其蚜情指数分别为0、0~0.25、0.26~0.50、0.51~0.75、0.76~1.25和大于1.25。
1.3 F2群体的抗蚜鉴定
2015年夏天,以高抗蚜虫玉米自交系32t33为父本,高感蚜虫玉米自交系335HX为母本配制杂交组合,秋天收获的F1种子在2015年冬季种植于海南省三亚市河北省农林科学院粮油作物研究所试验站,自交获得F2种子。2016年6月15日将收获的762粒F2遗传分离群体与双亲及F1一起, 采取单粒播种的方法种植于堤上试验站玉米试验田进行抗蚜性鉴定。
在田间F2群体种植圃, 对762个单株授粉后,采用田间蚜虫自然繁殖和人工接虫相结合的方法进行抗蚜性鉴定。在授粉后第10天开始根据上述蚜虫调查方法进行第一次调查后,在每株果穗以下第一片叶的叶腋处接虫约10~20头,接虫后7 d进行第二次蚜虫数量调查,继而进行第2次接虫,再过7 d进行第三次蚜虫数量调查,收获前进行最后一次调查。根据4次的结果计算F2群体各单株的蚜情指数。
1.4 DNA提取和混池的构建
在苗期采集335HX×32t33杂交组合的双亲、F1和F2群体单株的新鲜嫩叶,采用改良的 CTAB法提取DNA[22],用1%琼脂糖凝胶,电压120 V,电泳50 min检测DNA质量,并利用NannoDrop 2000分光光度计(Thermo Scientific,美国)测定DNA浓度。DNA样品的OD260/280值在 1.8~2.0之间,浓度≥50 ng·μL-1, 总量≥2 μg,无降解的DNA用于混池的构建。
根据F2群体762个单株抗蚜鉴定结果,分别选取高抗蚜、高感蚜单株各40株的DNA等量混合,分别构建最终浓度为30 ng·μL-1的抗、感混池,与双亲的DNA样品一起用于特异位点扩增片段测序(SLAF-seq)。
1.5 SLAF文库构建及高通量测序
以玉米基因组(ftp://ftp.ensemblgenomes.org/pub/plants/release-24/fasta/zea_mays/)为参考基因组进行电子酶切预测后,选用HaeⅢ和Hpy166III双酶对双亲以及2个混池的基因组DNA样品进行酶切,酶切片段长度在414~464 bp的序列定义为SLAF 标签,回收得到的酶切片段进行3′端加A处理、连接Dual-index测序接头[23]、PCR 扩增、纯化、混样、切胶选取目的片段,文库质检合格后,利用IlluminaHiSeqTM2500高通量测序平台进行测序。
1.6 SLAF标签的开发和SNP检测
对SLAF-seq测序获得的序列进行比对并根据序列相似度进行聚类,获得在不同样品间序列有差异的多态性SLAF 标签(这种序列多态性主要包括SNP 和Indel标记),利用BWA软件[24]将SLAF 标签与玉米参考基因组比对,确定在基因组的位置。使用GATK 软件工具包的局部重比对(local realignment)对SLAF标签中的SNP进行变异检测,从而获得多态性SNP标记。
1.7 BSA关联分析
采用ED(euclidean distance)算法[25]计算与目的基因连锁的区域。利用两混池间差异SNP的频率的差异,计算两混池间SNP的ED值,ED值越大表明该SNP在两混池间的差异越大。根据连锁的原理,真实的关联区域附近的SNP位点会倾向于在两混池间表现出差异,因此目标区域内的ED值越大。根据ED值作图,在目标性状关联区域的附近会出现较明显的峰。为消除背景噪音,对每个位点原始ED值进行2次方处理,然后对每个位点进行SNPNUM拟合,取所有位点拟合值的中位数与3倍的标准差之和(median+3SD)作为分析的关联阈值,根据关联阈值确定最终关联区域。公式如下:

表1 参试玉米种质资源来源及抗蚜性表现Table 1 The origin of maize germplasm resources and their aphid-resistance evaluation

表1(续)
式中,Amut表示在SNP位点上A碱基在隐性(抗蚜)混池中的深度;Awt表示A碱基在显性(感蚜)混池中的深度。依次类推。
2 结果与分析
2.1 玉米不同发育时期玉米蚜种群的数量动态
由图1可知,玉米蚜种群数量在抽雄期前极少,之后随着大量有翅蚜的迁入并大量繁殖,使得成熟期单株蚜虫量平均达到1 200头以上,表明玉米蚜的发生盛期出现在玉米抽雄期至成熟期。因此,应在玉米抽雄后对其进行抗蚜性鉴定和筛选。

图1 蚜虫种群在玉米不同发育时期的数量动态Fig.1 Dynamics of aphid population at different maize developmental stages
2.2 不同玉米种质对玉米蚜抗性水平的影响
根据蚜情指数对98份参试玉米种质资源进行抗蚜性鉴定和评价。比较每份参试玉米种质资源在2个不同播期玉米蚜的种群数量发现,5月中旬播种(春播)的所有玉米种质资源材料在整个发育时期玉米蚜数量均明显低于6月播种(夏播)的玉米蚜数量(数据未列出)。每份材料单株的玉米蚜虫数量和蚜情指数分析结果显示,没有对玉米蚜表现免疫的种质资源; 5份表现为高抗,分别是IRF312、B123、B112、32t33和DM3/335F;包括335HX在内的17份表现高感(表1、表2)。从参试种质资源的总体表现看,88.78%的玉米种质资源表现感玉米蚜,表明现有的玉米种质资源中缺乏玉米蚜的抗源,尤其缺少对蚜虫侵染表现免疫的材料。
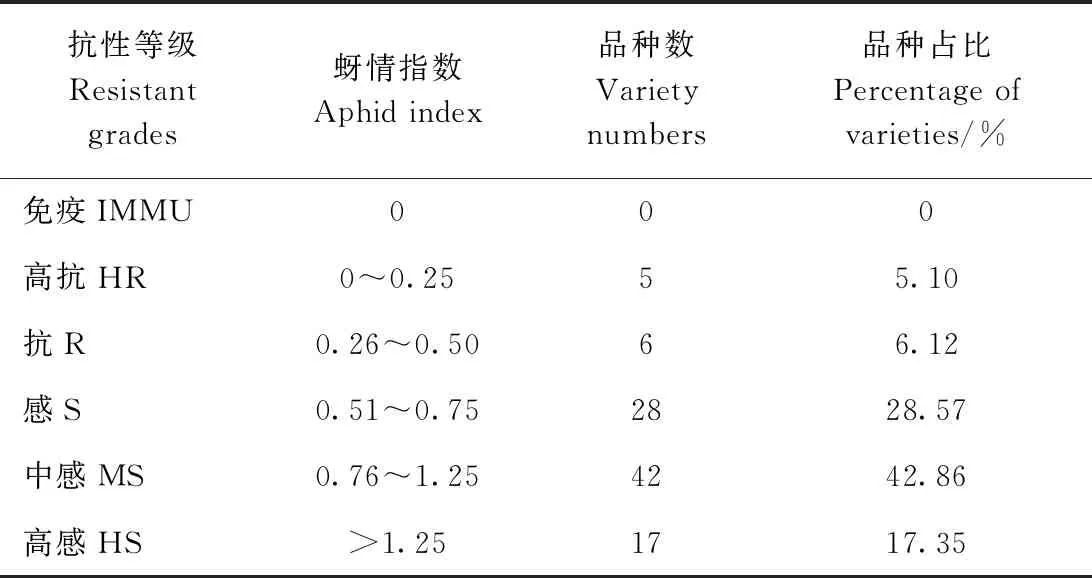
表2 98份玉米种质资源的抗蚜性鉴定结果Table 2 Aphid-resistance evaluation of ninety-eight maize germplasm resources
2.3 32t33自交系的抗蚜性遗传
为了明确筛选出的高抗玉米蚜32t33自交系的抗蚜遗传特性,利用其与高感蚜自交系335HX配制杂交组合,对组合的双亲及其杂交后代F1、F2群体单株的蚜虫群口数量和抗蚜等级进行统计分析(图2、图3)。结果显示,杂交种F1和感蚜亲本的蚜情指数分别为0.908、0.904,在感蚜表现上一致,F2群体表现抗、感蚜分离且呈正态分布,表明32t33自交系的抗蚜性遗传为隐性且表现数量性状特征。

图2 供试材料的蚜情指数Fig.2 Aphid index of plant materials

图3 F2群体抗蚜等级频数分布图Fig.3 Frequency distribution of aphid resistance in the F2 population
2.4 SLAF标签开发及其在玉米染色体上的分布
对利用玉米32t33与335HX杂交后代F2群体单株构建的抗、感蚜2个混池的DNA和双亲的DNA样品,经HaeⅢ+Hpy166III双酶切所产生的414~464 bp片段进行测序。利用BWA软件将测序结果与玉米参考基因组比对,发现4个样品的序列与参考基因组序列重叠率在98.84%以上,表明测序结果能真实反映双亲及2个混池基因组信息,共获得364 147个SLAF标签,抗蚜混池平均测序深度为70.45×,感蚜混池平均测序深度为65.68×,两混池平均测序深度为68.07×,总测序深度为136.13×(表3)。由表4可知,有357 778个SLAF标签定位到玉米染色体上,开发的标记有效率为98.25%。在每条染色体上的标记数量在23 870~52 668之间,开发的SLAF标签在不同染色体上均匀分布,覆盖了整个基因组(图4),可以用于进一步分子标记的开发。

表3 抗、感蚜混池开发的SLAF标记统计表Table 3 The statistics of developed SLAF markers for resistant and susceptible bulks
2.5 多态性SNP标记分析
根据定位到染色体上的多态性SLAF标签序列信息,利用GATK软件的序列局部重比对功能对SLAF标签中存在的序列变异的SNP进行检测,一共检测到11 052 576个SNP标记(表5)。滤掉可信度低的标记后,最终得到高质量的可信SNP 位点46 553 个。这些SNP在父本32t33、母本335HX、抗蚜混池、感蚜混池样本中的杂合度分别为28.81%、24.42%、81.62%和75.61%,两混池的杂合度高于双亲,杂合度的分布符合亲本及混池的特征,表明开发的SNP标记可用于进一步的关联分析。

表4 SLAF标记在每条染色体分布统计表Table 4 The distribution of SLAF markers on each chromosome

注:横坐标为染色体物理长度(Mb),每一个黄色条带代表一条染色体,色条代表SLAF密度;颜色的深浅表示SLAF 标记在这些区域的数量。Note: The x-axis indicates the physical position in megabases(Mb). Each yellow band represents a chromosome. The color bar shows the SLAF density. Dark and light colors denote the SLAF marker numbers at these loci.图4 SLAF标记在每条玉米染色体上的分布Fig.4 The distribution of SLAF markers on each maize chromosome
2.6 抗蚜性候选区域的筛选
利用获得的46 553 个可信多态性SNP位点,计算每个SNP位点的ED值,并对ED值进行拟合得到关联值分布(图5)。以所有位点拟合值的中位数与3倍标准差之和(0.12)为阈值进行关联分析,将抗蚜性关联到2个区段,分别位于第3、第5染色体上(图5)。位于第3染色体的区域在70 453 782~108 289 839 bp之间的19.66 Mb范围内,第5染色体的区域在177 885 175~184 229 926 bp之间6.34 Mb范围内(表6)。

表5 样品中检测到的SNP统计表Table 5 The statistics of detected SNPs in the used samples

图5 混池ED关联分析结果图Fig.5 The results from bulk ED association analysis
2.7 抗蚜候选基因的筛选
针对关联区域内的基因,分析其外显子区域在2个亲本之间差异的SNP信息,对SNP进行变异的注释,共发现存在非同义突变的SNP有85个,对应到43个基因上,这些基因可能是与抗蚜性状直接相关的功能基因。将存在非同义突变的基因分别与NR、Swiss-Prot、GO、KEGG、COG等数据库比对进行深度注释,并结合与模式植物拟南芥中同源基因的功能注释,进一步筛选与植物免疫、抗性有关的基因,缩小候选基因的范围。根据抗性基因编码的抗性蛋白具有的保守区域序列,在关联区域发现3个具有抗性蛋白结构域的基因,分别是Zm00001d041215、Zm00001d041298、Zm00001d016953(表7)。前2个基因位于第3染色体,编码具有LRR-RLK(leucine rich repeat receptor-like kinases)功能域的激酶,后1个基因位于第5染色体关联区域,编码典型的受体蛋白,其含有NB-ARC结构域(nucleotide-binding adaptor shared by APAF-1,certain R gene products and CED-4)。除3个抗性基因外,还发现2个位于第3染色体关联区域的基因Zm00001d041220和Zm00001d040936,其同源基因在拟南芥中具有防御病害、逆境的功能[26-27]。在关联区域内的5个与免疫、抗性相关的基因可作为抗蚜候选基因做进一步研究。
3 讨论
研究玉米蚜在玉米整个生育期的发生规律是蚜虫综合防治的基础,对玉米生产上选择适宜的防治时期具有指导意义。本研究结果表明,玉米蚜在不同玉米品种上发生高峰表现比较一致,均在玉米抽雄后的灌浆期,也是蚜虫对玉米危害最严重的时期(图1)。这与以往一些研究结果一致,玉米蚜繁殖高峰期也正是玉米产生和积累营养的最佳时期[8-9, 28]。玉米蚜的繁殖同时还受环境因素的影响,如光照、温度、湿度等,既可以直接影响玉米的抗性,又可以通过影响蚜虫繁殖间接影响玉米的抗性[7]。因此,在田间应选择在灌浆期对玉米品种进行抗蚜鉴定和评价,确保鉴定结果的准确性。

表6 关联区域信息统计表Table 6 The statistic of associated regions
玉米为异花授粉作物,遗传多样性丰富,对蚜虫的抗性也表现出很大的差异[29-30]。本研究在2年2个播期共4个不同环境下对近百份玉米种质资源的抗蚜性状进行鉴定,未发现对蚜虫免疫的材料,仅筛选出包括32t33在内的5份高抗蚜材料(表2)。这与其他国内外研究者认为已应用的玉米种质资源缺乏抗玉米蚜的玉米种质,抗蚜遗传基础狭窄的观点一致[8-9]。少数表现高抗蚜的玉米种质资源,如Minnesota 13、Oh43、Oh45、L317、Mo17、A632、Ky21、Mo18w等,也是非常重要的遗传育种基础材料[9, 12]。本研究鉴定筛选出的抗蚜性种质材料丰富了抗蚜遗传育种资源,特别是玉米自交系32t33不仅对玉米蚜表现高抗,还表现出很高的一般配合力,是一个非常优良的亲本,已利用其配出多个强优势杂交组合参加玉米区域试验。
SLAF-seq技术是利用高通量测序发展而来的一套简化基因组测序技术。与BSA分析相结合,在分子标记开发上具有通量高、准确性高的优势,近年来在水稻、小麦、大豆等作物中已得到广泛应用[31-33]。但是,在玉米中的应用比较晚。杜龙岗等[34]、吴向远[35]利用此方法分别对玉米果皮纤维素含量、玉米早衰性状进行了分析,获得了与两性状相关联的基因组区域,进一步证实了此方法用于基因定位的可行性。本研究采用此方法对来自玉米自交系32t33的抗蚜性进行分析,获得了11 052 576个SNP位点(表5),并将2个与抗蚜性关联的区域分别定位在第3、第5染色体上。尽管前人分别利用抗蚜的Mo17、Ky21与不同的感蚜品种构建的纯系(RIL、NILs)在第1、第4、第5、第6、第7、第10染色体上定位了一些与玉米抗蚜性相关的位点(QTLs)[11-12],但本研究定位的抗性位点与其位置不同,本研究发现的新位点丰富了玉米抗蚜遗传的基础,新开发的SNP标记可用于进一步基因精细定位和分子标记辅助育种。

表7 关联区段的候选基因Table 7 The identification of candidate genes in associated regions
本研究在2个与抗蚜性关联的染色体区域,筛选出5个与植物免疫、抗性有关的基因(表7)[36-37]。3个为编码核苷酸结合结构域(nucleotide bainding site,NBS)和富亮氨酸重复序列保守结构域(leucine-rich repeat conserved domain,LRR)的受体蛋白(nucleotide-binding adaptor shared by APAF-1,R proteins and CED-4,NB-ARC)或激酶(leucine rich repeat receptor-like kinases,LRR-RLK)基因,这2种基因在植物的防御系统中起着非常重要的作用[36-38]。虽然鲜见玉米抗性蛋白和激酶的基因对玉米蚜具有抗性的报道,但在番茄、甜瓜上分别克隆的Mi-1、Vat基因属于R基因具有抗蚜功能[39-41]。此外,还有多个与抗蚜相关的位点也已被定位在NBS-LRR簇序列区域内[42-44]。Song等[45]在玉米全基因组中鉴定出151个具有NBS-LRR结构的基因和226个含有LRR-RLK结构的基因,这对在抗蚜关联区域筛选候选基因具有指导意义。除3个R基因外,还鉴定出2个与在拟南芥上参与植物免疫、抗逆性有关基因的同源基因(表7)。但这些候选基因对蚜虫危害的应答反应有待进一步研究。
4 结论
通过对从国内外收集的玉米种质资源的抗玉米蚜鉴定,筛选出高抗的玉米自交系32t33,其抗蚜性由隐性基因控制且表现数量性状特征,采用SLAF测序技术与BSA分析相结合的方法开发出11 052 576个SNP标记,获得了2个与抗蚜性关联的区域,并确定了5个候选基因。本研究结果丰富了玉米的抗蚜基因资源,开发的分子标记可用于后续的基因精细定位,为最终分离出抗性基因,明确玉米的抗蚜的遗传机制和应用于玉米抗蚜品种选育奠定了基础。
