类Fenton法的Fe0/Na2S2O8体系对甲基橙降解研究
2020-12-03吴芳芳郭绍英黄辉煌
吴芳芳,郭绍英,黄辉煌,2
(1.武夷学院 生态与资源工程学院,福建省生态产业绿色技术重点实验室,福建 武夷山 354300;2.翔安市政集团环境工程有限公司,福建 厦门 361100)
据统计2018年我国染颜料产量103万t[1],在生产和使用过程中10%~20%染料释放到水体中[2]。染料含有大量的难降解有机物例如苯系、苯胺及联苯胺类化合物,一旦进入水体后对人体健康及生态环境将产生巨大的威胁[3,4]。研究高效、廉价的清洁技术成为治理染料废水重中之重。
近年来,Fenton高级氧化法在处理印染废水研究中被广泛利用[5-7],而以过硫酸盐为氧化剂的类Fenton高级氧化法降解污水中的有机物是近年来兴起的新技术,是最具有发展潜力的类Fenton法之一[7]。过硫酸钠的还原性高于H2O2,并且价格相对实惠[8]。在其他活化方法操作和成本的不可控下,用过渡金属离子的活化,过硫酸钠分解生成的·SO4-具有很强的还原性,氧化还原电势高达2.6 V,能够氧化绝大部分的有机物[9]。但是金属离子的反应速度过快,通常几分钟反应就完成了,为了减缓反应速度,可采用零价铁作为亚铁的来源活化过硫酸钠[10,11]。
本研究在Fenton理论的基础上用零价铁活化过硫酸钠考察降解过程的影响因素,探索最佳的反应条件,建立降解动力学方程,为实际处理印染废水提供理论参考依据。
1 实验部分
1.1 实验药品、仪器
过硫酸钠(PDS)、甲基橙(MO)、零价铁(Fe0)、甲醇(CH3OH)、硫酸(H2SO4)、氢氧化钠(NaOH),均为分析纯;
紫外可见分光光度计(V-5100),上海元析仪器有限公司;恒温水浴振荡锅(DK-S24),上海精宏实验设备有限公司。
1.2 实验方法
配置100 mg/L甲基橙(MO)溶液备用。移取250 mL MO溶液于锥形瓶中,调节pH,随后加入一定量过硫酸钠和零价铁,用锡纸封住瓶口后将锥形瓶迅速放入25 ℃的恒温水浴振荡器中振荡,调节振荡速度,在10、30、60、90、120、150(min)时分别取样20 mL于试管中,再迅速加入5 mL甲醇中止反应(4 mL溶液需要1 mL甲醇淬灭)。取混合液用分光光度计在波长464 nm条件下测量吸光度,并计算浓度。
2 结果与讨论
2.1 初始反应pH对MO降解的影响
在温度为25 ℃,Fe0投加量为0.16 g/L,PDS投加量0.912 mmol/L的条件下,考察不同初始pH为4.0、6.0、8.0、10.0时,体系对初始浓度为100 mg/LMO溶液的降解情况,结果见图1。
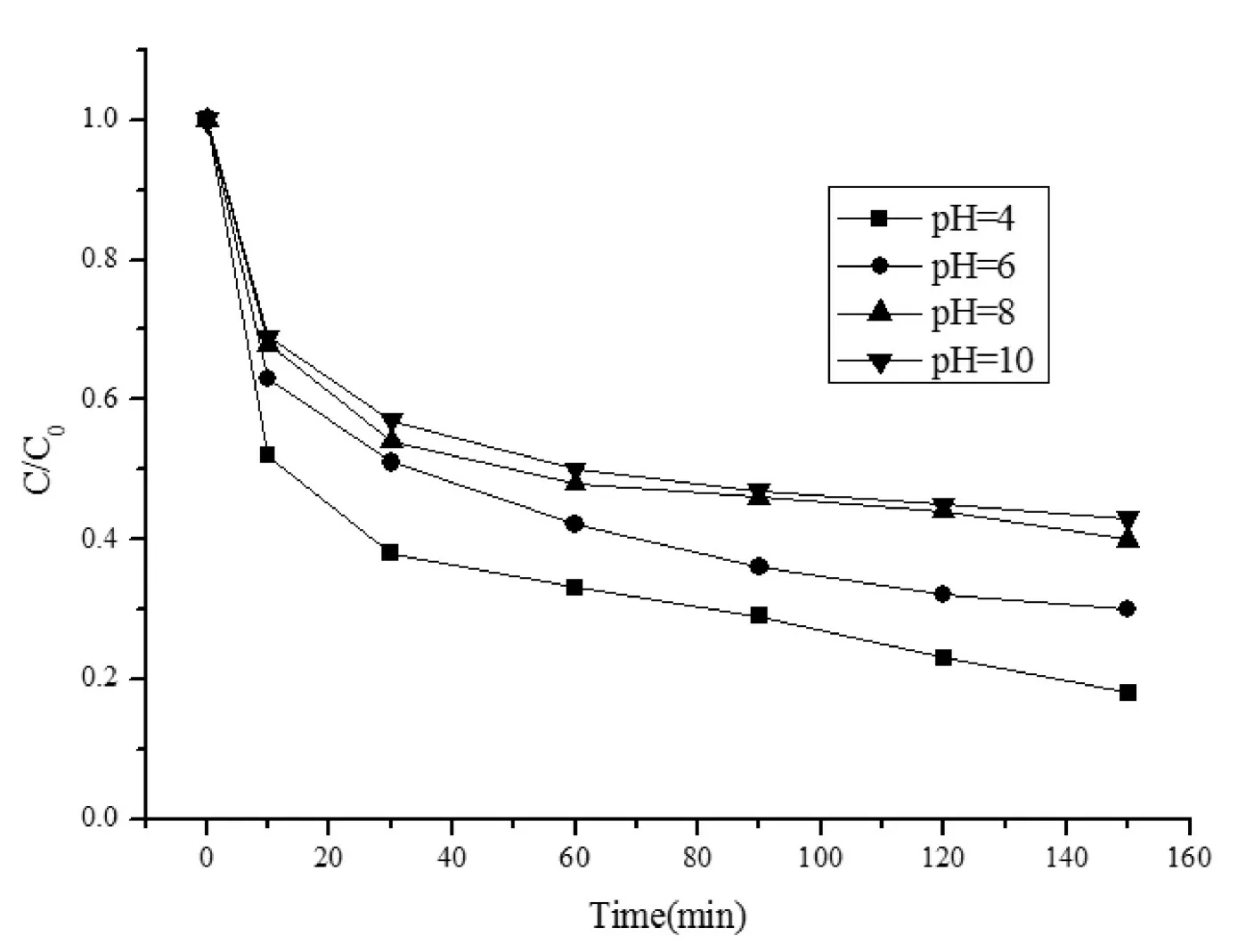
图1 不同初始pH条件下MO的降解率Fig.1 Effects of initial pH on degradation rate of MO
由图1可知,随着初始反应pH的升高,体系对MO溶液的降解率逐渐降低。酸性条件下,有利于·SO4-快速增加。但过量·SO4-的生成又会导致它们互相反应湮灭,影响降解效果[12,13]。而碱性条件下,溶液中生成的Fe2+和·SO4-都会与OH-反应,后者生成氧化能力弱的·OH,而且Fe3+形成络合反应生成沉淀,从而影响该体系对MO的降解。
有研究表明Fe0活化PDS降解有机物的过程符合一级动力学[13,14],即有
In(c1/c0)=-kt
(1)
其中k为表观动力学常数,c0为体系中初始MO浓度。k值主要受工艺参数的影响[15],常用下式表示。
k=f(T,pH,[c0],[PDS],[Fe0])=Aexp(-Ea/RT)[c0]a[PDS]b[Fe0]c
(2)
式中,A为指前因子[L·(mol·min)-1];Ea为反应活化能(J·mol-1);R 为普适常数[R=8.314 J·(mol·K)-1];a,b,c 分别为c0, PDS,Fe0的反应分级数。将图1中的实验结果进行一级动力学模型拟合,其相关数据见表1。

表1 不同初始反应pH下的表观速率常数Table 1 Kinetic parameters of degradation of MO at different initial pH
由表1可知,R2均大于0.9,说明该反应遵循一级动力学反应规律。同时偏酸性条件下有利于过硫酸盐体系对MO溶液的降解,且在初始pH=4时达到最大降解率为81.5%,表观降解速率常数为0.0067 min-1。
2.2 PDS投加量对MO降解的影响
在温度为25 ℃,Fe0投加量为0.16 g/L,初始反应体系初始pH为4时,考察改变PDS的投加量对初始浓度为100 mg/LMO溶液的降解情况,结果见图2,动力学拟合后表观速率常数k见表2。

表2 PDS投加量对表观速率常数的影响Table 2 Kinetic parameters of degradation of MO at different dosage of PDS
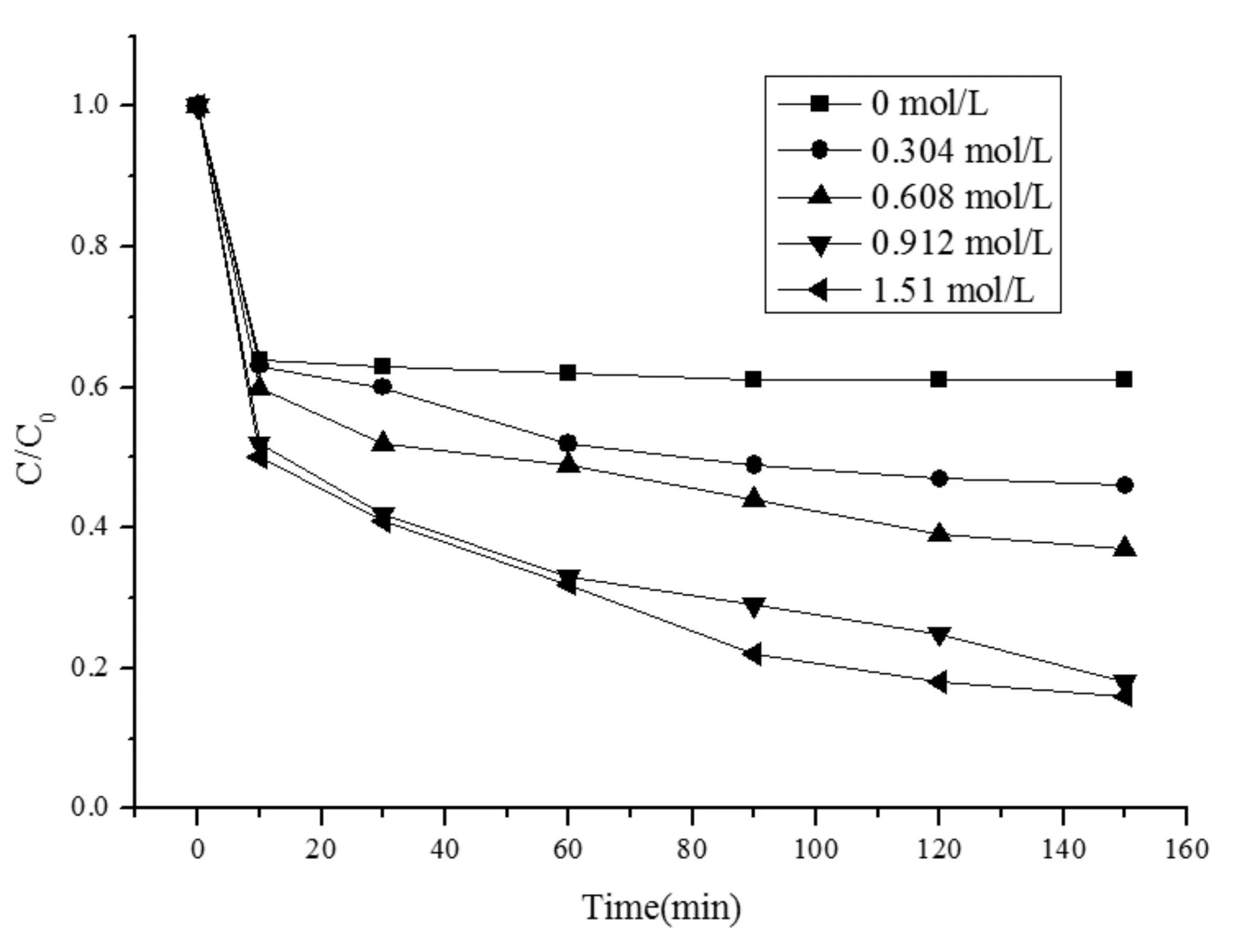
图2 PDS投加量对MO降解率的影响Fig.2 Effects of PDS dosage on the degradationrate of MO
由图2可知,当体系中只有Fe0存在时,MO溶液的降解率在前10 min就达到36%。在Fenton高级氧化理论中[17,18],零价铁能与水反应生成氢氧离子,氢氧离子具有还原性,能够生成例如FeOH2+、Fe(OH)4+、Fe(OH)4-这些化合物都具有还原性,能够降解部分的MO。随着PDS投加量的增加,降解率增大,表观速率常数k从0.0032 min-1增大到0.0074 min-1。在0~10 min之间甲基橙的快速降解,随后甲基橙降解速率变得缓慢。当PDS投加量过多时,·SO4-会互相反应湮灭,且Fe0的投加量有限,无法还原更多的PDS,所以PDS的投加量从0.912 mmol/L增加到1.51 mmol/L时,150 min后的降解率近似相等。这与Yang S[19]等人的有研究结论相符。
由公式(2)可知,k与不同PDS浓度之间符合下式:
k=kP[PDS]b
(3)
kp为常数,根据表2的数据,对PDS与k质之间进行拟合,可得kp=3.57,b=0.0876。
2.3 Fe0投加量对MO降解的影响
在温度为25 ℃,PDS投加量0.912mmol/L,初始反应体系初始pH为4时,考察改变Fe0的投加量对初始浓度为100mg/LMO溶液的降解情况,降解结果及动力学拟合情况见图3和表3。

表3 Fe0投加量对表观速率常数的影响Table 3 Kinetic parameters of degradation of MO at different dosage of Zero-valent iron
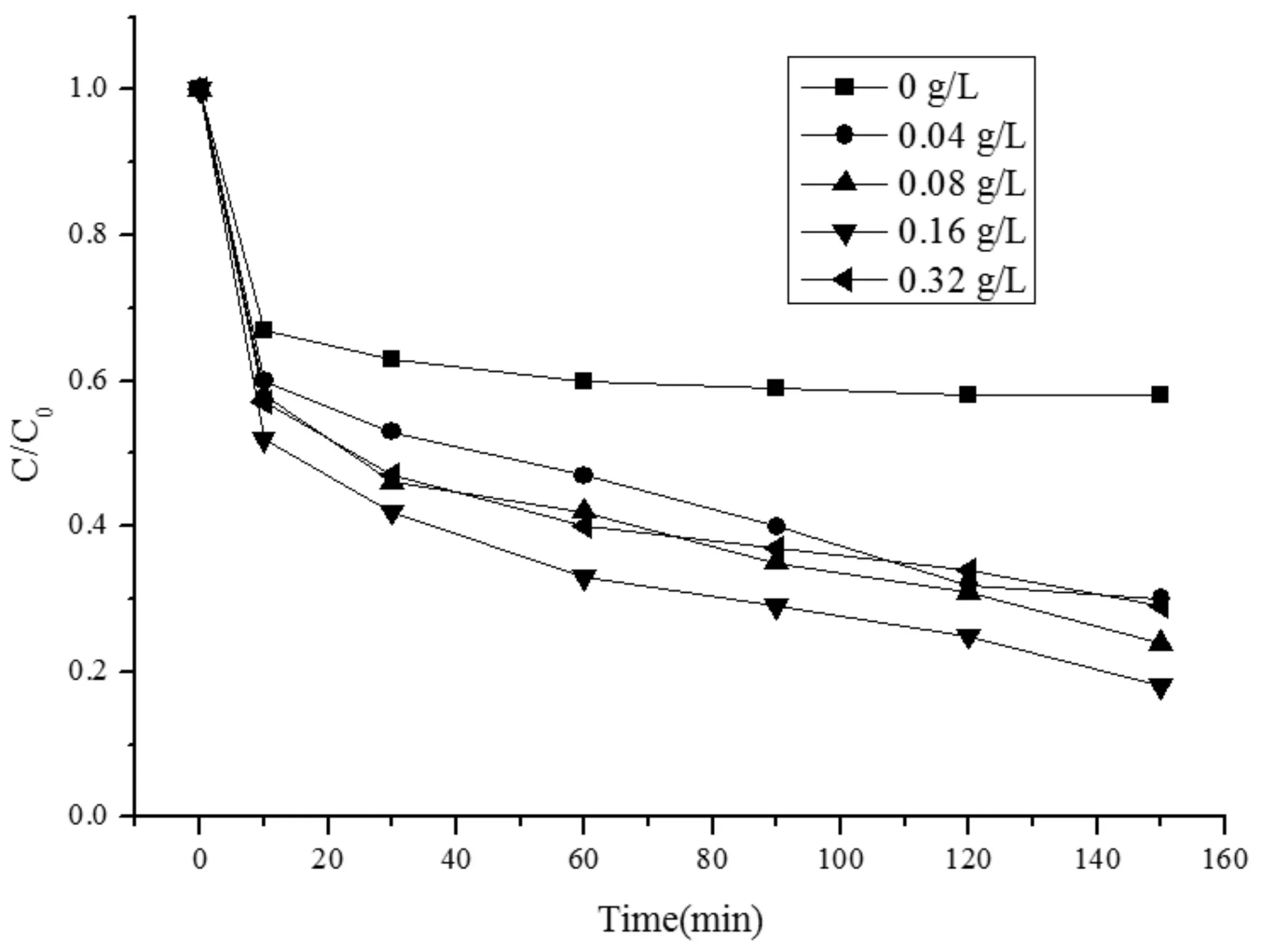
图3 Fe0投加量对MO降解率的影响Fig.3 Effects of Zero-valent irondosage on the degradation rate of MO
由图3可知,当Fe0投加量为零的时,过硫酸盐本身就具有强氧化性,能够氧化有机物,150min后MO降解率可达41.9 %。但常温常压下过硫酸盐的性质稳定,无法生成·SO4-,降解效率一般。随着Fe0投加量增加,MO降解率增加到81.5%,说明Fe0有利于硫酸盐体系对MO的降解。
由表3可知k值先增大后减小,且在0.16g/L时k值为0.067min-1。这是因为Fe0投加量增加到一定程度,产生过量Fe2+,过量的Fe2+会与部分·SO4-反应,使·SO4-的反应量变少,从而降低反应速率。
由公式(2)可知,k与Fe0之间符合下式:
k=kde0〗c
(4)
根据表3的数据,对Fe0与k之间进行拟合,可得kd=5.35,c=0.712。
2.4 反应温度对MO降解的影响
为探究温度对零价铁活化过硫酸钠降解MO溶液的影响,在不改变反应其他初始条件的情况下,调节反应温度分别为15、25、35、45、55 ℃时,反应体系对MO的降解情况及动力学拟合结果见图4和表4。
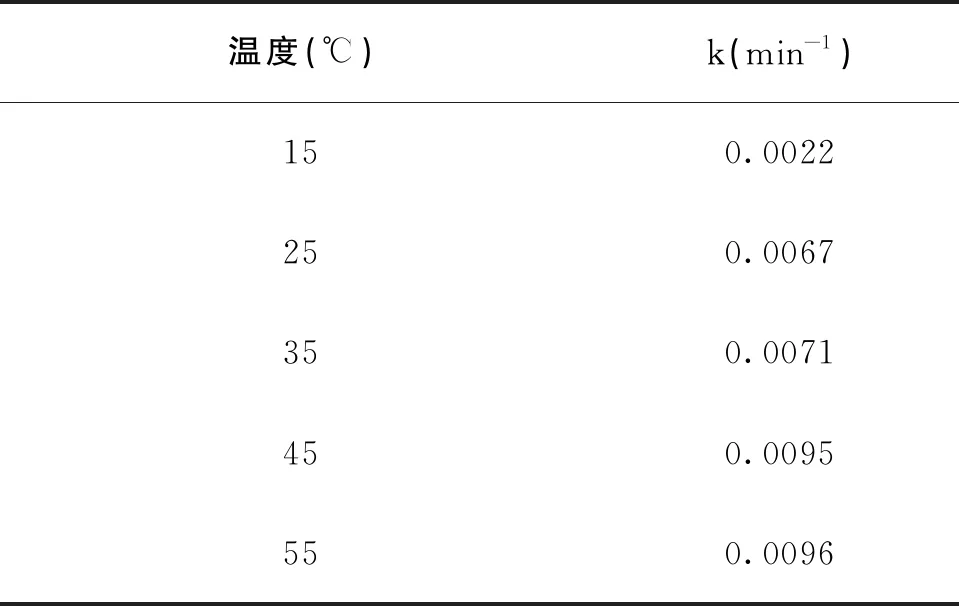
表4 不同温度下的表观速率常数kTable 4 Kinetic parameter of degradation of MO at different temperature
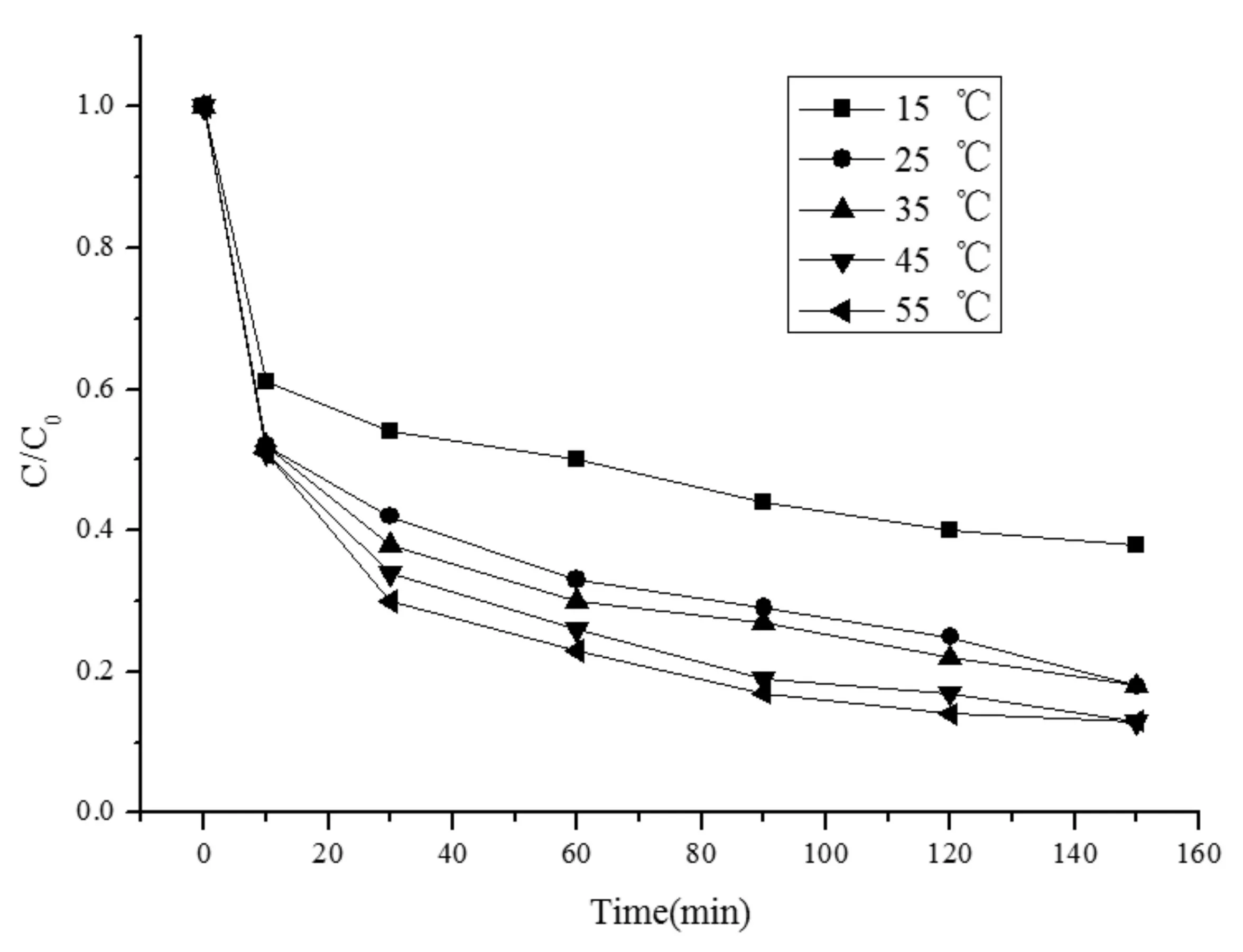
图4 不同温度下MO降解率Fig.4 Effects of temperature on the degradation rate of MO
由图4和表4可知,MO溶液降解率随着温度的升高而升高,反应表观速率常数k则由0.0022 min-1增加到0.0096 min-1。用分子动力学解释,温度升高,分子就能获得更多的能量,分子间的运动碰撞的频率提高,即分子的有效碰撞频率得到提高,促使反应速率加快[19-21]。
由公式(2)可知,假设k与温度之间符合下式:
k=kTexp(-Ea/RT)
(5)
根据表3的数据,对lnk与1/T之间进行拟合,可得Ea=4838.7 J·mol-1。
2.5 MO溶液初始浓度对MO降解的影响
在25 ℃,PDS投加量0.912 mmol/L,Fe0投加量0.16 g/L,pH=4的条件下,考察不同初始MO浓度下,反应体系对MO的降解情况及动力学拟合结果见图5和表5。

表5 MO初始浓度对表观速率常数的影响Table 5 Kinetic parameter of degradation of MO at different initial concentrations
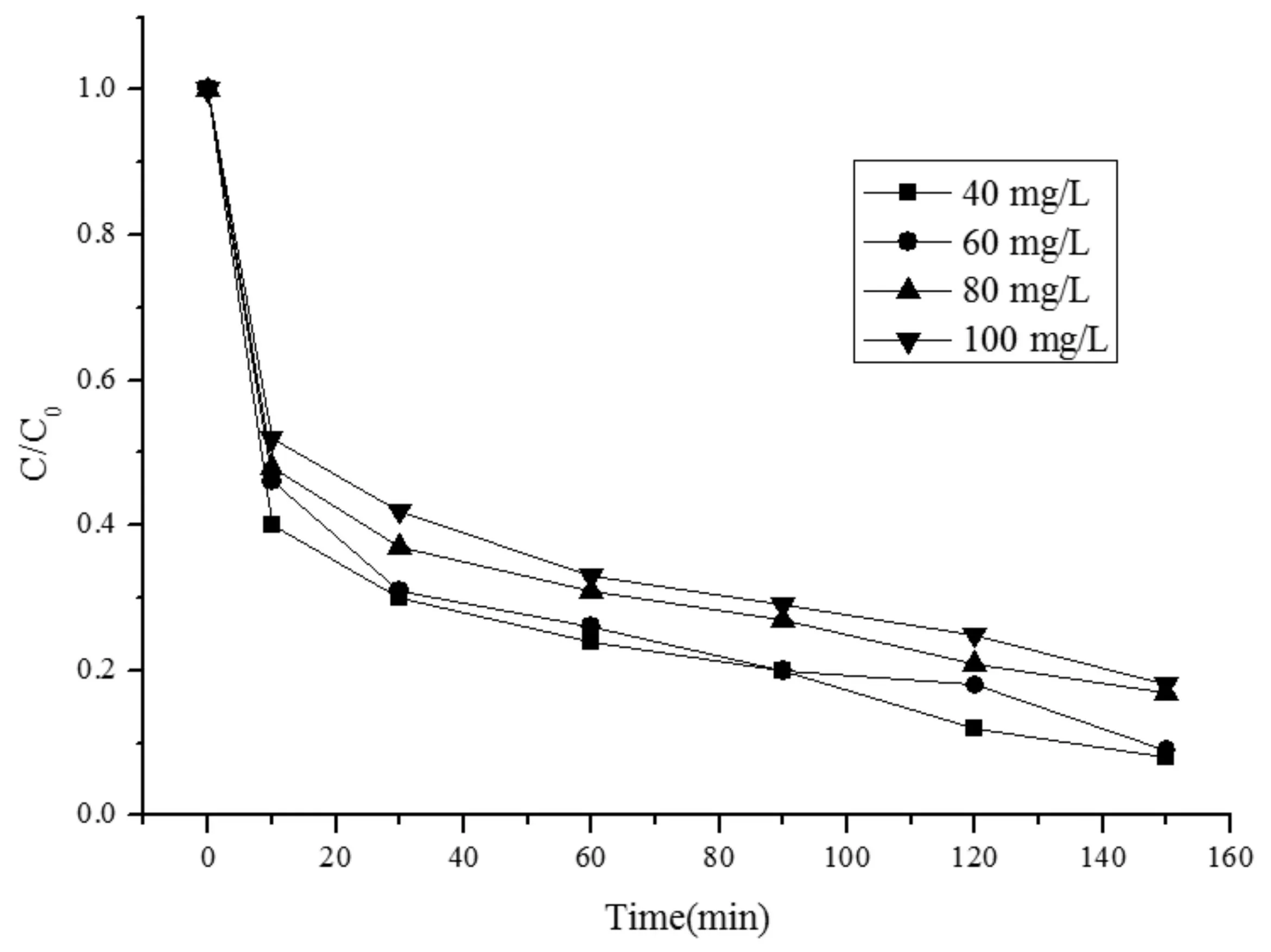
图5 MO初始浓度对降解率的影响Fig.5 Effects of initial concentration on the degradation rate of MO
由图5和表5可知MO浓度从40 mg/L上升到100 mg/L,反应150 min后降解效率分别为92.5 %、92.1 %、83.5 %、81.3 %,k值则从0.018 min-1下降到0.0067 min-1。由于体系中Fe0和PDS的投加量一定时,产生的·SO4-数量相同,与MO反应相同,但是随着MO初始浓度增大,该反应比例就减小。因此降解速率下降。
由公式(2)可知,k与MO初始浓度之间符合下式:
k=kc[c0]a
(6)
根据表5,对其进行拟合,可得kc=5.46,a=0.2004。
综上,在pH=4、初始浓度40~100 mg/L、PDS投加量0.304~1.51 mmol/L、Fe0投加量0.04~0.32 g/L、温度15~55 ℃时,Fe0/PDS体系降解MO溶液符合一级动力学反应:
k=0.0894exp(-4838/RT)[c0]0.2004[PDS]0.0876
[Fe0]0.712
(7)
由上式可知,MO初始浓度、PDS投加量、Fe0投加量三者对降解率影响顺序分别为PDS投加量 Fe0活化过硫酸盐体系在偏酸性条件下,有利于该过硫酸盐体系对MO溶液的降解;适量增加PDS或Fe0可以促进体系对MO的降解,k也随着增大。温度越高,MO溶液的降解速率越大。在pH=4,MO初始反应浓度为100 mg/L时,PDS投加量为0.912 mmol/L,Fe0投加量为0.16 g/L时,体系反应150 min后的降解率为81.9%,表观反应速率常数k为0.067 min-1。 Fe0活化过硫酸盐体系对MO溶液的降解符合一级反应动力学规律,且反应条件对降解率影响顺序分别为PDS投加量 k=0.0894exp(-4838/RT)[c0]0.2004[PDS]0.0876 [Fe0]0.7123 结论
