来氟米特脂质体凝胶的工艺优化及体外透皮吸收实验研究
2020-12-03姜海涛杨欣冉金家乐
姜海涛,杨欣冉,金家乐
(1. 云南大学 建筑与规划学院,云南 昆明 650500;2. 河南大学 药学院,河南 开封 475004)
类风湿性关节炎(rheumatoid arthritis,RA)是一种未明病因的难治性自身免疫性疾病[1],致残率很高,在风湿类患者中造成的伤害也最大。我国至少有500万类风湿性关节炎患者,其中以女性居多[2]。常见的用于治疗类风湿性关节炎的药物主要以非甾体类抗炎药和糖皮质激素为主,来氟米特是目前治疗类风湿性关节炎的一线药物。
来氟米特(leflunomide,LFMD)的化学名称为N-(4-三氟甲基苯基)-5-甲基异噁唑-4-羧酰胺[3],是一种异噁唑类的抗增殖活性免疫调节剂,其半衰期(t1/2)为15 d,该药也可以作为解热镇痛、非甾体抗炎药使用[4],主要通过抑制二氢乳清酸脱氢酶活性进而影响淋巴细胞合成嘧啶[5]。来氟米特结构中的异噁唑环在碱性条件或酶的作用下易开环,从而可增强药物疗效。1998年来氟米特由德国Hoechst Marion Roussel公司研发并获得美国FDA批准上市[6],主要用于治疗成人类风湿性关节炎。除此之外,该药对狼疮性肾炎、难治性肾病综合征、难治性原发性血小板减少型紫癜(ITP)、银屑病、干燥综合征、大疱性类天疱疮、Wegener肉芽肿等疾病的治疗也显示出较好的疗效[7]。临床研究显示,口服来氟米特可能引起血小板增多、恶心、腹痛、腹泻、胸痛、高血压、头晕、头痛、骨痛、全血细胞或白细胞减少、肌肉痉挛等不良反应[8-9]。为减少这些不良反应拟将其制成外用凝胶制剂,同时提高局部用药浓度[10]。来氟米特为无臭的白色粉末或结晶,难溶于水,可溶于乙醇,易溶于甲醇、冰醋酸,属于BCS(biopharmaceutics classification system,生物药剂学分类系统)二类药物[11],将其制备成卡波姆水性凝胶时会影响其外观和均匀性。脂质体具有容易发生药物渗漏、聚集、融合等物理性质的变化[12]。因此,将来氟米特制成脂质体凝胶能提高其经皮肤吸收的疗效,同时又能显著提高来氟米特的稳定性。来氟米特脂质体凝胶是将药物包埋在球形脂质体中[13],可以通过局部给药减轻药物的不良反应。脂质体凝胶的类生物膜结构特性对皮肤几乎不产生刺激,而且还具有药物贮库效应,从而增加药物在皮肤上的滞留量[14]。
1 仪器与材料
仪器:Y92-HN超声波细胞粉碎机(宁波新芝生物科技股份有限公司)、RE-52A旋转蒸发器(上海亚荣生化仪器厂)、HC-188药检透皮释放试验仪(天津市正通科技有限公司)、ME104E电子分析天平(梅特勒-托利多仪器上海有限公司)、Zetasizer Nano-ZS90激光粒度及Zeta电位分析仪(英国马尔文仪器有限公司)、UV-2000紫外-可见分光光度计(上海双旭电子有限公司)、JB-3定时恒温磁力搅拌器(金坛市杰瑞尔电器有限公司)等。
试药:纯度为99% 的来氟米特原料药(湖北信康医药化工有限公司,批号:100571-201511)、大豆卵磷脂(上海太伟药业有限公司,批号:20150701)、胆固醇(北京化学试剂公司,批号:Q/0042-93)、体积分数为99.9% 的色谱纯甲醇(天津四友精细化学品有限公司,批号:534076)、974PNF卡波姆(美国诺誉化工上海有限公司,批号:CC91AAB549)、化学纯Tween80(天津市科密欧化学试剂有限公司)、体积分数为99.7% 的分析纯无水乙醇(天津市进丰化工品有限公司)、质量分数为99.5% 的分析纯氯化钠(天津市德恩化学试剂有限公司)、质量分数为96%的分析纯氢氧化钠(天津石英钟厂霸州市化工分厂)、体积分数为99% 的分析纯丙三醇(天津市致远化学试剂有限公司)、医用级水溶性月桂氮䓬酮(郑州市津北化工有限公司)、实验室自制蒸馏水等。
2 方法
2.1 脂质体的制备与测定
2.1.1 脂质体的制备
精密称取一定量的来氟米特原料药、大豆卵磷脂和胆固醇,置于250 mL茄型瓶中,加入20 mL甲醇,超声5 min使其溶解,置于旋转蒸发器中设定不同的水浴温度,旋蒸45 min,至瓶壁上形成一层均匀的薄膜。再用吸量管精密吸取20 mL蒸馏水,配制成水合介质,加入到上述茄型瓶中,继续在设定的温度下水合45 min,形成不透明的混悬液,即为来氟米特脂质体。
将制得的来氟米特脂质体倒入西林瓶中,在冰浴下用超声波细胞粉碎机进行细胞粉碎,每工作7 s暂停3 s,工作若干次,然后采用透析法将脂质体与游离的来氟米特分离。首先用蒸馏水冲洗手套,除去金属离子等干扰,小心扎紧透析袋的一端,将制备好的脂质体倒入透析袋中扎紧;然后将透析袋放入盛满蒸馏水的烧杯中,向烧杯中加入转子,在定时恒温磁力搅拌器上恒温搅拌6 h,第一个小时每20 min换一次蒸馏水,3次后每1 h换水一次,使游离的来氟米特与脂质体基本上分离。
2.1.2 测定波长的选择
精密称取15 mg来氟米特原料药,置于100 mL量瓶中,加甲醇稀释至刻度,超声溶解。在100 mL溶液中精密量取1 mL溶液置于10 mL量瓶内,加甲醇稀释至刻度,并摇匀。于紫外光谱仪200~400 nm波长进行紫外全波长扫描,得到来氟米特的吸收图谱。
同理,分别配制大豆卵磷脂、胆固醇和Tween80的甲醇稀溶液,测得在200~400 nm波长内的吸收图谱,以排除辅料对于来氟米特测定的干扰。
2.1.3 标准曲线的绘制
精密称取24 mg来氟米特原料药,置于100 mL量瓶中,加甲醇稀释至刻度,超声溶解。在100 mL溶液中用单道可调移液器精密吸取250、375、500、625、750、875、1 000 μL药品溶液,分别置于20 mL量瓶中,加甲醇稀释至刻度。按顺序编号并摇匀,得到质量浓度分别为3、4.5、6、7.5、9、10.5、12 μg·mL-1的溶液,采用紫外可见吸收光谱法在260 nm波长处测定各质量浓度样品的吸收图谱[15]。以来氟米特的质量浓度(ρ)为横坐标,以溶液的吸光度(A)为纵坐标,得出药物的线性关系曲线。
2.1.4 粒径、Zeta电位和包封率的测定
将经细胞粉碎后的来氟米特脂质体用激光粒度及Zeta电位分析仪测定其平均粒径和电位。记录脂质体的体积,精密吸取1 mL经透析的来氟米特脂质体,通过0.2 μm微孔滤膜注入到10 mL量瓶中,加入甲醇破乳,并定容至10 mL。在10 mL脂质体溶液中用吸量管精密吸取1 mL,置于10 mL量瓶中,再加甲醇稀释定容,并摇匀。稀释后测定吸光度,根据原脂质体体积换算出该脂质体包封的原药物含量,与称量时的加入量对比,得出被包封的来氟米特所占的比例。
2.2 脂质体处方工艺优化
2.2.1 单因素考察处方因素
固定处方中大豆卵磷脂用量为200 mg,通过变动其与胆固醇、来氟米特原料药用量(质量)比或水合介质种类制备不同处方的来氟米特脂质体,均在45 ℃ 下旋蒸和水合,且超声细胞粉碎均工作40次,以薄膜分散−透析法制得5组来氟米特脂质体。测定不同处方的脂质体的粒径、电位和包封率,综合考察各处方因素对粒径、电位和包封率的影响[16]。
2.2.2 单因素考察工艺因素
先固定来氟米特脂质体的处方组成和用量(大豆卵磷脂200 mg、胆固醇20 mg、来氟米特原料药20 mg),分别在不同温度下或不同的水合介质中成膜和水合。测定5组不同处方的来氟米特脂质体的粒径、电位和包封率,综合考察同一处方不同工艺因素对粒径、电位和包封率的影响[17]。
2.2.3 正交设计处方工艺优化
根据单因素考察的结果,筛选出大豆卵磷脂和胆固醇的质量比(A)、大豆卵磷脂和来氟米特的质量比(B)和成膜温度(C)这3个因素对脂质体制备的影响相对较大。根据这些因素各设计三个水平进行处方工艺正交设计筛选。
2.3 脂质体凝胶制剂的体外试验
2.3.1 脂质体凝胶剂的制备
称取974PNF卡波姆0.4 g,加入到100 mL蒸馏水中充分溶胀约5 h。精密称取0.1 g来氟米特原料药,将其溶于20 mL乙醇中,记为Ⅰ组。将按上述最优处方和工艺制备的来氟米特脂质体100 mL记为Ⅱ组。向制备的来氟米特脂质体中分别加入2 mL水性氮酮、8 mL丙三醇和20 mL氢氧化钠溶液(4 g·L-1)[18],并与溶胀的卡波姆凝胶混合。为防止产生大量气泡,沿逆时针方向缓缓搅拌,分别得到来氟米特卡波姆水性凝胶和脂质体凝胶。
2.3.2 透皮给药试验
取体质量适中的成年健康大鼠,拉断颈椎致死,用于制备游离鼠皮。剪开并剥离腹部皮肤,并剔除其皮下脂肪组织,用剪刀小心剪除鼠皮的毛,不得划伤其皮肤。将处理好的鼠皮在生理盐水中洗净,在密封小袋中倒入生理盐水,将鼠皮浸入其中,密封,置于冰箱中冷藏备用[19]。
剪出两块适当面积的鼠皮,分别固定在Frans池中[20]。在甲、乙供给池中分别涂抹来氟米特普通凝胶和脂质体凝胶,在接收池中倒满生理盐水,加入转子匀速搅拌,并采用(32.2 ± 0.5)℃(大鼠体温)的循环水浴进行恒温,分别在1、2、4、6、8、12、24 h吸取5 mL,并补充同体积的生理盐水,测定各试验样品的吸光度,通过线性关系方程计算药物浓度,更换鼠皮重复试验5组求均值。
3 结果
3.1 药物的紫外测定波长与标准曲线
来氟米特紫外全波长扫描图谱见图1,图中1号波峰处的波长为260 nm,2号波谷处的波长为233 nm,且辅料峰对来氟米特的测定不构成干扰。故选择最大吸收波长260 nm作为样品质量浓度的测定波长。来氟米特的标准曲线见图2,测得标准曲线的线性范围:3~12 μg·mL-1,所得线性方程:A= 0.073ρ-0.099 4,相关系数R为0.999 4,表明线性关系较为良好。
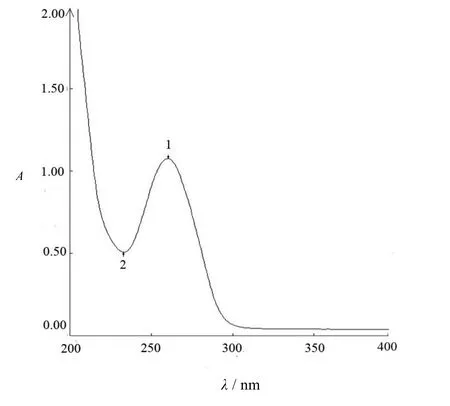
Fig. 1 Ultraviolet absorption wavelength scanning of leflunomide图 1 来氟米特紫外全波长扫描

Fig. 2 Standard curve of leflunomide图2 来氟米特的标准曲线
3.2 单因素考察试验结果
单因素考察结果见表1,各因素均通过方差检验,有显著差异。由表1的结果可知,药物浓度对包封率有较大影响,胆固醇用量对电位有较大影响,水合介质的种类对粒径有较大影响,对包封率和电位影响不大,可能是加入表面活性剂后水合更加完全,提高了脂质体的浓度。成膜温度的高低对包封率(encapsulation rate,ER)、粒径(d)和Zeta电位(ξ)都有较大影响,而超声波细胞粉碎时间对平均粒径有较大影响。

Table 1 Optimization and comparison of formulation process factors表 1 处方工艺因素优化对比
3.3 正交设计试验结果
正交试验结果见表2、3、4。包封率主要受大豆卵磷脂和药物的用量比(B)、成膜温度(C)这两个因素的影响(B > C > A);平均粒径主要受成膜温度的影响较大(C > B > A);Zeta电位也主要受成膜温度的影响(C > B > A)。筛选得到的最优组合为A3B2C3、A3B1C3、A3B2C3,仅第二组略有不同,然而在测定平均粒径时,药脂比仅作为次要的影响因素,且适当提高投药量可以提高其包封率,增加含药量。综上,该正交试验的最优组合为A3B2C3,确定的最佳处方为大豆卵磷脂200 mg、胆固醇30 mg、来氟米特原料药20 mg,用体积分数为0.5% 的Tween80溶液作为水合介质;最优工艺为55 ℃ 旋蒸和水合,超声波细胞粉碎设置工作次数为40次,每工作7 s,暂停3 s。镜下对比检验结果显示,该处方工艺制备的脂质体其变形、泄露和集聚的比例均低于平均水平。

Table 2 Orthogonal factor level table表 2 因素水平表

Table 3 The result of the orthogonal experiment表 3 正交试验结果

Table 4 Orthogonal design range analysis表 4 正交设计极差分析
3.4 最优处方工艺验证
按上述处方工艺,采用薄膜分散-透析法制备10批来氟米特脂质体,并测定其粒径、电位和包封率,结果见表5。制得脂质体的粒径、电位和包封率的RSD均小于3%,说明此工艺处方稳定可靠。处方中由于胆固醇用量较大,使得负电性相对较强,因此使来氟米特脂质体更加稳定。虽然脂质体浓度增大会引起平均粒径增大,但处方中各组分的用量不能过少,使载药量适中,可确保来氟米特脂质体的质量。

Table 5 Optimal formulation and process verification表 5 最优处方工艺验证
3.5 透皮给药试验结果
透皮给药后药物溶出量(Q)与时间曲线见图3所示,重复试验数据通过t检验,服从正态分布。由图3可知,普通凝胶药物吸收开始时基本能呈线性,2 h后吸收速率逐渐减慢;而脂质体凝胶药物吸收基本保持线性,在较长时间后的透皮扩散也只是略有减慢。开始时2 h,脂质体凝胶透皮效果仅略强于普通凝胶,之后随着普通凝胶的透皮吸收减慢,与脂质体凝胶的差距渐渐拉开。脂质体的磷脂膜具有提高药物溶解度的作用,较药物在乙醇中的溶解度要高,且与皮肤的脂质双层类似,具有很好的生物相容性和生物稳定性,很容易透过皮肤[21]。同时,脂质体凝胶还具有药物贮库效果,使来氟米特能以相对均匀的速率释放。

Fig. 3 The dissolution curve of transdermal absorption图 3 透皮给药溶出曲线
4 讨论
a. 经搅拌制备的脂质体凝胶的透明度和均匀度要好于普通凝胶,在镜下多数呈现球形,且渗漏比例通过样方计数,约为40%,而脂质体乙醇溶液渗漏率高达70% 以上。该脂质体凝胶在多数物理性质方面得到了优化。
b. 由于来氟米特本身的理化性质,普通口服制剂的溶出成为限速步骤,且不良反应较多,对于多数需要长期治疗的类风湿性关节炎等免疫性疾病的效用很差。将其制成脂质体凝胶制剂,脂质体各处方工艺因素对其各个性状的影响程度不同,整体来看,主要受投料比和成膜温度的影响较大。但脂质体的综合评价指标较难确定,一般含药量较多的脂质体平均粒径较大,而过分稀释会使得包封药量过少,实用性不强。如果通过增加细胞粉碎时间来减小粒径,则会引起被包封药物的泄露,从而降低包封率。Zeta电位是由胆固醇的加入而产生的,较高的电位会使来氟米特脂质体更加稳定,但是加入大量胆固醇会引起脂质体刚性过强,进而使柔性的磷脂难以包封药物。鉴于此,需要对不同性质的脂质体开展体外试验,研究其与透皮吸收速率的相关性。
c. 脂质体凝胶选择了能较好被皮肤吸收且涂抹舒适的卡波姆水性凝胶,酸性的卡波姆与氢氧化钠中和、增稠形成了透明均匀的凝胶剂。借助凝胶对脂质体的包埋作用,使凝胶分布于脂质体的四周,脂质体以扩散和溶蚀的方式释放药物,其不仅仅在释放速率上优于普通凝胶,而且在缓释、控释方面也具有优势,在12 h内释药基本呈线性,能大大减少用药频率,且维持在一定药物浓度水平,防止释药过程由快到慢,避免体内药物浓度出现时高时低的情况。
d. 脂质体凝胶的不足之处:对于脂质体的影响因素尚不能完全考虑,例如:水合介质的种类、旋蒸的转速和时间、水合的转速和时间、超声细胞粉碎机的工作频率、透析的温度与时间等。脂质体凝胶在实际应用中很受限制,脂质体需要在低温条件下保存,大大增加了其在实际运输、储存中的成本。
